一种合成N-芳基-3,4-二取代异喹啉酮类化合物的方法
2019-05-13
(浙江工业大学 化学工程学院,浙江 杭州 310014)
异喹啉酮类化合物是一类普遍存在于自然界的重要杂环化合物,其衍生物具有广泛的生物活性和独特的药理活性,如舒张血管[1]、抗肿瘤[2]、抗菌消炎[3]、抗高血压[4]和抗心律失常[5]等。关于异喹啉酮类化合物的研究一直是有机合成化学和药物合成化学领域的研究热点之一[6]。近年来,已有很多关于异喹啉酮类化合物合成方法的报道,由最初需要特定结构底物、反应产率较低和选择性较差的重排反应[7-9],如异喹啉N氧化物的重排、Schmidt重排、Curtius重排、Pummerer重排和Beckmann重排等,到反应高效、条件温和、价格昂贵的过度金属催化反应[10-14],如钯、酮、钌、铑、镍等。关于异喹啉酮类化合物的合成方法研究从未间断,开发简单高效的异喹啉酮类化合物合成方法将长期备受关注。而含碳碳三键的分子内环化反应是构建各种杂环的有效方法。当碳碳三键周围有亲核基团,如氮、氧原子时,可以发生对炔基的亲核加成或金属催化反应,实现含氮或含氧杂环的构建[15-17]。该类方法具有原料简单易得、反应条件温和等特点,其中含炔基的底物通常可以通过经典的Sonogashira偶联反应得到。目前,关于该类方法的报道主要是以氮、氧原子作为亲核基团,而以碳负离子作为亲核基团进攻炔基完成环合的报道不多。2015年,Chen等[18]报道了DBU促进邻炔丙醇苯甲酰胺化合物制备异喹啉酮化合物的方法,实现了以碳负离子作为亲核基团完成对炔基的亲核加成反应,得到异喹啉酮化合物。
本研究以邻碘苯甲酸为起始原料,经过酰胺化反应得到邻碘苯甲酰胺化合物,再与含炔基化合物在钯、铜金属催化下发生Sonogashira偶联反应,最后在强碱NaH作用下实现关环,得到一系列异喹啉酮类化合物,反应线路简单高效,易于引入多种目标基团。
1 实验部分
1.1 仪器与试剂
AVANCE III 500 MHz 型核磁共振谱仪,Bruker;Agilent 1200-6210型TOF LC /MS,Agilent;R-210型旋转蒸发仪,BUCHI;EL204型电子天平,梅特勒-托利多仪器(上海)有限公司。
苯乙炔,DBU(AR,百灵威试剂);二氯亚砜、碘化亚铜、氢化钠(AR,阿拉丁试剂);氯化钠、碳酸钾、无水硫酸镁(AR,上海四赫维化工有限公司);三乙胺、乙腈、乙酸乙酯、二氯甲烷、四氢呋喃、甲醇(AR,上海凌峰化学试剂有限公司);PdCl2(PPh3)2,t-BuOK(实验室自制);氮气(99.999%,今工气体有限公司)。所用溶剂均按常规方法进行除水处理。
1.2 实验过程
N-芳基-3,4-二取代异喹啉酮类化合物的反应线路为

1.2.1 邻炔苯甲酰胺化合物2的合成
N2保护和室温条件下,向50 mL干燥的两口烧瓶中分别加入邻碘苯甲酰胺化合物1(1 mmol),苯乙炔(1.2 mmol),PdCl2(PPh3)2(0.05 mmol),CuI(0.05 mmol),再分别加入乙腈和三乙胺各3 mL,开始搅拌后,逐渐升温至80 ℃,TLC监测反应进程,反应时间约4 h。反应结束后,旋蒸浓缩,加入饱和氯化钠水溶液和乙酸乙酯进行萃取,无水硫酸镁干燥,旋蒸浓缩,柱层析,淋洗剂为:V(石油醚)∶V(乙酸乙酯)=5∶1,得到邻炔苯甲酰胺化合物2。
1.2.2 N-芳基-3-酯基-3,4-二取代异喹啉-1(2H)-酮化合物3的合成
N2保护条件下,向25 mL干燥的两口烧瓶中加入邻炔苯甲酰胺化合物2(0.3 mmol),乙腈2 mL,开始搅拌,直到化合物2溶解后再加入4当量的NaH,50 ℃条件下继续搅拌,TLC监测反应进程,反应时间约1 h。反应结束后,将反应液浓缩,加入饱和氯化钠水溶液和乙酸乙酯进行萃取、无水硫酸镁干燥、浓缩、TLC分离,得到N-芳基-3-酯基-3,4-二取代异喹啉-1(2H)-酮化合物3。
2 结果与讨论
2.1 成环条件的优化
选择合适的碱是以碳负离子作为亲核基团进攻碳碳三键完成分子内环化反应的关键。以2a作为环合目标产物,考察不同的碱、溶剂和反应时间对环合目标产物产率的影响,从而筛选出最优反应条件,筛选结果见表1。
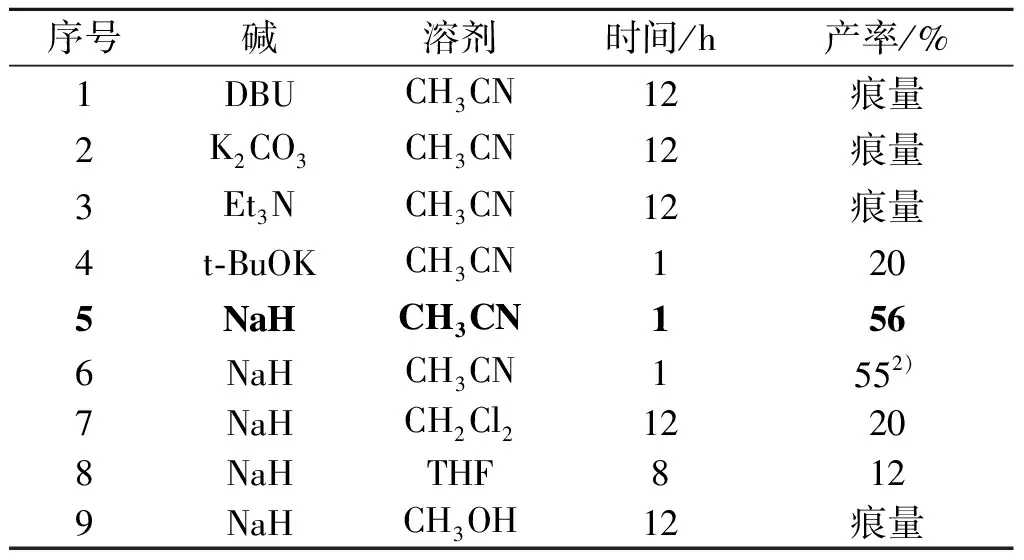
表1 成环条件的优化1)Tabel 1 Optimization of conditions for cyclization
注:1) 反应条件为底物0.3 mmol,碱4 当量,溶剂2 mL,50 ℃,N2;2) 反应条件为底物0.3 mmol,碱5 当量,溶剂2 mL,50 ℃,N2。
从表1中可以看出:当以CH3CN为溶剂,50 ℃时,选择DBU,K2CO3,Et3N作为碱,即使反应12 h,升高温度都只有痕量目标产物生成(序号1,2,3);尝试加大碱性,当选择t-BuOK作为碱,反应1 h,目标产物产率为20%(序号4);而选择NaH作为碱时,同样反应了1 h,目标产物的产率有了较大幅度的提升(序号5);接着将碱的当量提升到5当量(序号6),发现产率没有明显提升。于是,确定使用NaH作为碱,反应时间为1 h,随后对溶剂进行了简单筛选(序号7,8,9),最终确定了最优的反应条件:50 ℃,NaH(4当量)作为碱,CH3CN作为溶剂,反应时间为1 h。
2.2 底物拓展
根据最优反应条件,接下来尝试对带有不同取代基的底物进行拓展,结果如表2所示。结果表明:含不同取代基的R1对环合产率的影响较大,当R1为吸电子基时比供电子基的产率要高,其中以间位氯取代产率最高。

表2 成环反应底物拓展1)Table 2 The substrate expansion of cyclization
注:1) 反应条件为底物0.3 mmol,NaH 4 当量,CH3CN 2 mL,50 ℃,反应时间1 h,N2。
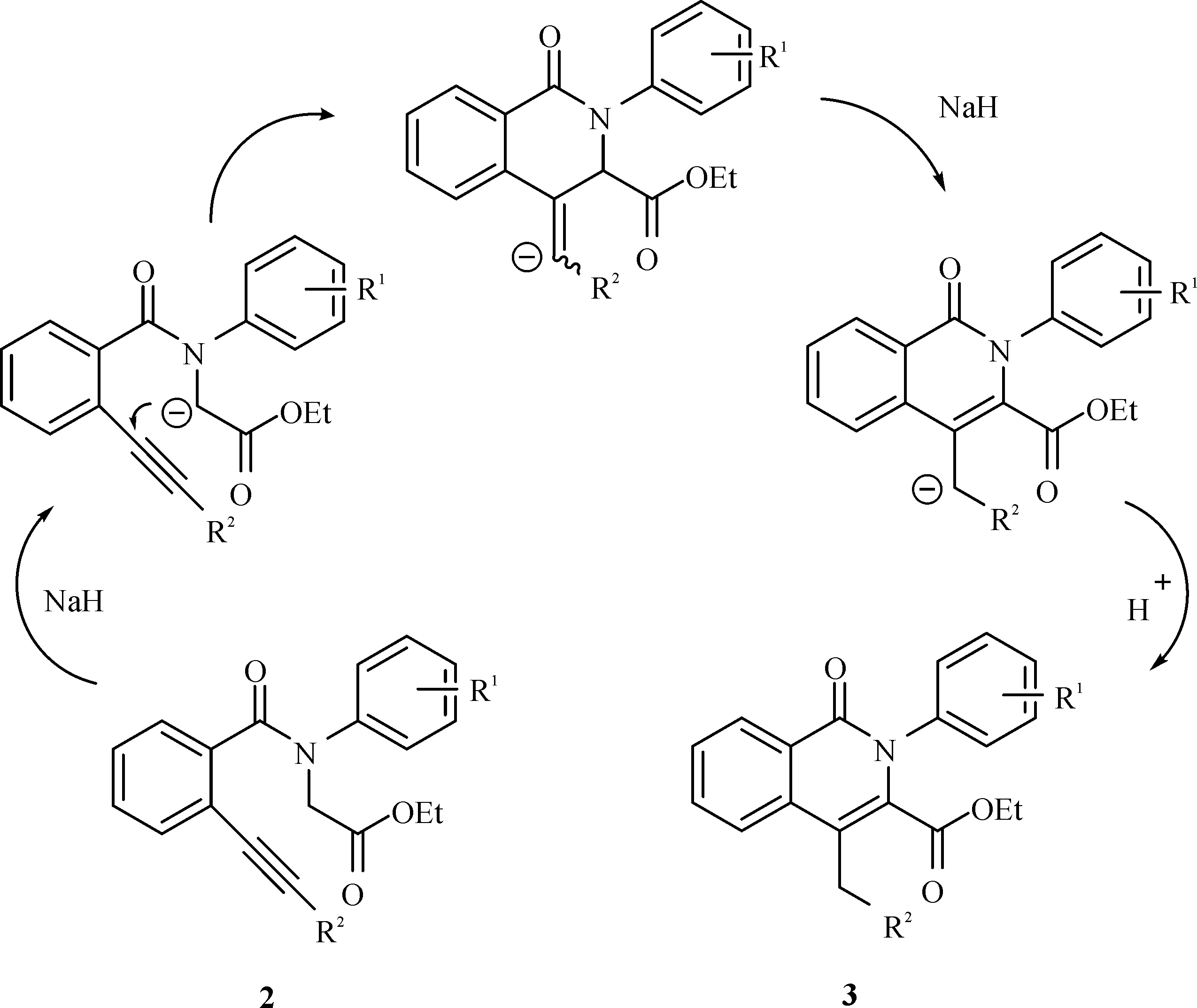
2.3 反应机理讨论
将结构3化合物作为环合目标产物进行条件筛选,最终发现在NaH作用下,产物产率较高。其可能的反应路径是结构2化合物在NaH作用下生成碳负离子,随后进攻炔基上靠近苯环的碳,生成环合产物,进一步在NaH作用下发生环外双键异构,得到目标环合结构3化合物,可能的反应机理为
2.4 产物表征
4-苄基-1-氧代-2-苯基-1,2-二氢异喹啉-3-乙酸乙酯(2a):黄色固体(56%);1H NMR(500 MHz, CDCl3):δ为8.51 (d,J=7.6 Hz, 1H), 7.65 (d,J=7.9 Hz, 1H), 7.62 (td,J1=8.0 Hz,J2=1.2 Hz, 1H), 7.55-7.43 (m, 6H), 7.34-7.29 (m, 4H), 7.22 (t,J=6.7 Hz, 1H), 4.14 (s, 2H), 3.87 (q,J=7.2 Hz, 2H), 0.87 (t,J=7.2 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.4, 161.5, 139.0, 138.8, 136.1, 135.2, 132.9, 129.0, 128.8, 128.7, 128.6, 128.1, 127.9, 126.8, 126.4, 124.8, 113.0, 62.0, 34.0, 13.4; HRMS-ESI: [M+H]+理论值C25H22NO3384.160 0, 实测值384.159 7。
4-(4-甲基苄基)-1-氧代-2-苯基-1,2-二氢异喹啉-3-乙酸乙酯(2b):黄色固体(49%);1H NMR (500 MHz, CDCl3):δ为8.51 (d,J=7.9 Hz, 1H), 7.67 (d,J=8.1 Hz, 1H), 7.62 (t,J=7.2 Hz, 1H), 7.55-7.49 (m, 3H), 7.45 (d,J=7.7 Hz, 3H), 7.22 (d,J=7.8 Hz, 2H), 7.12 (d,J=7.7 Hz, 2H), 4.10 (s, 2H), 3.88 (q,J=7.1 Hz, 2H), 2.32 (s, 3H), 0.89 (t,J=7.1 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.4, 161.5, 138.8, 136.1, 135.9, 135.0, 132.8, 129.3,129.0, 128.8, 128.7, 128.6, 128.0, 127.8, 126.8, 124.8, 113.2, 61.9, 33.6, 21.0, 13.4;HRMS-ESI: [M+H]+理论值C26H24NO3398.175 6, 实测值398.174 1。
4-(4-氯苄基)-1-氧代-2-苯基-1,2-二氢异喹啉-3-乙酸乙酯(2c):黄色固体(40%);1H NMR (500 MHz, CDCl3):δ为8.52 (d,J=7.9 Hz, 1H), 7.63 (dt,J1=7.6 Hz,J2=1.2 Hz, 1H), 7.58-7.53 (m, 2H), 7.50 (d,J=7.8 Hz, 2H), 7.46 (d,J=7.3 Hz, 1H), 7.43 (d,J=7.3 Hz, 2H), 7.28-7.24 (m, 4H), 4.09 (s, 2H), 3.87 (q,J=7.2 Hz, 2H), 0.87 (t,J=7.1 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.3, 161.5, 138.7, 137.5, 135.8, 135.4, 133.0, 132.3, 129.5, 129.1, 128.9, 128.8, 128.1, 126.9, 124.6, 112.5, 62.1, 33.4, 13.4; HRMS-ESI: [M+H]+理论值C25H21ClNO3418.121 0, 实测值418.121 2。
4-苄基-1-氧代-2-(对甲苯基)-1,2-二氢异喹啉-3-乙酸乙酯(2d):黄色胶体(54%);1H NMR (500 MHz, CDCl3):δ为8.51 (dd,J1=7.8 Hz,J2=1.1 Hz, 1H), 7.64 (d,J=8.1 Hz, 1H), 7.61 (td,J1=8.1 Hz,J2=1.3 Hz, 1H), 7.52 (dt,J1=7.4 Hz,J2=1.5 Hz, 1H), 7.33-7.28 (m, 8H), 7.21 (t,J=6.8 Hz, 1H), 4.13 (s, 2H), 3.91 (q,J=7.1 Hz, 2H), 2.43 (s, 3H), 0.91 (t,J=7.2 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.5, 161.7, 139.0, 138.8, 136.1, 135.4, 132.8, 129.6, 128.7, 128.6, 128.5, 128.1, 127.8, 126.8, 126.4, 124.7, 112.6, 61.9, 34.0, 21.2, 13.4; HRMS-ESI: [M+H]+理论值C26H24NO3398.175 6, 实测值398.176 3。
4-苄基-2-(4-氯苯基)-1-氧代-1,2-二氢异喹啉-3-乙酸乙酯(2e):黄色固体(67%):1H NMR (500 MHz, CDCl3):δ为8.50 (d,J=7.9 Hz, 1H), 7.66-7.61 (m, 2H), 7.54 (t,J=7.6 Hz, 1H), 7.48 (d,J=8.5 Hz, 2H), 7.39 (d,J=8.5 Hz, 2H), 7.31 (d,J=4.3 Hz, 4H), 7.24-7.21 (m, 1H), 4.14 (s, 2H), 3.94 (q,J=7.1 Hz, 2H), 0.94 (t,J=7.1 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.2, 161.4, 138.8, 137.2, 136.0, 134.8, 134.7, 133.0, 130.2, 129.2, 128.7, 128.6, 128.1, 126.7, 126.5, 124.9, 113.4, 62.1, 34.0, 13.5; HRMS-ESI: [M+H]+理论值C25H21ClNO3418.121 0, 实测值418.119。
4-苄基-2-(4-溴苯基)-1-氧代-1,2-二氢异喹啉-3-乙酸乙酯(2f):黄色固体(66%):1H NMR (500 MHz, CDCl3):δ为8.49 (d,J=7.9 Hz, 1H), 7.64 (d,J=8.6 Hz, 4H), 7.54 (dt,J1=7.3 Hz,J2=1.6 Hz, 1H), 7.33 (d,J=8.6 Hz, 2H), 7.30 (d,J=4.4 Hz, 4H), 7.24-7.20 (m, 1H), 4.14 (s, 2H), 3.94 (q,J=7.1 Hz, 2H), 0.94 (t,J=7.1 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.3, 161.4, 138.9, 137.8, 136.0, 134.7, 133.1, 132.2, 130.5, 128.7, 128.6, 128.1, 126.7, 126.5, 124.9, 122.9, 113.5, 62.2, 34.0, 13.5; HRMS-ESI: [M+H]+理论值C25H21BrNO3462.070 5, 实测值462.069。
4-苄基-1-氧代-2-(间甲苯基)-1,2-二氢异喹啉-3-乙酸乙酯(2g):黄色固体(44%):1H NMR (500 MHz, CDCl3):δ为8.51 (d,J=7.3 Hz, 1H), 7.65-7.59 (m, 2H), 7.53 (dt,J1=7.3 Hz,J2=1.5 Hz, 1H), 7.38 (t,J=8 Hz, 1H), 7.31 (d,J=6.8 Hz, 4H), 7.26-7.22 (m, 4H), 4.14 (s, 2H), 3.92-3.87 (m, 2H), 2.43 (s, 3H), 0.89 (t,J=7.1 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.4, 161.6, 139.1, 139.0, 138.6, 136.1, 135.3, 132.8, 129.6, 129.4, 128.8, 128.7, 128.6, 128.1, 127.8, 126.8, 126.4, 125.7, 124.8, 112.8, 61.9, 34.0, 21.3, 13.4; HRMS-ESI: [M+H]+理论值C26H24NO3398.175 6, 实测值398.173 9。
4-苄基-2-(3-氯苯基)-1-氧代-1,2-二氢异喹啉-3-乙酸乙酯(2h):黄色固体(80%):1H NMR (500 MHz, CDCl3):δ为8.50 (d,J=7.9 Hz, 1H), 7.67-7.61 (m, 2H), 7.54 (dt,J1=7.3 Hz,J2=1.0 Hz, 1H), 7.49 (s, 1H), 7.45 (d,J=5.1 Hz, 2H), 7.35 (td,J1=4.5 Hz,J2=1.9 Hz, 1H), 7.31 (d,J=4.4 Hz, 4H), 7.25-7.21 (m, 1H), 4.15 (s, 2H), 3.95 (q,J=7.0 Hz, 2H), 0.94 (t,J=7.1 Hz, 3H);13C NMR (125 MHz, CDCl3):δ为163.2, 161.3, 139.8, 138.8, 136.0, 134.6, 133.1, 130.0, 129.3, 129.1, 128.6, 128.1, 127.1, 126.6, 126.5, 124.9, 113.5, 62.2, 34.0, 13.4; HRMS-ESI: [M+H]+理论值C25H21ClNO3418.121 0, 实测值418.120 3。
3 结 论
成功建立了一种以碳负离子作为亲核基团进攻炔基完成环合反应得到异喹啉酮类化合物的方法,以邻碘苯甲酰胺化合物与含炔基化合物在钯、铜金属催化下发生Sonogashira偶联反应得到多取代的邻炔苯甲酰胺乙酸酯化合物,随后在NaH促进作用下生成了相应的N-芳基-3-酯基-3,4-二取代异喹啉-1(2H)-酮化合物。该方法不仅具有操作简单、原料简单易得和反应条件温和等优点,更重要的是易于引入多种取代基团,为异喹啉酮类化合物的结构修饰和衍生化发展提供了一种十分有效的方法。
