jet基因与时差对果蝇寿命的调控研究
2019-05-10张佳星
张佳星,平 勇
(上海交通大学 生命科学技术学院,上海 200240)
随着社会的进步,人们对于健康的重视不断加强,各项生物学研究也在不断更新着我们对于健康及寿命的认识,然而生物钟的重复相移对健康的影响却少有研究[1].现今,跨时区旅行以及轮班工作已司空见惯,由此我们难免会产生时差反应.受时差反应困扰的人不在少数,而经常跨时区出行使得人们不由担心自己的身体健康,担心记忆力衰退、身体代谢水平下降等一系列问题[2].我们已知时差反应会降低神经敏锐度,导致许多疾病的患病风险提高,其中一些疾病的患病几率会随着时间的推移日益累积,从而导致对身体健康的累积性伤害,因此也就提高了探究时差反应对健康影响的必要性[3].毫无疑问,哺乳动物和果蝇的生活史存在较大差异,但鉴于其基本生物学过程的相似性,哺乳动物和果蝇中可能会存在具有统一性的有效延长寿命的机制.因此,果蝇的寿命研究可能会对哺乳动物(包括人类)类似机制的分析提供有用性参考[4].果蝇一直是理想的节律、睡眠与寿命机制分析的动物模型,我们可以通过突变体果蝇了解时差反应和果蝇体内的时差蛋白对于寿命的影响,从而为针对性探究倒时差的环境对人体生理反应的影响提供实验和理论支持[5].
从蓝细菌到人类的大部分生物体中,都发现具有约为24h周期性的内生性昼夜节律钟.生物体节律通常更接近LD周期(12h光照∶12h黑暗),更接近它们的自然昼夜节律,这样的内生性昼夜节律钟可能使内部和外部节律之间的时差最小化[6].近年来,“时钟基因”家族的克隆和特征研究,提高了我们对于果蝇及哺乳动物生物钟分子机制的理解.其中,Cry蛋白(Cryptochrome是一种蓝光感受器[7-9])通过Jet蛋白(Jetlag是一种F-box蛋白[3])和启动分子时钟重置的蛋白酶体,介导Tim蛋白(Timeless是一种光依赖时钟蛋白[10-11])的快速光依赖性降解.当果蝇暴露于光照条件下,体内的Jet蛋白使其对光照敏感,从而对光照做出快速应答.然而,Jet蛋白的功能性丧失使得果蝇对光照不敏感,不能够对光照作出及时的应答,使得内部和外部节律不协调,从而产生时差反应.果蝇的生物钟对光照时间敏感,在大自然中,这种对光照作出快速应答的方式,使得它们将内置时钟作为一个计时设备,生理活动可以与季节变化同步,也使得它们在跨时区的时候,能够快速适应新的时区[12].已知慢性时差会加速果蝇的一种特定形式的运动老化(是一种年龄相关的运动障碍),并且这种效应可以通过改善昼夜节律所同步的环境变化而得到缓解[2].这些研究结果可能会促进治疗时差反应和睡眠障碍的发展,并且可以提高我们对时钟基因的改变在睡眠和神经精神障碍等方面所作出的遗传贡献的理解.
本研究率先利用jet基因突变体果蝇模型进行睡眠与寿命监测,从而探讨jet基因和时差环境对果蝇寿命的影响,实验结果提示了jet基因的缺失对于果蝇寿命可能产生部分影响,对于果蝇中的Jet蛋白在果蝇寿命影响中的作用具有提示性意义,其作用机制与生物学意义还有待进一步研究.
1 材料与方法
1.1 材料
实验中用到的果蝇有w1118、yw;jetc;+、yw;jetr;+ 3种基因型[3,13],均来自本实验室保种.实验中用到的果蝇活动监测系统(Drosophila Activity Monitoring System, DAMS)购于美国Trikinetics公司,普通体式显微镜购于意大利OPTIKA公司,果蝇时差反应培养的光照装置购于上海良亮灯饰电器有限公司,透明食物管购于生工生物工程(上海)股份有限公司.
1.2 方法
1.2.1 果蝇培养
果蝇在标准玉米麦芽糖糊精培养基上,12h光照∶12h黑暗(LD)环境下培养,其周期(T)为24h,光照周期为12h(即T=24h;LD 12h∶12h).所有果蝇都在明暗12h交替,温度25℃的环境中培养.实验中所用到的果蝇都挑选羽化8h以内的雄果蝇[14].
1.2.2 果蝇睡眠节律活动监测实验
挑选羽化8h以内的雄性果蝇,单只放入65mm×5mm的特制果蝇管中,置于果蝇活动监测系统(DAMS)中,每种基因型需平行测试15~30只.将环境参数设置为LD环境,早上9点灯亮,晚上9点灯灭,另一组环境参数设置为DD环境,持续黑暗.待果蝇适应环境3~5d后开始正式测试,以1min/次的频率记录下果蝇的活动次数.5~7d后结束监测,收集整理实验数据进行分析[15].果蝇的睡眠与哺乳动物类似,大多是生活在12h明暗交替的环境中,利用DAMS系统进行红外线的检测,基于果蝇每分钟的活动次数,判断及估算果蝇的睡眠时间,其测试值与实际值相比较,误差在可接受范围内,由各因素导致的睡眠水平的不同可以区分显著性.
在数据分析中,标准睡眠曲线图通过统计果蝇每30min内的平均睡眠时间绘制.果蝇睡眠时间及用于描述睡眠行为的参数计算使用R语言程序实现.正态分布的两种基因型参数的显著性差异比较采用student’st-test,多种基因型的比较则采用one-way ANOVA.两种比较分别通过Sigma Plot、SPSS统计软件实现.
1.2.3 果蝇寿命监测实验
分别挑选羽化8h以内的w1118、yw;jetc;+、yw;jetr;+ 3种基因型的雄果蝇,每种基因型的雄果蝇分别放入10个透明食物管中,每管10只果蝇.将3种基因型的果蝇各10管(共30管),放入明暗12h交替,温度25℃的培养箱中培养,此为一组.第1组果蝇在正常LD的光照周期下培养,为对照组;第2组果蝇每7d一次,调整其光照周期提前8h,其他条件与对照组一致,命名为提前组;第3组果蝇每7d一次,调整其光照周期延迟8h,其他条件与对照组一致,命名为延后组.实验开始后,在每组果蝇的光照状态下,每天记录死亡果蝇的数量,每3d更换一次食物,直至每组果蝇全部死亡,实验结束.
1.2.4 数据分析
获得的数据通过Sigma Plot、Coreldraw、Lifespan等软件分析并作图.对于寿命检测实验,先进行数据记录与数据汇总,接着将数据导入Lifespan程序包中,R语言环境为3.3.2,编程软件为R Studio.根据所统计的数据,进行生存分析,绘制不同基因型及不同生存环境下的果蝇存活率数据图.数据完全根据实验方法所获得,每组数据分析采用平均值±标准误差(mean±SEM).对于成正态分布的数据一般通过student’st-test和生存分析比较(多组).对寿命监测实验数据主要采用生存分析,分为两组比较和两组以上比较.当*P<0.05,即为有显著性差异,同时设定**P<0.01,***P<0.001.
2 结 果
2.1 w1118果蝇与yw;jetc;+、yw;jetr;+果蝇的标准睡眠曲线图比较
由于Amita Sehgal等[3]关于jet基因型的研究工作中采用了w1118野生型果蝇为对照组,进行节律分析,得出了jet突变体果蝇具有时差反应这一结论.由此,为探寻jet基因型与野生型果蝇在时差反应中对寿命的影响关系,我们也延续这一标准,采用w1118基因型的果蝇进行睡眠以及寿命实验.首先,为排除w1118与yw品系的果蝇遗传背景的影响,比较分析并统计两种基因型的果蝇每30min的睡眠时间以及白天睡眠总量、夜间睡眠总量、全天睡眠总量等,做出睡眠曲线图与睡眠柱状图(图1).

图1 w1118与yw的睡眠差异比较Fig.1 The comparison of w1118 and yw in sleep difference(a) w1118与yw的睡眠趋势图,每个点表示果蝇30min睡眠总量平均值,测试中果蝇处于LD环境.(b) w1118与yw白天、夜间及全天睡眠总量柱状图,均值比较采用one-way ANOVA检验(n.s.: 无显著性差异).
比较得出,w1118与yw品系的果蝇在睡眠节律与睡眠量等方面并无显著性差异(n.s.),由此,我们可以排除两者之间的遗传背景不同可能会给实验结果带来的影响,可以进一步利用两种jet突变体果蝇,与对照组果蝇的睡眠状况进行比较分析.
实验中将w1118作为对照组,yw;jetc;+、yw;jetr;+作为实验组,进行睡眠监测,收集整理实验数据进行分析并作图,实验结果如图2,图3所示.我们分别统计了3种基因型果蝇每30min的睡眠时间、白天睡眠总量、夜间睡眠总量、全天睡眠总量、全天睡眠次数和每段全天睡眠平均持续时间等睡眠参数来定量描述果蝇的睡眠状况.

图2 LD条件下,对照组和实验组睡眠趋势图Fig.2 Sleep trends in control and experimental groups under LD condition每个点表示果蝇30min睡眠总量平均值,测试中果蝇处于LD环境.
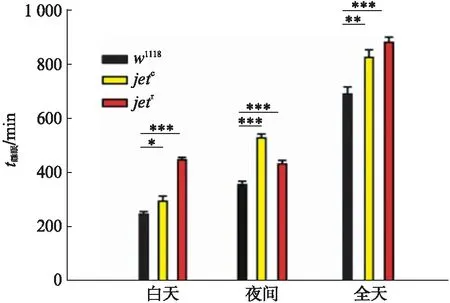
图3 LD条件下,对照组和实验组白天、夜间及全天 睡眠总量柱状图Fig.3 Bar graph of day-time, night-time, and total in control and experimental groups under LD condition均值比较采用one-way ANOVA检验,**P<0.01,***P<0.001.
由睡眠曲线可以看出,实验组的曲线位于对照组上方.分析指出,相比于对照组(w1118),实验组的果蝇(yw;jetc;+,yw;jetr;+)白天和夜间的睡眠时间均显著性增加,其中对照组白天和夜间睡眠分别为(247.9310±3.1435)min和(356.1494±3.5507)min,而实验组与之相对应的值分别有(296.0000±4.3549)min和(528.0000±3.8087)min(yw;jetc;+),(447.3846±2.9812)min和(432.3077±3.6210)min(yw;jetr;+).
根据以上数据,我们可以得出,两种jet突变体果蝇在一天中的睡眠总量均显著高于野生型果蝇,进而推测果蝇神经元内Jet蛋白功能的丧失会导致睡眠总量的升高,提示Jet蛋白本身可能在果蝇睡眠调节中发挥重要作用,生物钟环路的变化也可能与睡眠时间的延长存在相关性.
2.2 w1118果蝇与yw;jetc;+,yw;jetr;+果蝇的睡眠参数统计分析
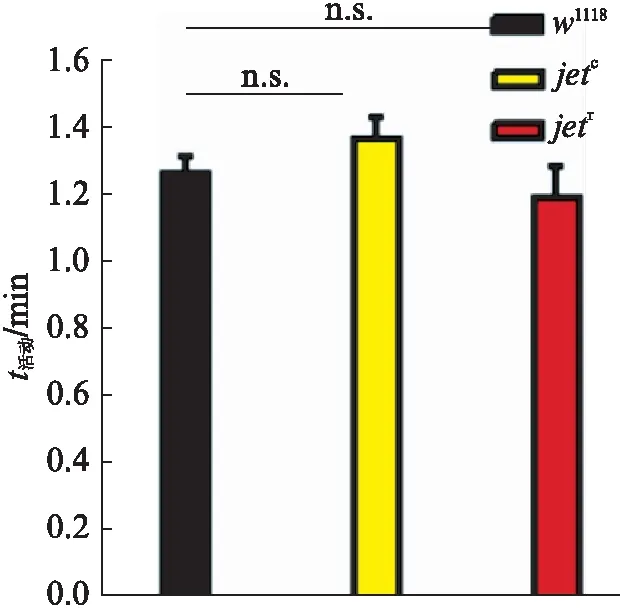
图4 LD条件下对照组和实验组平均 每分钟活动量柱状图Fig.4 Bar graph of the average activity per minute in the control and experimental groups under LD condition均值比较采用one-way ANOVA检验,n.s.: 无显著性差异.
对w1118、yw;jetc;+、yw;jetr;+基因型雄果蝇的标准睡眠数据进行分析,统计3种基因型果蝇的全天睡眠总量及睡眠次数,并得出平均睡眠时间,进行数据分析.为了排除对照组果蝇与实验组果蝇自身活动性差异可能对实验结果产生的影响,我们检测了yw;jetc;+,yw;jetr;+果蝇活动性与w1118果蝇是否一致.采用平均每分钟的活动量为参数进行比较,如图4所示.
由图4可知,yw;jetc;+,yw;jetr;+果蝇与w1118果蝇的平均每分钟活动量并无显著性差异,yw;jetc;+,yw;jetr;+果蝇的活动性表现正常,并未对睡眠量的升高造成显著影响,同时,也验证了Amita Sehgal等关于jet基因型的研究工作中的结论,jet突变体果蝇在LD条件下的活动性保持正常.因此,我们可以排除对照组果蝇与实验组果蝇自身活动性差异可能对实验结果产生的影响.
对于实验组与对照组的睡眠量进行数据分析,yw;jetc;+基因型果蝇的全天睡眠时间总量显著高于w1118果蝇(**P<0.01),且平均睡眠时间显著高于w1118果蝇(***P<0.001),从而,全天睡眠次数显著低于w1118果蝇(***P<0.001)(图5(a)).进一步分析全天睡眠参数显示,yw;jetr;+果蝇全天睡眠次数并没有发生明显的变化,而平均每段睡眠的持续时间却从平均(37.0349±1.4653)min/次提高到(48.6631±2.0521)min/次,且在统计学上具有显著性差异.yw;jetc;+果蝇全天睡眠次数显著降低,由平均(21.1609±0.8903)次降低到(13.5667±0.9455)次,而平均每段睡眠的持续时间却从平均(37.0349±1.4653)min/次提高到(76.2802±3.0607)min/次,且具有显著性差异(图5(b)).这也就意味着,两种同类型jet突变体果蝇的睡眠总量的提升是由促进了睡眠状态的维持所引起的.
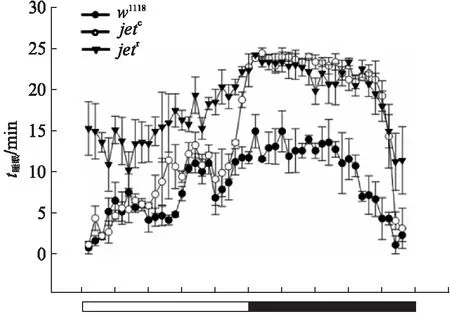
图6 DD条件下,对照组和实验组睡眠趋势图Fig.6 Sleep trends in control and experimental groups under DD condition
以上数据说明,在LD条件下,两种同类型jet突变体果蝇的睡眠时间显著高于对照组果蝇,其睡眠次数相对较少,每次睡眠持续时间较长.果蝇体内Jet蛋白的缺失可能会促进睡眠质量的提升,提示了Jet蛋白功能的缺失反而能促进果蝇睡眠的维持,出现嗜睡症状(嗜睡是果蝇中一种以睡眠量过量为特征的现象,其以白天睡眠量显著升高为主要特征).
为了进一步探究jet基因的缺失是否会对DD(Dark Dark)条件下突变体果蝇的睡眠有类似的影响,我们对置于DD条件下的w1118、yw;jetc;+、yw;jetr;+基因型的雄果蝇的标准睡眠数据进行分析,结果如图6所示.
对于DD条件下,实验组果蝇和对照组果蝇的睡眠状态,我们选用与LD条件下相同的参数进行比较分析,由睡眠曲线(图7)可以看出,实验组的曲线位于对照组上方.相比于对照组(w1118),实验组的果蝇(yw;jetc;+,yw;jetr;+)白天和夜间的睡眠时间均显著性增加,其中对照组白天和夜间睡眠分别为(162.8333±3.8602) min和(251.5000±3.7976) min,而实验组与之相对应的值分别有(205.6061±4.1871) min和(499.2424±3.5707) min(yw;jetc;+),(384.6667±4.4799) min和(497.8333±3.9815) min(yw;jetr;+).
同样的,为了排除对照组果蝇与实验组果蝇自身活动性差异可能对实验结果产生的影响,我们检测了在DD条件下yw;jetc;+,yw;jetr;+果蝇活动性与w1118果蝇是否一致.采用平均每分钟的活动量为参数进行比较,结果如图8所示.
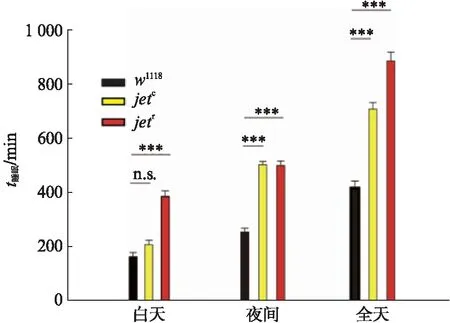
图7 DD条件下,对照组和实验组白天、夜间及全天睡眠总量柱状图Fig.7 Bar graph of day-time, night-time, and total in control and experimental groups under DD condition均值比较采用one-way ANOVA检验,***P<0.001.
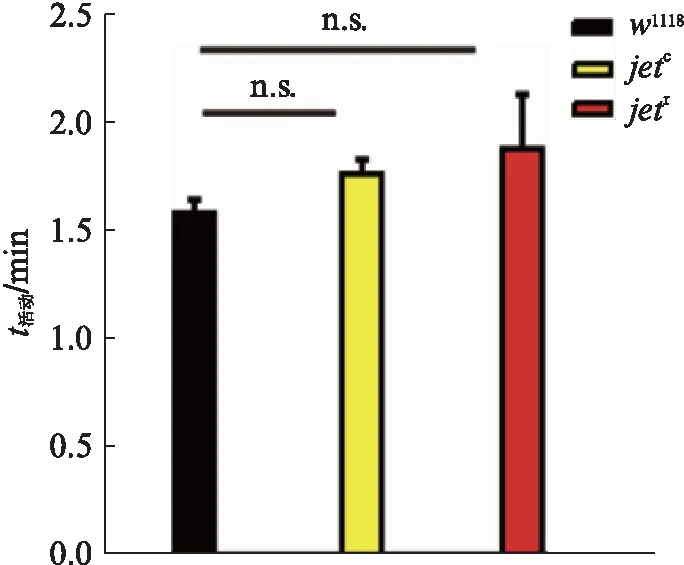
图8 DD条件下对照组和实验组平均每分钟 活动量柱状图Fig.8 Bar graph of the average activity per minute in the control and experimental groups under DD condition均值比较采用one-way ANOVA检验,n.s.: 无显著性差异.
在DD条件下,yw;jetc;+,yw;jetr;+果蝇与w1118果蝇的平均每分钟活动量并无显著性差异,突变体果蝇的活动性与对照组活动性一致,yw;jetc;+,yw;jetr;+果蝇的活动性表现正常,并未对睡眠量的升高造成显著影响.
对于实验组与对照组的睡眠量进行数据分析,与LD条件下表现相同的是,yw;jetc;+与yw;jetr;+基因型果蝇的全天睡眠时间总量均显著高于w1118果蝇(***P<0.001),且平均睡眠时间显著高于w1118果蝇(***P<0.001).全天睡眠参数(图9)显示,与w1118相比,yw;jetc;+与yw;jetr;+果蝇全天睡眠次数显著降低,由平均(37.0333±1.1304)次降低到(20.3333±1.1072)次和(26.4667±1.3661)次,而平均每段睡眠的持续时间却从平均(11.2479±0.8173) min/次提高到(39.2554±1.6289) min/次和(46.7309±3.0450) min/次,且具有显著性差异.数据表明,在DD条件下,突变体果蝇睡眠的异常与LD条件下基本保持一致.

图9 DD条件下全天睡眠次数与平均睡眠时间柱状图Fig.9 Bar graph of sleep bout number and sleep bout duration under DD condition(a) 对照组与实验组的全天睡眠次数;(b) 对照组与实验组的全天睡眠平均时间.均值比较采用one-way ANOVA检验,***P<0.001.
通过DD条件下两种突变体果蝇睡眠量和睡眠状态的分析,我们进一步验证了LD条件下的推测,果蝇体内Jet蛋白的缺失可能会促进睡眠量的增加,jet基因的缺失使得果蝇的睡眠量出现异常,出现嗜睡症状.
2.3 jet突变体果蝇的寿命曲线
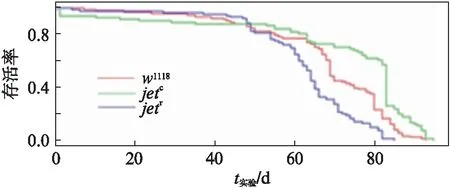
图10 正常光照下对照组与实验组的寿命曲线图Fig.10 Life curve of the control group and the experimental groups under normal light cycle conditions在正常12h∶12h光照周期情况下,野生型果蝇生存状况良好,呈现良好的寿命分布,突变体果蝇yw;jetc;+,ywjetr;+与正常果蝇的存活率呈现显著性差异(yw;jetc;+和w1118: ***P<0.001; ywjetr;+和w1118: ***P<0.001).
为了探究Jet蛋白的功能性丧失对于果蝇寿命的影响,我们首先进行了正常环境条件下的果蝇寿命监测.分别统计w1118、yw;jetc;+、yw;jetr;+基因型的雄果蝇在正常LD光照周期下的寿命,将寿命数据导入R语言程序包,利用Lifespan程序[16]作出存活率曲线图,每种基因型的果蝇约100只.
从图10可以看出,对照组和实验组在前45d左右的存活率基本保持一致,在寿命的后程阶段,3种基因型的果蝇呈现不同的趋向.w1118果蝇存活率下降趋势较为平缓,基本保持平稳下降,yw;jetc;+果蝇的存活率在83d左右呈现断崖式下降,总体存活率高于对照组果蝇,yw;jetr;+果蝇呈现出较为迅速的下降趋势.对照组和实验组果蝇寿命趋势可以明显区分和比较.
2.4 不同的时差条件对jet突变体果蝇寿命的影响
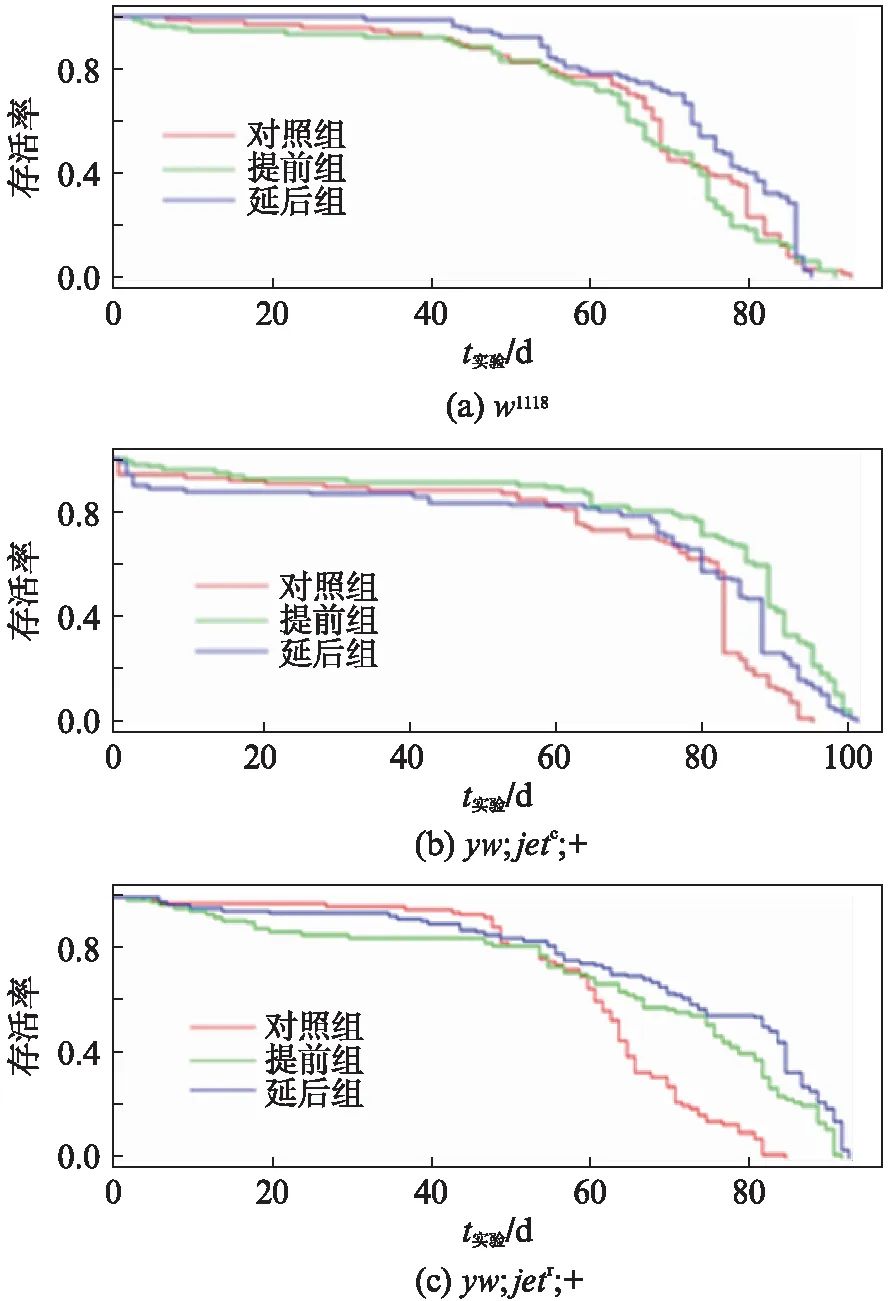
图11 (a) w1118、(b) yw;jetc;+和(c) ywjetr;+ 在3种光照周期条件下的寿命曲线图Fig.11 Life curve of w1118(a) , yw;jetc;+(b) and yw;jetr;+(c) under three light cycles(a)w1118基因型的果蝇正常情况下与提前组和延后组的存活率并无太大差异. (b), (c)相较于对照组,提前组和延后组的生存状况良好.
为了解在不同时差环境中,Jet蛋白的功能性丧失对果蝇的寿命有何影响,我们进行了正常果蝇与突变体果蝇在不同的时差条件下的寿命比较.分别统计了w1118、yw;jetc;+、yw;jetr;+基因型的雄果蝇在提前组和延后组(见材料与方法)情况下的寿命,与正常环境周期下的果蝇进行自身对照.对w1118基因型的果蝇在正常条件下以及提前组和延后组条件下的存活率数据进行分析作图.根据统计结果,对照组果蝇的寿命为(67.7692±1.8634) d,提前组果蝇为(65.2874±2.1301) d,延后组果蝇为(70.3333±1.4514) d.从图11(a)中可以看出,相对于对照组果蝇,每隔7d将光照周期提前8h所产生的时差,使得本身不具有时差反应的野生型果蝇在寿命上并无太大改变(n.s.),而延后组的果蝇寿命有轻微的延长(*P<0.05).在正常光照时间周期持续到第50天时,对照组果蝇有75只存活,光照周期每周提前的果蝇有72只存活,经历光照周期延迟的果蝇有80只存活,在当存活率到达50%时,对照组果蝇的寿命已经到达69d,光照周期每周提前的果蝇寿命达到68d,经历光照周期延迟的果蝇寿命为72d.在野生型果蝇体内,其正常功能的实现需要依靠各种时钟蛋白的相互调控.在很大程度上,整个节律系统必须依靠外部及内部分子的变化来维持正常的内生性生物钟的调控.它们通过协调多种组织和细胞分子的活动,不断地进行调节,从而维持其日常的生理和行为活动.这种内源性节律调控对光线急剧或轻微变化(如闪电和满月)而言相对难以适应,但对黎明和黄昏以及适应季节变化导致的日长时间变化非常敏感[17].w1118果蝇本身有完整的时钟蛋白调控系统,能够通过调节Jet蛋白与Cry蛋白的结合,引起Tim蛋白的下调,来对光照条件的变化进行快速应答,进而维持整个生命周期的调控[18].
基因型为yw;jetc;+的果蝇在提前组和延后组的光照条件中,受光照周期变化的影响,其生存状况良好,在果蝇寿命的后程,其存活率显著高于对照组.由图11(b)可知,在正常光照时间周期持续到第50天时,对照组果蝇有71只存活,光照周期每周提前的果蝇依然有81只存活,经历光照周期延迟的果蝇有79只存活,在当存活率到达50%时,对照组果蝇的寿命为83d,光照周期每周提前的果蝇寿命达到89d,经历光照周期延迟的果蝇寿命为86d.根据数据统计,对照组果蝇的寿命为(71.6296±2.7848) d,提前组果蝇为(80.7416±2.5626) d,延后组果蝇为(73.1684±3.0426) d.对于yw;jetc;+基因型的突变体果蝇,逐步推进或延后其光照周期,延长了该突变体果蝇的寿命,即时差条件可能会有利于其生存,给予其一定的时差环境可能会对其自身的寿命调控机制起到一定的正向作用.
基因型为yw;jetr;+的果蝇在提前组和延后组的光照条件中,也显示了同样的趋势(图11(c)).根据数据统计,对照组果蝇寿命为(62.1529±1.5556) d,提前组为(65.9111±2.6990) d,延后组为(71.8421±2.3074) d.在正常光照时间周期持续到第50天时,对照组果蝇有67只存活,光照周期每周提前的果蝇有73只存活,经历光照周期延迟的果蝇有80只存活,在当存活率到达50%时,对照果蝇的寿命已经到达64d,光照周期每周提前的果蝇寿命达到76d,经历光照周期延迟的果蝇寿命为82d.同样地,我们可以得出与yw;jetc;+果蝇类似的推论,对于yw;jetr;+果蝇来说,逐步推进或延后其光照周期,延长了该突变体果蝇的寿命,即时差条件可能会有利于其生存.
表1总结了3种基因型的果蝇在不同的环境条件下的两个生存标准的数据: 果蝇达到50%存活率的天数以及在第50天果蝇的存活率.在9组实验下,分别对3个实验环境中的每个实验环境中得到的数据进行生存分析.
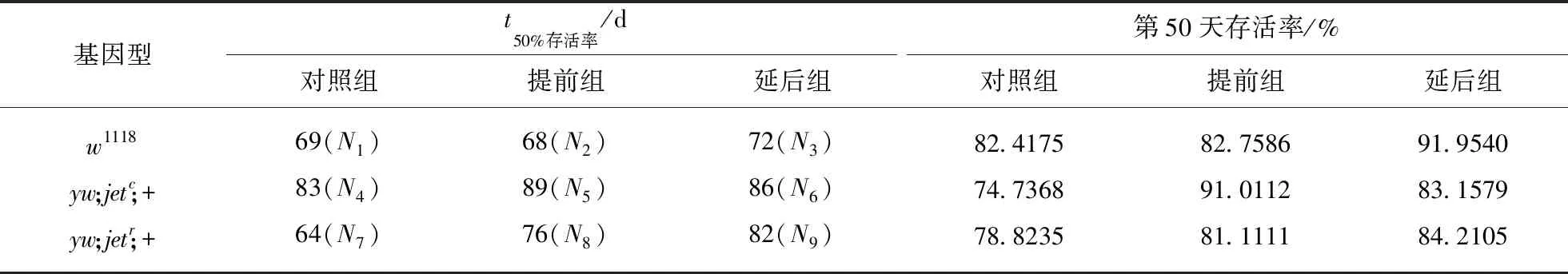
表1 对照组和实验组在不同的条件下的两个生存标准的数据
注:Nx表示每组果蝇的数量,N1=91,N2=87,N3=87,N4=95,N5=89,N6=95,N7=85,N8=90,N9=95.

注: -表示无显著性差异比较,n.s.表示不存在显著性差异,*P<0.05,**P<0.01,***P<0.001(生存分析比较).
表2总结了对照组和实验组在3种时差条件下的显著性差异比较.在比较分析中,我们提出两个问题: 两种基因型的果蝇在不同的时差环境中的生存能力是否有显著差异;jet突变体果蝇在不同的时差条件下的平均生存率是否显著大于正常环境下的平均值?结果表明: 在突变体果蝇的生存实验中,无论是50%存活率的天数标准还是在第50天存活的数量标准,都表现出了在时差环境下,其寿命的延长.仅考虑这3种周期性时差的环境,清楚地表明了一点,对于jet突变体果蝇来说,给予相应的时差环境,有利于其寿命的延长.而对于野生型果蝇w1118来说,每隔7d将生物钟提前8h并没有对其生长造成显著影响,然而每隔7d将生物钟延后8h的情况对其寿命有轻微影响,总体来说,并没有太大差异.已有研究表明,在光照情况下,野生型果蝇对光照反应敏感,内置生物周期可以对光照周期的改变作出快速应答,调控Tim蛋白的降解,进而调控整个节律系统[3].由此我们可以推测,正是这种对光反应的快速应答,使得光照周期的改变并不能对其产生明显影响,可能对寿命的影响也微乎其微.
3 讨 论
在果蝇的睡眠监测实验中,我们可以发现,两种同类型jet突变体果蝇的睡眠时间显著高于对照组果蝇,其睡眠次数相对较少,每次睡眠时间较长,这种表现的异常也就提示了Jet蛋白功能的缺失反而能促进果蝇睡眠的维持,出现嗜睡症状.在3组寿命监测实验中,两种jet突变体寿命在时差环境中表现出显著性延长,而对照组果蝇则没有明显变化.由突变体基因型和对照组基因型的睡眠及寿命比较可知,两种同类型jet突变体的睡眠量的增加对于正常条件下寿命的影响可能不具有相关性.
本次实验结果首次展示,对于jet突变体果蝇,在时差条件下,Jet蛋白功能的缺失可能有利于其寿命的延长,起到正向的环境诱导作用.根据实验结果推测,野生型果蝇本身表达Jet蛋白,并且可以及时对光照作出应答,然而利用转基因手段,使得遗传学上保守的jet基因不能正常表达,类似于给予果蝇人为的不利条件,将其置于时差环境中,可能会起到类似挽救的作用,从而在宏观上表现出寿命的显著性延长,而对于野生型果蝇则没有类似的作用.一般认为,睡眠量减少与寿命降低有显著性关联,但是鲜有睡眠量的增加与寿命的延长有强关联性的研究.分析认为,w1118果蝇的睡眠量保持正常状态,具有正常的生物钟环路,而影响野生型果蝇寿命的方式和途径有多种,其中,比较常见的有JNK、MAPK、mTOR、Wnt、Notch和Hippo信号传导途径等,涉及到自噬、翻译、糖酵解、氧化磷酸化、细胞凋亡、免疫应答、神经发生、睡眠和对DNA损伤的反应等[19-20].本文的实验探究中,以野生型果蝇作为对照,利用突变体果蝇寻找内部节律与外部环境中的关联,果蝇睡眠量的变化可能受多种途径和方式的共同影响,使得果蝇寿命作出一定的改变,其中的影响途径较为复杂,并未表现出一致性.所以,我们在探究两者之间联系的可能性的同时,不否认其过程中其他内置因素对于结果的影响,由此表现出寿命与睡眠长度未完全一致.
已知果蝇节律研究中,Tim蛋白对光敏感,即使是短暂的光脉冲也会触发Tim蛋白的降解,体内Tim蛋白水平的变化可以重置分子时钟,并引起生物钟的重置[21-22].进一步研究指出,Jet与Cry相互作用在果蝇体内非常重要,能够保障高效的光诱导的Tim降解[21].一般有两种方式: Cry与Tim的结合可以修饰Tim,使它可以结合Jet诱导降解;另一种是Jet-Cry复合物与Tim结合,从而诱导Tim降解,因此Jet-Cry复合物对于Tim的修饰是引起Tim蛋白快速光依赖性降解的重要部分[3,23].已知不同的基因操作和环境干预可延长果蝇的寿命[4],环境因素会对jet时钟基因影响其寿命产生一定作用,并且功能性的生物钟改变能防止果蝇过早老化,由此,jet突变体果蝇由于特定的遗传和/或环境因素而显示出复杂的寿命变异性模式[24].果蝇的广义抗逆性可能是在整个物种中延长成年寿命的主要机制,其抗性机制在不同的基因型中表达延长的寿命表型可能会涉及不同的遗传、分子和生理机制[5].一方面,在jet突变体果蝇中,Jet蛋白功能的丧失引起了Tim蛋白的不充分降解,其内置周期性调节不完全,可能会引起自身调节机制的损害,而在外部施加时差环境之后,可能会使得环境条件接近其内生环境,表现出寿命的延长[24-25].另一方面,F-box蛋白Jetlag参与了生物钟的重置机制,普遍认为,Jet是Skp1/Cullin/F-Box(SCF)E3泛素连接酶复合物组分,其在Cry存在的情况下与Tim以光依赖的方式结合.这种相互作用促进Tim的泛素化和降解,而突变体果蝇在Tim的泛素化方面效果较差[10].SCF复合物调节许多不同的细胞和发育过程,Jet与SkpA(果蝇中的几种Skp1同源物之一)相互作用.skpA是表达最丰富的果蝇skp1相关基因,果蝇SkpA是SCF泛素连接酶的一个组成部分,它调节细胞和中心体周期之间的联系.SkpA在调节中心体复制,核内复制,染色质浓缩,细胞周期进展和细胞周期蛋白E积累等方面发挥重要作用[26].而在突变体果蝇中,Jet蛋白含量的变化使得其不可避免地对与SkpA的相互作用产生一定的影响,进而通过SCF复合物造成对整个生命周期的影响.同时,jet基因对衰老、心律失常等都有一定的影响,我们推测jet的缺失可能不是主要通过对下游基因tim的表达调控引起睡眠异常,而是通过多种途径对生物周期产生影响.
在哺乳动物中,我们会经常认为时差反应会带来健康的危害以及寿命的减短,本文利用jet突变体果蝇首次发现时差环境下,可能会有利于该时差蛋白缺失果蝇寿命的延长.我们推测,野生型果蝇自身合成Jet蛋白,可及时对光照作出应答,利用转基因手段,使得其体内本应正常表达的jet基因不能参与正常的时差蛋白调控后,可以认为是人为的给予果蝇以时差蛋白的缺失,其内部稳态环境受到破坏,当在外部环境中给予一定时差后,影响了相关时差蛋白的调控,从而影响相关激素水平及蛋白水平的调节,进而影响到寿命的调控.而对于野生型果蝇,其本身内部环境稳定,给予时差环境后,对其内部稳态并无明显改变,由此并没有表现出明显的作用.我们认为,进一步探究jet突变体果蝇寿命延长现象的原因可能的方向是,在jet突变体果蝇中,Jet蛋白的缺失引起了Tim蛋白的不充分降解,其内置周期性调节不完全,引起内置环境的损害,而在外部施加时差环境之后,维持在环境条件接近其内生环境中,表现出寿命的延长,另一种可能的方向是Jet蛋白含量的变化使得其对与SkpA的相互作用产生一定影响,进而通过SCF复合物造成对整个生命周期的影响.这些结果提示,今后可以利用果蝇的jet突变体模型,深入研究时差蛋白对果蝇内部节律及激素水平调节的神经环路和细胞分子基础.
时差环境是如何对生物产生影响的?在生物界中,科学的阐述生物体内如何对快速的光周期的变化作出应答是十分必要的.在果蝇中存在的与时差反应有重要联系的Jet蛋白,以及与它具有高度相似性的哺乳动物F-box蛋白的功能尚未有清晰的确定.我们未来的工作将进一步研究控制Jet蛋白水平变化的条件因素和分子机制,进而观察在果蝇体内,时钟蛋白水平的变化对果蝇内环境所产生的多方面影响,后续可以探究时差环境使得jet突变体果蝇寿命延长的分子机制,从而对人类的寿命研究有所提示.
