细菌耐药的外排机制及其抑制剂
2019-05-10孙仲琳
孙仲琳,崔 锦,王 锐,穆 青
(1.复旦大学 药学院,上海 201203; 2.昭通学院,云南 昭通 657000)
抗生素药物的发展及其在临床上的广泛使用甚至是过度使用,导致细菌对药物产生了严重耐药性.所谓细菌耐药性,是指由于某种抗菌药物的长期或多次使用,使相同浓度的抗菌药物不能达到预期的杀灭或抑制细菌的效果,需增大浓度才能达到目的.从进化角度讲,细菌产生耐药性有益于菌体本身适应不利环境而得以生存,是生物进化的结果;从医疗的角度来说,耐药性引起的直接后果是严重影响临床抗菌治疗效果,增加患者治疗成本;从新药研发角度讲,细菌耐药性的产生极大地缩短了新药应用周期,增大了新药的研究与开发成本[1].总之,细菌耐药性问题严重威胁着人类生命健康,已经发展成为全球性的严峻问题,研究耐药性的产生机制,寻求克服细菌耐药性的有效方法十分迫切.
1 细菌产生耐药性的机制
细菌耐药性分为两种: 一种为特异性耐药,表现为细菌仅针对某种或某一类的抗生素产生耐药,另一种为非特异性耐药,表现为细菌对多种类型抗生素均产生耐药[1].细菌特异性耐药的主要机制有: (1) 细菌自身生成保护酶,对抗生素的化学结构进行修饰使其失活;(2) 药物作用靶点发生改变,使药物不能与靶点结合而失活.细菌非特异性耐药常表现为多重耐药,其机制为: (1) 细菌形成生物被膜对自身进行保护;(2) 细菌细胞膜的通透性下降,导致药物难以进入细菌,使细菌胞内药物减少;(3) 细菌外排泵对药物的主动外排,药物排出增加,使细菌胞内药物浓度降低[2].
由细菌外排泵介导的细菌对抗生素的外排作用是细菌多重耐药的重要机制之一.细菌外排泵是存在于细胞膜上的具有外排功能的蛋白质(膜转运蛋白),能够将进入胞内的抗菌药物泵出胞外,使菌体内药物浓度降低而导致耐药[3].这种膜转运蛋白的能量主要来源于两种: ATP水解释放的自由能(主要主动转运体)或跨膜质子移动产生的驱动能(次要主动转运体)[4].
自从1980年第一次认识到外排泵机制是导致大肠杆菌耐四环素的重要原因以来[1],已有多种细菌外排泵介导的多药耐药现象的报道,这种普遍存在于各种细菌中的外排作用与降低膜通透性的机制类似,都可以使细菌胞内的药物浓度降低而产生耐药[5].
2 主动外排耐药机制的特点
多药耐药主动外排系统是存在于细菌胞膜上的一类蛋白质,可以非选择性的将药物泵出胞外.从这一作用过程可以总结到,多药耐药主动外排机制具有底物广泛、外排蛋白多样、能量依赖和外排泵来源菌多样等特点.
2.1 底物广泛
细菌的多药耐药外排泵可识别的底物十分广泛,目前已有报道的可被外排泵排出的底物类别有: 抗生素类药物,合成类抗菌药物,表面活性剂类,抗菌染料类,金属离子类,去污剂类,消毒防腐剂类等[5].这种广泛的底物识别特性是细菌排除有害物质的自我保护机制,也是产生多重耐药性的重要原因和生物学基础.
2.2 外排蛋白多样
介导细菌多重耐药的主动外排泵本质是细胞膜上起转运作用的蛋白质,种类丰富.主要分为膜通道蛋白、主要主动转运体、次要主动转运体、组易位体和其他功能不明的转运蛋白5类,其中主动外排耐药性的转运蛋白属于次要主动转动体和主要主动转运体两类[6].而细菌多重耐药的主动外排泵主要可分为5大家族: ATP结合盒家族(ATP-Binding Cassette, ABC);主要易化子超家族(Major Facilitator Superfamily, MFS);小多重耐药性家族(Small Multi-drug Resistance, SMR);耐药-结节化细胞分化家族(Resistance Nodulation cell Division, RND);多药及毒性化合物外排家族(Multidrug And Toxic compound Extrusion, MATE)[6].不同的氨基酸序列和多变的三维蛋白结构是形成不同家族外排泵的主要原因.
ABC家族是依靠ATP水解供能的,同时存在于原核生物和真核生物[7].ABC家族的成员都具有相似的4个结构域: 两个疏水跨膜区域,通常各由6个跨膜的α螺旋构成,它们被两个亲水性的核苷酸结合区域分开.两个核苷酸结合区域分布在细菌细胞膜的内表面上,是ATP水解的位点.ABC家族多药外排系统典型代表是与肿瘤耐药相关的p-糖蛋白,同时也在葡萄球菌属、屎肠球菌、霍乱弧菌和乳酸乳球菌等细菌中有发现[8].在细菌外排系统中,ABC家族对外排底物具有高选择性,如糖,氨基酸,金属离子,有机铁复合物,维生素和抗生素等[7].
MFS家族为跨膜质子能驱动型外排系统,可以细分为若干亚家族,其氨基酸序列高度保守,表现为12或14个跨膜蛋白.在MFS的每一类亚家族中,都存在特异性多药转运蛋白,能介导特异性药物外排,且革兰氏阳性菌与阴性菌的外排模式不同[9].金黄葡萄球菌的NorA、QacA,肺炎链球菌的PmrA,粪肠球菌的EmeA等外排系统等都属于MFS家族[10].
SMR家族同为跨膜质子能驱动型外排系统,该家族是已知的最小的外排蛋白系统,仅具有110个氨基酸残基和4个跨膜区域,其跨膜区与MFS家族的跨膜区无同源性.SMR家族仅存在于细菌中,典型包括金黄葡萄球菌的Smr(QacC)和大肠杆菌的EmrE等.尽管该族外排泵属于多药耐药外排泵,它们作用的底物范围仅限于亲脂性阳离子,包括抗菌剂和消毒剂等[11].
跨膜质子能在RND族外排泵的能量驱动机制中有重要作用.RND家族外排泵广泛存在于革兰氏阴性菌中,是导致临床上阴性菌对多种抗菌药物产生耐药性的主要原因.RND族外排泵具有特殊的拓扑结构,由12个跨膜区域(TMS)及2个大的膜外的环状结构构成,这2个环状结构分别位于TMS1和TMS2、TMS7和TMS8之间[10].所有的RND族外排泵都是多药转运体,相比MFS家族和SMR家族,RND家族外排底物更为广泛,涵盖亲脂性和两性分子,包括多种抗生素、防腐剂、染料和洗涤剂等[12].铜绿假单孢菌的MexB,大肠杆菌的AcrB,空肠弯曲杆菌的MexB和淋病奈瑟氏菌的MtrD等外排系统都属于RND家族[13].
MATE家族与MFS家族的膜拓扑结构相似,但是和MFS家族成员并不存在同源性.并且该家族利用电化学梯度,例如钠离子或氢离子梯度作为驱动能量来源[14].副溶血性弧菌的NorM,霍乱弧菌的VcrM,流感嗜血杆菌的HmrM,铜绿假单孢菌的PmpM,艰难梭状芽胞杆菌的CdeA和金黄葡萄球菌的MepA等外排系统都属于MATE家族[15].
2.3 能量依赖性
细菌外排泵主导的主动外排过程是需消耗能量的,两种能量来源为质子移动力(PMF)或ATP的分解.据此,外排系统可分为跨膜质子梯度能驱动型外排泵和ATP水解能驱动型外排泵两大类[1].常见的外排蛋白5大家族中SMR家族,MATE家族,MFS家族和RND家族都属于PMF型,ABC家族为ATP型[15].
2.4 外排泵来源菌多样
多药耐药外排系统来源十分普遍,广泛分布于革兰阳性菌(金黄葡萄球菌、枯草芽孢杆菌、肺炎链球菌、乳酸乳球菌、粪肠球菌)、革兰阴性菌(大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、肠道沙门氏菌、鲍曼不动杆菌、空肠弯曲杆菌、淋病奈瑟氏菌)、真菌(白色念珠菌)以及结核杆菌(结核分枝杆菌、耻垢分支杆菌)中.不同来源菌的外排系统种类各异,可以对不同种抗生素产生耐药现象,这是导致临床抗感染治疗失败的主要原因.表1是临床常见几种菌的外排系统种类和所属家族类型.
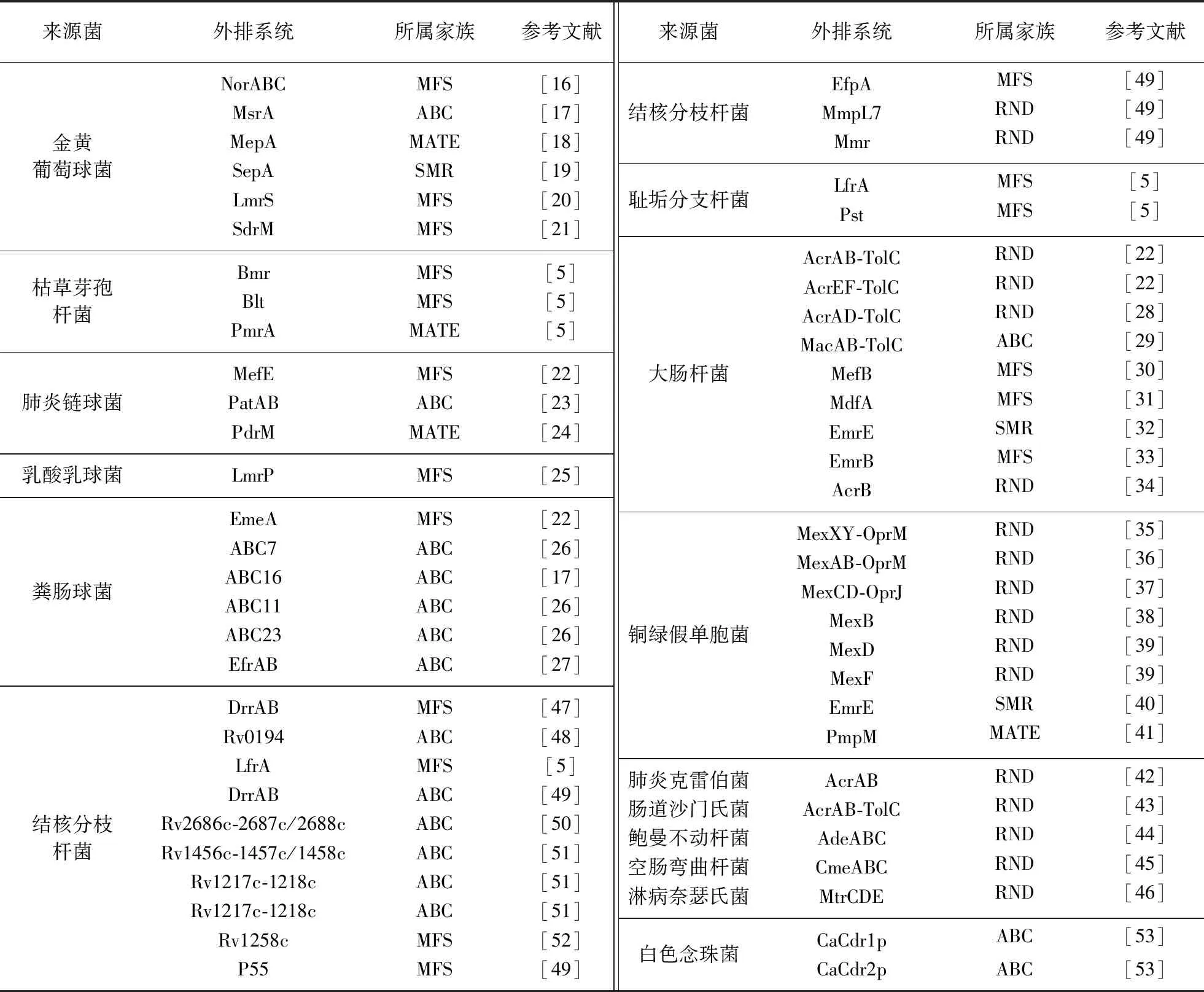
表1 临床常见几种菌的外排系统种类和所属家族类型
3 细菌多药耐药外排泵抑制剂
临床上克拉维酸与阿莫西林联合应用能够用于治疗耐阿莫西林细菌所引起的感染,而克拉维酸的作用机制是抑制β-内酰胺酶对β-内酰胺类抗生素的水解作用,其中β-内酰胺酶是细菌自身产生的一种保护酶.与此类似,许多细菌的另一种自我保护作用是通过外排系统将进入胞内的抗菌药物泵出胞外,从而使胞内药物浓度降低而导致耐药[3].外排泵抑制剂可以通过抑制外排泵对抗生素的外排作用,从而恢复细菌对抗生素的敏感性,是解决耐药性问题的可行方法.而且某些外排泵抑制剂在改善某些药物的动力学特性方面(降低肝、肾清除率,提高口服药物的吸收)也有作用[4].细菌外排泵抑制剂来源丰富,从天然产物和合成化合物中都可得到,表2是不同来源的外排泵抑制剂类型,代表结构如图1和图2所示.
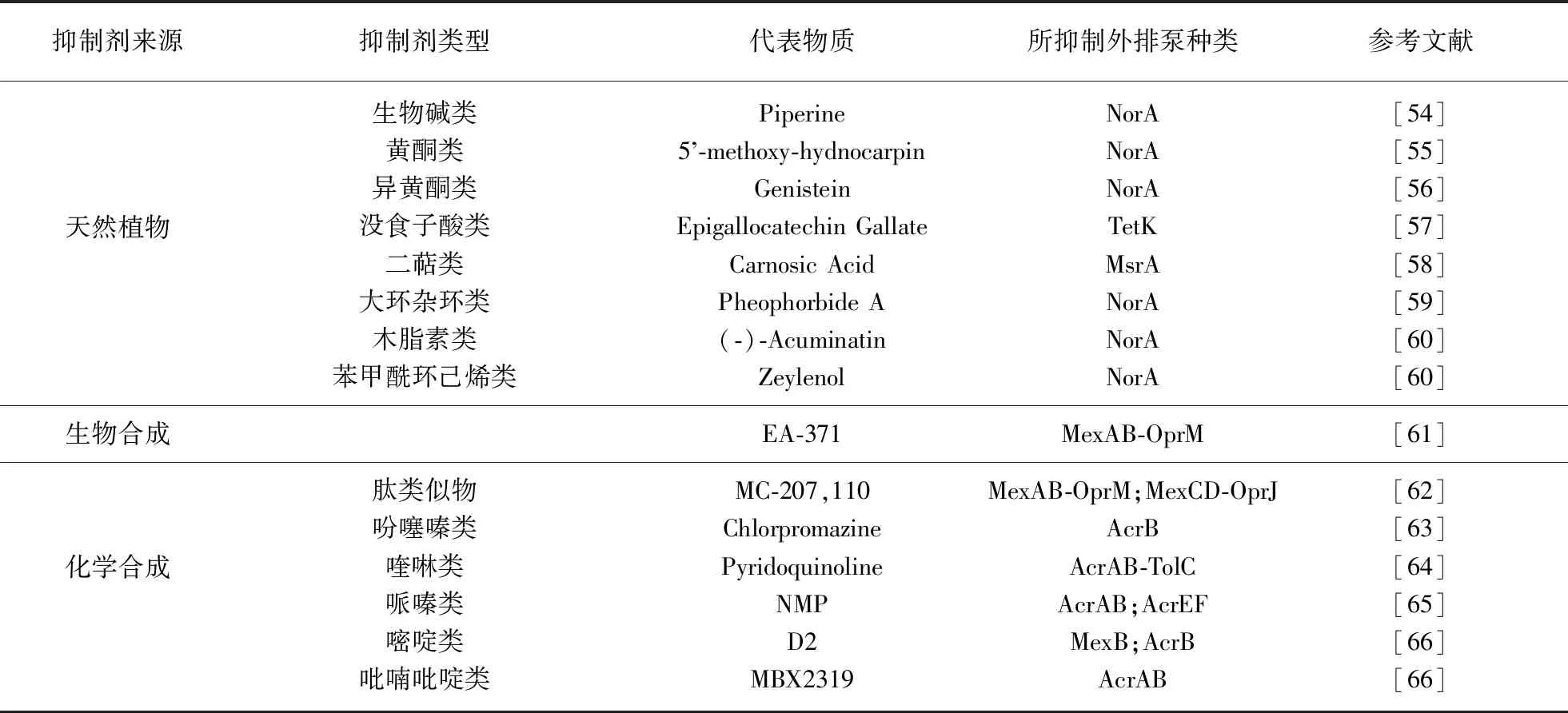
表2 不同来源的外排泵抑制剂类型
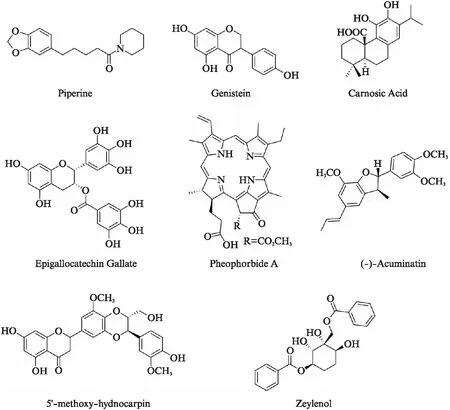
图1 植物来源外排泵抑制剂Fig.1 Efflux pump inhibitors from plants
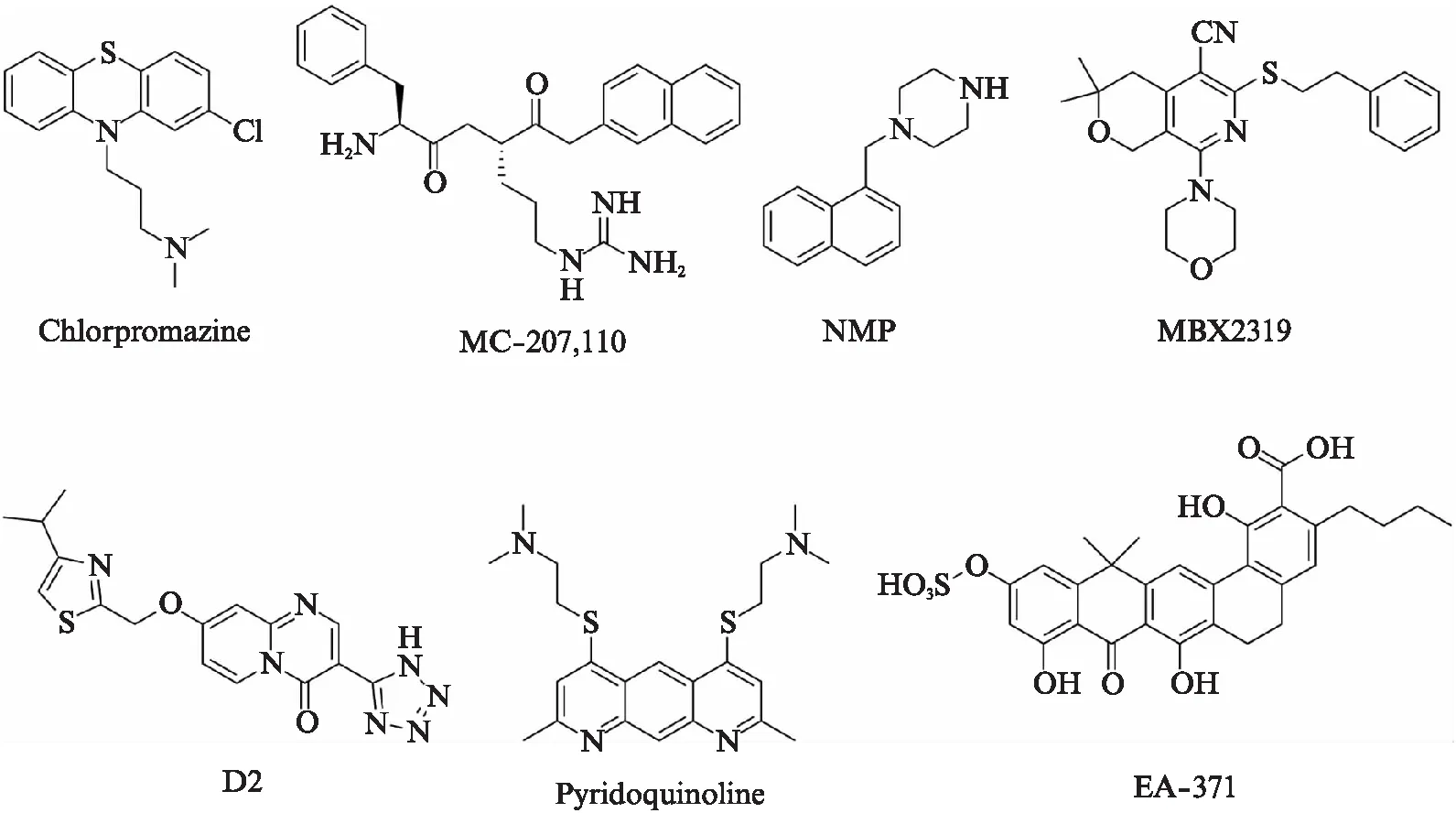
图2 生物合成和化学合成来源外排泵抑制剂Fig.2 Efflux pump inhibitors from biosynthesis and chemical synthesis
针对细菌多药耐药的跨膜质子梯度能驱动抑制剂的代表药物为5’-methoxy-hydnocarpin(5’-MHC),MC-207,110,Piperine及氰氯苯腙.5’-MHC单独用药无抗菌活性,但与抗菌药物联合使用时能完全抑制MDR的外排能力[55].MC-207,110为二肽类广谱外排泵抑制剂,抑制效力与肽无关,只要具有双阳离子并且脂溶性相似就可以抑制MDR的外排能力[67].氰氯苯腙为质子动力解偶联剂.另外,有相关报道首个被发现的P-gp蛋白抑制剂维拉帕米对结核分支杆菌外排系统具有抑制作用[68].
4 外排泵分子机制举例
随着科学的不断发展,人们对外排泵的研究已深入到分子基因水平.我们不仅对外排泵的耐药机理和作用机制有了更加深刻的认识,同时意识到从分子基因水平上可能根本解决困扰人类的细菌耐药性问题.克隆外排基因,提高阻遏蛋白水平,调控外排基因的表达;或设计相应的阻断剂,封闭基因;或采用基因缺失的方法都是可利用的手段,也是亟待解决的问题[69].从分子水平认识细菌耐药机制,对于解决细菌耐药性问题至关重要.下面分别以铜绿假单胞杆菌和金黄葡萄球菌为例阐述革兰阴性菌和阳性菌的外排泵分子机制.
4.1 铜绿假单胞菌外排泵分子机制
铜绿假单胞菌属于革兰阴性菌,其外排泵的作用是造成临床严重耐药的重要原因.铜绿假单胞菌主要有4种外排泵,即MexAB-OprM、MexCD-OprJ、MexEF-OprN和MexXY,均属于RND家族.其中MexAB-OprM、MexCD-OprJ、MexEF-OprN外排系统由内膜转动蛋白、外膜外排蛋白和膜融合蛋白组成[69].MexXY外排系统缺少外膜外排蛋白基因,可能利用OprM表达产物发挥外排作用,而位于其上游的MexZ可编码MexXY表达的阻遏物,阻遏MexXY的表达,可提高对氨基糖苷类等多种抗生素的敏感性[69].如果MexA、MexB或OprM缺失,可使铜绿假单孢菌对多种抗生素敏感度增加.临床分离得到的铜绿假单胞菌菌株nalB的mexR基因与MexAB-OprM的表达相关,mexR基因可以直接抑制MexAB-OprM和自身的表达,从而减弱细菌对药物的抵抗能力[70].
4.2 金黄葡萄球菌外排泵分子机制
金黄葡萄球菌有多种类型的外排泵,其中报道较多的是NorA外排系统.NorA外排系统属于MFS家族,外排蛋白由388个氨基酸残基组成,含12个跨膜结构.NorA外排蛋白由位于染色体Sma ID片段上的norA基因编码.NorA编码基因norA转录水平过高或mRNA水平过高导致了该菌耐药,与NorA蛋白的结构变化无关.norA基因表达的潜在负调节因子是norR,norR的过度表达可抑制norA的表达[69].
多药耐药外排系统种类繁多,作用机制错综复杂,在细菌耐药性产生过程中发挥着重要作用,但同时也为我们对抗细菌耐药提供了可能的途径,即可以从外排泵蛋白分子水平抑制和基因水平调控方面来解决这个问题.目前从植物、微生物以及化学合成物质中发现了多种能抑制外排活性的物质(图1和图2),因此将抗菌剂与外排泵抑制剂相结合,可以开发出更加高效、更为广谱的抗菌药物.尤其是天然产物的结构具有多样性,不易被各种外排系统识别为底物,对细菌生长没有直接抑制作用,更有利于其协同现有抗菌剂发挥抗菌作用.我国拥有丰富的植物资源,这一天然宝库,作为外排泵抑制剂来源具有重要的研究意义及应用价值.
