整合素基因多态性与胃癌发病风险的相关性
2019-05-10张青松朱传卫王三六赵吉光沈俊周琳
张青松 朱传卫 王三六 赵吉光 沈俊 周琳
安徽宣城市中心医院1检验科,2肿瘤科,3普外科(安徽宣城242000);4江苏省太湖康复医院检验科(江苏无锡214086)
胃癌(gastric cancer,GC)是我国高发的肿瘤之一,据最新统计显示我国胃癌的发病率在肿瘤中位于第二位(男性第二,女性第四)[1],严重地影响了群众的健康。胃癌是一个复杂的疾病,其发病是一个慢性的病理过程。现有研究显示,胃癌的发病与是环境因素和遗传因素相关。其中幽门螺杆菌(helicobacter pylori,Hp)感染被证实为明确的胃癌致癌因子,被定为Ⅰ类致癌因素。
整合素是细胞表面的异二聚体蛋白家族,其介导细胞与基质及细胞与细胞之间的相互作用。该家族蛋白的18 个α-亚单位及8 个β-亚单位形成25 种整合素[2]。整合素介导的信号对细胞的粘附、扩散、迁移、增殖、分化、等都起到关键作用。此外,其还与多种肿瘤的发生及转移相关[3-4]。研究显示整合素α1β1 的表达上调与胃肠道粘膜的炎症相关并与胃癌的发生相关[5]。研究[6-7]显示整合素的遗传多态性与胃癌的发病风险相关,亦有研究显示[8]其与胃癌的治疗及预后相关。因此进一步探讨整合素家族基因的遗传多样性与胃癌的发病及病理的相关性对于胃癌的发病机制及预后判断有着重要的临床应用价值。
1 对象与方法
1.1 研究对象 研究招募2013年7月至2018年6月于安徽宣城市中心医院经病理诊断为胃癌的患者设为病例组。同期招募在医院健康体检结果且无消化道疾病史者为健康对照组。上述二组人群均抽取以肝素抗凝的静脉血,400 ×g 离心10 min,然后分别收集血细胞与血浆,冻存于-80 ℃冰箱用于后续抗体检测及基因分型。病例组组成为男186 例,女67 例,平均年龄(64.63 ± 12.17)岁。健康对照组组成为男213 例,女94 例,平均年龄(63.6±12.30)岁。
1.2 试剂和仪器 DNA 提取试剂盒购自西安金磁纳米生物技术有限公司;PCR 扩增仪为美国ABI 公 司GeneAmp PCR System 9700 型。蛋白 核 酸检测仪购自美国Thermo 公司;MassARRAY 平台所用的点样仪及质谱仪为美国Sequenom 公司产品;引物由上海生工生物工程技术服务有限公司合成;Iplex Gold Reagent kit 为美国Sequenom 公司产品。幽门螺杆菌检测试剂盒由上海凯创生物技术公司产品。
1.3 样本DNA提取 所有受试者取抗凝全血3 mL分离得到的白细胞,基因组DNA 提取采用GoldMag全血基因组DNA 提取试剂盒,按照试剂说明书步骤进行,主要步骤如下:(1)破碎红细胞:向加入红细胞裂解液,充分裂解后以500 ×g离心10 min,弃上清,留下沉淀;(2)破碎白细胞:向步骤1 管中加入白细胞裂解液及蛋白酶K,用以破碎白细胞;(3)清洗磁粒:取1 mL 充分摇匀的磁性微粒加入到一新离心管中,置于磁性分离器上,待溶液澄清后弃去上清,并向离心管中按一定的比例加入结合液BC,将离心管置于涡旋振荡器上涡旋混匀15 s 后备用;(4)结合:将步骤3 中处理好的磁性微粒转移到装有步骤2 中已裂解的样本离心管中,将离心管置于涡旋振荡器上涡旋混匀15 s 后室温放置5 min,然后将离心管置于磁性分离器上磁性分离5 min,待溶液澄清后弃去上清;(5)清洗Ⅰ:向离心管中加入清洗液并混匀15 s后置于磁性分离器上磁性分离,待溶液澄清后弃上清;(6)清洗Ⅱ:向离心管中加入清洗液Ⅱ,混匀15 s 后置于磁性分离器分离弃上清;(7)洗脱:加入洗脱液,混匀15 s 后置于磁性分离器上,收集上清中的DNA 到1.5 mL 离心管中,将离心管置于-80 ℃冰箱中保存备用。基因组提取后采用NaniDrop2000c 型蛋白核酸检测仪并分析其纯度与浓度。
1.4 多态性位点的选择与分析基因多态性位点选择 以中国人群最小等位基因频率为0.05。基因多态性位点位于整合素家族基因上,见表1。所选择的基因分型采用美国Sequenom 公司MassARRAY 平台进行分析。该平台分析基因型主要为以下几个步骤:(1)PCR 扩增反应:采用多重PCR 扩增含有多态性位点的序列片断;(2)SAP 纯化:SAP是一个纯化的过程,主要采用虾碱酶(shrimp alkaline phosphatase,SAP)来消化PCR 扩增体系中多与的dNTPs 和引物;(3)Iplex 单碱基延伸反应:利用多重PCR 扩增后的产物,针对该位点再设计一条延伸引物,延伸引物在iplex 酶的作用下进行单碱基延伸反应。根据SNP 位点的不同,探针将结合不同的ddNTP,从而具有不同的分子量,质谱仪即可检测出这种分子量差异,从而实现SNP 分型的目的;(4)树脂纯化:向每个反应体系中加入Clean Resin(树脂),混匀15 min 后离心5 min,其目的是为了去除前三步反应中残余的杂质;(5)点样:使用MassArray 点样仪将制备好的样本点到检测芯片的相应位置上;(6)质谱分析:利用MALDI产生离子常用飞行时间(Time-of-Flight,TOF)检测器来检测不同的核酸片断,不同的等位基因会产生不同的质谱牲,从而得到相应的检测结果;(7)结果分析:使用SequenomTyper 4.0 Software 观看和分析实验结果,得出不同的基因型。
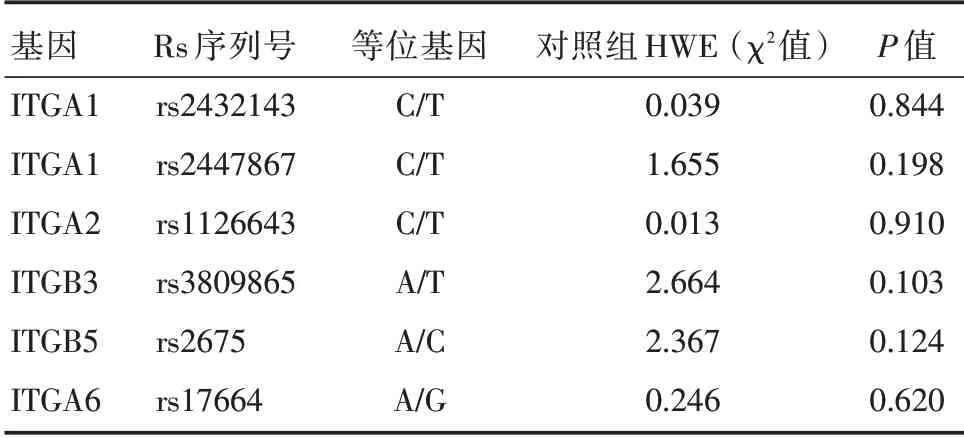
表1 多态性位点信息Tab.1 Information of polymorphisms
1.5 Hp 感染检测 采用胶体金法,严格按照检测试剂盒说明书操作并判读结果。主要步骤如下:用加样吸管往加样孔内垂直滴加1 滴(大约20 μL)。然后立即垂直加入3~4 滴样品稀释液,加样后5 min 判断结果;判读阳性为质控线(C 线)和检测线(T 线)各有一条红色线条出现,表明样本中存在胃幽门螺旋杆菌尿素酶抗体。判读阴性为只有质控线(C 线)有一条红色线条,而检测线(T 线)无红色线条出现,则指示胃幽门螺旋杆菌尿素酶抗体或胃幽门螺旋杆菌尿素酶抗体低于检出水平。
1.6 统计学方法 用SPSS 11.0 软件包进行统计学分析。计量资料以均数±标准差表示,组间比较采用独立t检验;计数资料用例数、百分比表示,组间比较采用χ2检验。对照组的各多态性位点的基因型采用χ2检验进行Hardy-Weinberg 平衡检测。采用二分类因变量Logistic 回归分析多态性位点的与胃癌风险的关系,以风险比(OR)及95%可信区间(CI)表示相对风险度,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 病例组及健康对照组的性别、年龄、吸烟等方面差异均无统计学意义(均P>0.05),但病例组的饮酒者比例显著高于对照组,差异均有统计学意义(P<0.05)。对照组中H.pylori 感染阳性为151 例(49.19%),病例组为132 例阳性(52.17%),二组差异无统计学意义(P>0.05)。经对对照组进行Hardy-Weinberg 遗传平衡(HWE)检验,结果显示各位点均符合该定律(P>0.05),认为具有群体代表性,见表2。病例组依临床分期T1-T2 为79 例(31.23%),T3-T4 为174 例(68.77%)。依据临床部位为贲门癌80 例(31.62%),非贲门癌173 例(68.38%)。
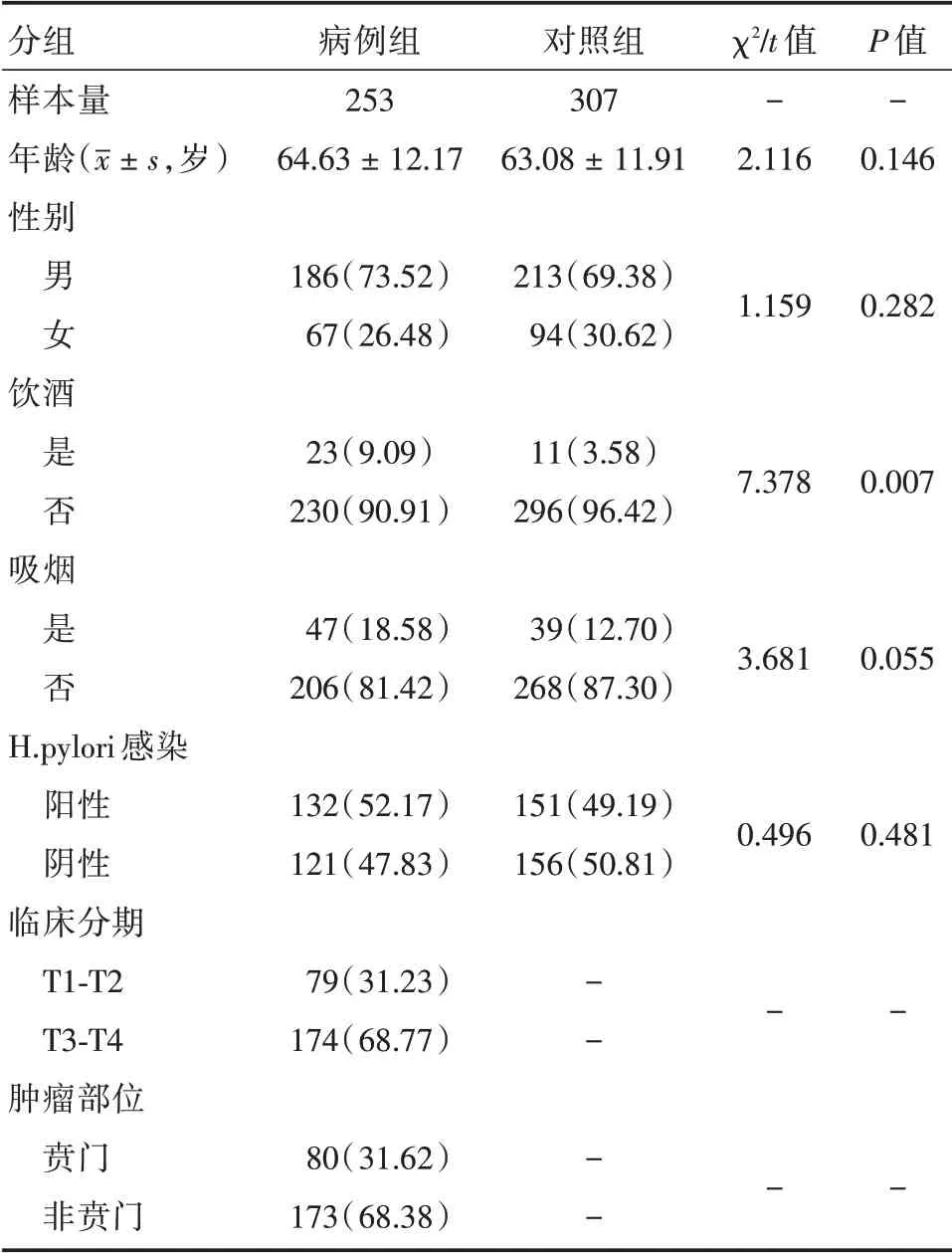
表2 胃癌组及健康对照组的临床资料Tab.2 Clinical characteristics of participants 例(%)
2.2 各基因型在病例组及对照组中的分布及其与胃癌易感性关系 ITGA1rs2447867 位点在病例与对照组的分布有统计学差异,Logistic 回归分析显示rs244786TC(校正后OR= 1.69,95%CI:1.16~2.45,χ2=7.574,P=0.006)、TT(校正后OR=2.23,95%CI:1.25~4.00,χ2=7.303,P=0.007)及TC/TT(校正后OR=1.75,95%CI:1.23~2.50,χ2=9.411,P= 0.002)基因型与胃癌的发病风险相关。其他各位点的基因型分布差异均无统计学意义。见表3。
2.3 ITGA1rs2447867 位点的亚组分析 ITGA1 rs2447867 位点经亚组进行logistic 回归分析显示,年龄>60 岁组各基因型均胃癌的发病风险相关(TCvs.CC:校正后OR=2.05,95%CI:1.27~2.31,χ2= 8.507,P= 0.003;TTvs.CC:校正后OR= 2.58,95%CI:1.18~5.63,χ2= 5.667,P= 0.017;TC/TTvs.CC:校正后OR= 2.07,95%CI:1.31~3.28,χ2=9.702,P= 0.002),而在年龄≤60 岁组,仅有TT 基因型与胃癌的发病风险相关(TTvs.CC:校正后OR=2.90,95%CI:1.09~7.67,χ2=1.580,P=0.032)。此外在肿瘤部位分组中亦显示,在非贲门癌中,各基因型均与胃癌的发病风险相关(TCvs.CC:校正后OR= 1.78,95%CI:1.17~2.72,χ2=7.191,P=0.007;TTvs.CC:校正后OR=2.68,95%CI:1.41~5.08,χ2= 9.080,P= 0.003;TC/TTvs.CC:校正后OR=1.90,95%CI:1.27~2.84,χ2=9.746,P=0.002),而在贲门癌中见未相关性。该位点在其他分组中分布差异无统计学意义。见表4。
3 讨论
本研究采用病例-对照分析了整合素基因家族5 个基因的多态性位点与胃癌发病风险的相关性。结果显示,ITGA1rs2447867 多态性位点是胃癌发病的风险因素。进一步亚组分析显示,该位点与年龄>60 岁的人群胃癌发病风险相关,且与非贲门癌发病风险相关。
ITGA1 位于染色体5q11.2,其编码整合素的α1 亚单位。研究显示其与胃癌细胞粘附及转移相关[9]。此外,在韩国人群的一项研究中也发现ITGA1rs2447867 与胃癌的发病风险相关[7],与本研究结果相一致。对其功能研究推测该位点是一个外显子拼接增强子,导致蛋白翻译后剪切的异常,因此与胃癌的发病风险相关[7]。整合素是细胞粘附分子主要倡导细胞之间、细胞与胞外基质及细胞与病原体的相互作用,其在免疫系统中发挥重要作用,如介导白细胞迁移、突触形成、吞噬作用等[10],因此在病原体感染导致胃部疾病进展乃至胃癌的发生过程中,整合素作为介导细胞间的作用及免疫系统的改变发挥着重要作用[11]。ITGA1编码整合素受体的α1 亚单位,其与β1 亚单位形成一个异源二聚体进而与胶原及层粘连蛋白结合,参与细胞之间的粘附并在介导免疫与纤维化的发生过程中发挥作用。该基因还被证实与胶原相互作用,调节基质金属蛋白的活性与肿瘤的发生相关[12]。亦有研究报道,整合素α1β1 在胃肠道炎症过程中表达上调,进而与胃癌的发生有潜在的关联[5]。此外,细胞及临床研究进一步证实整合素α1 亚单位阳性胃癌细胞与细胞外基质的粘附是其腹部转移的重要过程[9,13]。综合以上,虽然ITGA1 rs2447867 多态性位点的功能尚待研究,但现有研究显示ITGA1 在胃癌的发生过程中发挥着重要的作用,可以通过多个潜在的机制导致胃癌的发生。ITGA1rs2432143 位于ITGA1 基因内含子1 内,在韩国人群中报道该位点与胃癌的发病风险相关[7],而该位点的功能目前还没有相关报道。本研究没有发现该位点与胃癌的发病风险相关,该位点目前还未见相关的研究报道,有待于今后的研究进一步证实。
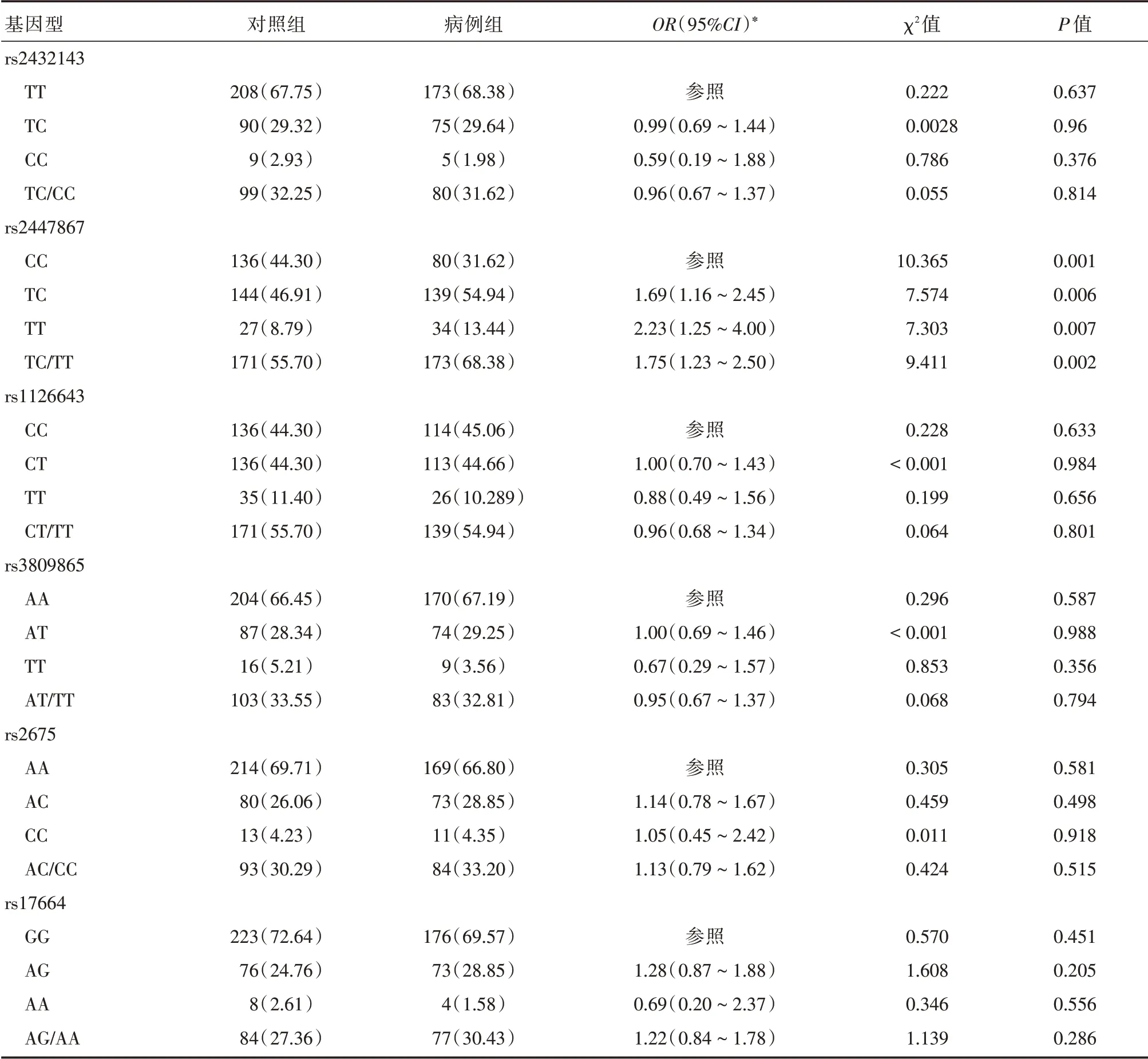
表3 基因型分布及其与胃癌风险性的关系Tab.3 Genotypes distribution and it′s association with GC risk例(%)
rs1126643 是一个位于ITGA2 外显子7 的C/T基因多态性,导致一个无义的多态性位点(Phe253Phe)。现有研究提示该多态性位点也心血管疾病及阿司匹林药效有关[14]。迄今为止,尚未见其与胃癌发病风险的相关性研究。rs3809865 与rs2675 分别位于ITGB3 基因ITGB5 基因的3′非编码区(3′UTR)与基因的表达有潜在的相关性[15],有研究报道二个位点与口腔鳞癌的发病风险相关[16]。rs17664 位点ITGA6 基因的3′UTR 区,有研究报道rs3809865,rs2675 及rs17664 而亦有研究报道这二个位点与胃癌的发病有潜在的相关性[17],与本研究的结论不一致,这可能与研究的方法(该研究采用高分辨溶解曲线法)、纳入研究的群体的年龄及地区(四川)的差别有关。上述研究结果目前鲜有研究报道,有待于进一步证实。
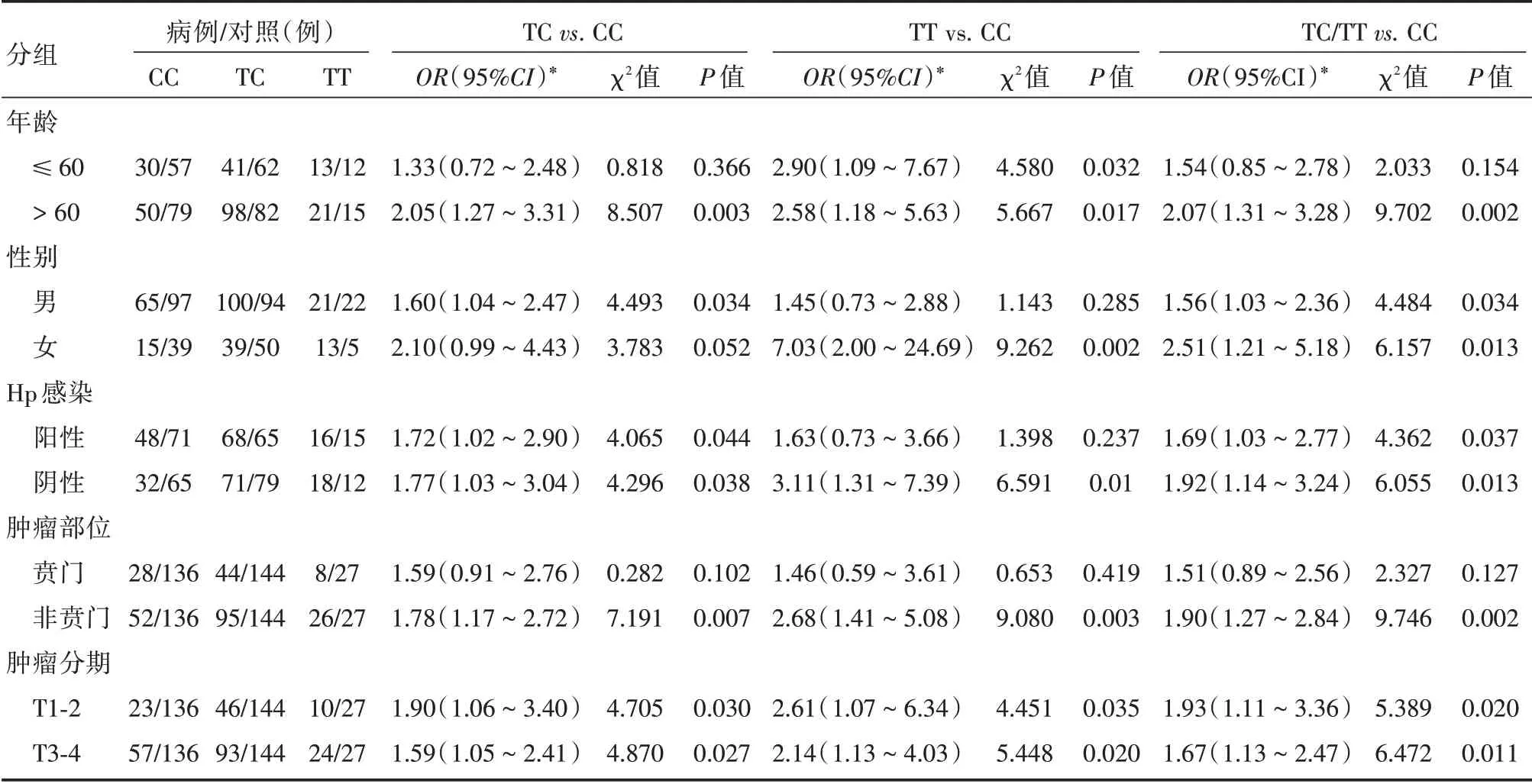
表4 ITGA1rs2447867 位点与胃癌风险的亚组分析Tab.4 Subgroup analysis of the assoication between ITGA1rs2447867 and GC risk
本研究还通过亚组分析进一步发现ITGA1-rs2447867 多态性位点与胃癌发病风险关系与年龄及胃癌的发生部位相关,该位点与在年龄较大人群(>60 岁)的胃癌及与非贲门癌相关胃癌的发病风险相关。众所周知,个体的年龄越大,所受到环境因素的影响积累就越多,这其中其中环境因素(如吸烟、饮酒、Hp 感染)、遗传因素及其二者的相互作用是胃癌发病的重要原因[18-19],随着年龄的增长个体的环境暴露时间增加,此会导致个体的胃癌的发病风险增加。就胃癌的发病部位而论,有研究显示贲门癌与非贲门癌在致病因素及分子表型方面有显著的差异[20],且二者在发病因素上亦有很大差异,如肥胖[21]、Hp 感染[22]等因素在二者发病的过程中起着不同的作用。此外,研究[23]还显示,二类胃癌在免疫表型上有很大差异,非贲门癌的发生更倾向于与炎症相关。基于我国人群的流行病学调查显示,既往患消化道溃疡、慢性胃炎为非贲门癌最强的危险因素[24],提示炎症在非贲门癌的发病中发挥重要作用,而ITGA1 在介导炎症过程发挥重要作用,以上结论与本研究ITGA1rs2447867 与非贲门癌发病风险相关的结果一致。
胃癌的发病因素复杂,本研究探讨的ITGA1rs2447867 位点的功能尚没有研究报道。另外,本研究所纳入的病例还相对较少,这些都是本研究的薄弱之处。本研究的结果还有待于更大样本量的分子流行病学研究及相关的功能研究的证实。
综合以上,本研究结果显示ITGA1rs2447867多态性位点与胃癌发病风险相关,且风险在年龄>60 岁人群中增大,该位点与非贲门胃癌有更强的相关性。本研究的结论为胃癌发病的基础研究提供了分子流病学资料,为胃癌发病的分子机制研究提供了临床资料。
