棕榈酸经过氧化物酶体增殖物激活受体α影响KGN细胞SR-BI 的表达和脂质含量
2019-05-10刘琪莫中成郭冰冰屈丽华廖宏庆谢远杰张蒙夏
刘琪 莫中成 郭冰冰 屈丽华 廖宏庆 谢远杰 张蒙夏
南华大学衡阳医学院应用解剖与生殖医学研究所,组织学与胚胎学教研室(湖南衡阳421001)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种最常见的内分泌和代谢紊乱疾病,在中国人肥胖患者中患病率约为60%~70%[1-2]。据报道PCOS 与脂质代谢受损有关,脂肪酸的急剧增加导致PCOS 患者的脂质变化显着[3-4]。研究表明,过多的脂肪酸在体内积累,引起脂毒性,从而影响PCOS 的发生发展,并且增加循环游离脂肪酸有许多不良代谢作用,包括血脂异常、胰岛素抵抗、2 型糖尿病、不孕和高血压[5-7]。
棕榈酸作为长链脂肪酸的一种,是一种含十六碳的机体内最常见的饱和脂肪酸。棕榈酸分布在体内和组织内,其代谢主要是经过β 氧化供给能量[8]。棕榈酸在正常的范围内,发挥其生理功能,但是在一些特定的病理条件下,组织内的棕榈酸异常增加,其稳态被打破,脂毒性会增加,导致相关疾病的产生。目前已知相关的疾病有肥胖型心肌病、高脂血症、糖尿病以及肿瘤。有研究报道,棕榈酸存在卵巢组织中,正常情况下它用于能量的供应,但是过多的棕榈酸能导致颗粒细胞凋亡[9]。并且,研究发现血浆中棕榈酸会增加,卵泡液中棕榈酸的浓度也会受血浆浓度的影响,对颗粒细胞的活性产生负面的作用[10]。在多囊卵巢综合征患者中,棕榈酸在卵泡液中增加,对卵泡的发育产生影响[11]。
人类SR-BI 基因位于染色体12q24,约75 kDa,B类Ⅰ型清道夫受体(scavenger receptor class B type I,SR-BI)的结构呈马蹄形,由1个胞外域、2个跨膜域、2 个胞浆域构成[12]。先前的研究发现SR-BI 用于摄取培养的大鼠原代颗粒细胞中的胆固醇酯用于类固醇合成,并且缺乏SR-BI 的小鼠具有异常的脂蛋白代谢和可逆的女性不育[13]。研究发现SRBI 敲除后引起高胆固醇血症,并且女性SR-BI 敲除后导致不孕。证实在卵母细胞回收过程中分离的颗粒细胞中具有SR-BI RNA 低表达的不育妇女的血浆雌二醇水平显着降低,并且回收和受精的卵母细胞数量较低[14]。在肝细胞中,高密度脂蛋白(high density lipoprotein,HDL)介导的胆固醇流出的可能机制是,甾醇载体蛋白-29(sterol carrier protein-2,SCP-2)[15]和脂肪酸结合蛋白(fatty acidbinding protein,FABP)[16]能影响SR-BI 的表达,从而介导胆固醇流出。此外,研究发现SR-BI 刺激游离胆固醇从稳定表达SR-BI 的中国仓鼠卵巢细胞中流出[17]。因此,说明SR-BI 是影响颗粒细胞胆固醇转运的重要蛋白,但是脂肪酸是否会影响其表达未见报道。
过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptor α,PPARα),PPARα属于核受体蛋白主要参与转录因子表达的调控,PPARα在糖、脂、蛋白质代谢中起重要的作用。通过激活过氧化物酶体增殖物激活受体(PPAR)信号传导途径,在许多组织中脂肪酸氧化受到调节[18]。CHINETTI 等[19]发现PPARα激活降低ACAT1 活性和降低酯化速率,但不改变ACAT1 基因表达,还表明PPARα 配体促进ATP 结合盒转运蛋白A1(ATP-binding cassette transporterA1,ABCA1)的蛋白质表达,从而增强胆固醇流出。在他们的另一项研究中,PPARα激活剂诱导SR-BI 的表达。但是,对于PPARα影响颗粒细胞脂质转运、摄取、氧化的作用仍不清楚。总而言之,这些研究说明PPARα在卵巢中脂质代谢中扮演者重要的角色。
综上所述,本研究旨在探讨棕榈酸在卵巢颗粒细胞中的作用,为防止卵巢脂质代谢障碍疾病提供新的思路。
1 材料与方法
1.1 细胞株 人卵巢颗粒细胞购于BNCC 公司。
1.2 试剂与仪器 DMEM 培养基购自美国gibco公司;棕榈酸、油红O 染料、青霉素-链霉素购自美国Sigma 公司;胎牛血清购自上海依科赛生物科技有限公司;抗体:SR-BI 购买于英国Abcam 公司,PPARα购自武汉三鹰;NBD-Choleaterol 购自美国Cayman。
倒置相差显微镜购自美国Olympus 公司,Carl Zeiss 荧光显微镜购自德国蔡司公司,低速离心机(LXJ-04)购自上海博迅实业有限责任公司设备厂,Tanon 5500 全自动化学发光成像分析系统购自上海天能科技有限公司。
1.3 方法
1.3.1 细胞培养和棕榈酸溶解 将加入4 mL 含10% 胎牛血清的DMEM 培养基的KGN 细胞置于5%CO237 ℃恒温无菌培养箱中。通过细胞计数,将1 × 106/mL 细胞密度的细胞悬液接种到6 孔板,2 mL/孔接种细胞悬液。棕榈酸溶解:先用0.1 mol/L NaOH 在70 ℃水浴5 min,趁热加到55 ℃的10%BSA 中,配成10 mol/L 的储备液待用,过滤后可放入-20 ℃冻存,处理细胞前加热溶解至无结晶。
1.3.2 油红O 染色 将KGN 细胞按细胞传代的方法离心后,吸去上清,每管均加入12 mL 无血清培养基制成细胞悬液。另取一块无菌6 孔板,每孔均放入已消毒盖玻片一块,然后每孔均加入KGN细胞悬液2 mL,待贴壁并密度达到50%时,加入棕榈酸处理,用PBS 溶液轻轻洗涤细胞2 次,加4%的多聚甲醛固定细胞15 min,以PBS 溶液清洗3 次后,加稀释好的油红O 工作液于37 ℃恒温箱染色15~30 min,60%异丙醇漂洗5 s 或者去离子水清洗3 次,用苏木素染核5~7 min 后去离子水清洗5 min,0.5%盐酸酒精快速分色并以清水返蓝后,自然风干后滴加甘油封片,在显微镜下观察,胞内的橙红色颗粒即为脂滴,拍照并保存。
1.3.3 KGN 细胞NBD-Cholesterol 标记荧光 将KGN 细胞按细胞传代的方法离心后,吸去上清,每管均加入12 mL 无血清培养基制成细胞悬液。另取一块无菌6 孔板,每孔均放入已消毒盖玻片一块,然后每孔均加入KGN 细胞悬液2 mL,待贴壁并密度达到50%时,加入棕榈酸处理,再加相应处理因素处理一定时间后,以100~200 μL NBDCholesterol 工 作液 干预KGN 细 胞12 h 后,预 热的PBS 清洗2 次。之后加相应处理因素处理一定时间后,用PBS 溶液轻轻洗涤细胞2 次,避光,立即荧光显微镜下拍照。
1.3.4 免疫荧光检测蛋白的表达 取一无菌6 孔板,每孔置一块无菌玻片,按细胞传代的方法将细胞离心后,弃上清,加入含10%胎牛血清的培养基,吹打混匀后,每孔加入2 mL 细胞悬液,经棕榈酸处理后,加相应的处理因素处理一段时间,PBS 洗涤细胞2 次,并加入4%甲醛室温固定30 min,再次用PBS洗涤细胞3次,加入10%山羊血清(PBS配制)室温封闭20 min。其后用SR-BI抗体(1∶1 000,10%山羊血清配制)、PPARα(1∶500)室温孵育1 h 或4 ℃过夜。接着PBS 洗涤3 次,每次5 min,加入二抗Cy3-conjugated Affinipure Goat Anti-Mouse lgG(H+L)(1∶500,10%山羊血清配制)室温避光孵育1 h。PBS 洗涤3 次(避光),每次5 min,立即荧光显微镜下拍照或防淬灭封片剂封片。
1.3.5 Western Blot 免疫印迹 将KGN 细胞接种在6 孔板中,经棕榈酸处理后,再加相应的处理因素处理一段时间。将进行样品的上样、电泳及转膜。在4 ℃冰箱中,将膜与SR-BI 一抗(1∶2 000)、PPARα一抗(1∶1 000)及β-Actin(1∶1 000)、HSP70(1∶5 000)过夜孵育,第2 天进行二抗的孵育。通过Image J 软件定量免疫印迹的信号强度。
1.3.6 免疫细胞化学 将KGN 细胞接种在6 孔板中,待密度到达50%左右,经棕榈酸处理,再加相应的处理因素处理一段时间。用PBS 洗涤细胞2 次,并加入4%甲醛室温固定30 min,再次用PBS洗涤细胞3 次,使用0.01% Triton 打孔10 min,PBS洗涤细胞3 次,H2O2室温孵育10 min,PBS 洗涤细胞3 次,将SR-BI(1∶400)一抗,PPARα一抗(1∶500)4 ℃过夜,次日,复温30 min,PBS洗涤细胞3次,滴加增强剂,37 ℃孵育20 min,PBS洗涤细胞3次,滴加二抗,PBS洗涤细胞3次,DAB显色,复染,分色,拍照。
1.4 统计学方法 计量资料数据表示为x ± s,所有实验重复3 次;数据都使用Student′st-检验和单因素方差分析进行分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 棕榈酸对KGN 细胞脂质含量及脂质流出的影响 为探索棕榈酸对KGN 细胞脂质的影响,采用不同浓度(0、0.000 1、0.000 2、0.000 3 mol/L)处理KGN 细胞,采用油红O 染色法检测细胞内脂质含量,结果发现与对照组相比,细胞体积增大,胞内脂滴数量增加,且随着棕榈酸浓度的增加胞内脂滴数量增加更为明显(图1A)。用NBD-Cholesterol孵育KGN 细胞后,荧光显微镜下观察细胞内荧光的强度,发现随着棕榈酸浓度的增加,胞内绿色荧光强度逐渐增加(图1B),提示胞内脂质的含量逐渐增加。说明棕榈酸促进KGN 细胞脂质增加,且其效应具有浓度依赖性。

图1 棕榈酸对颗粒细胞脂质含量的影响Fig.1 The effect of PA on lipid deposition and lipid outflow in KGN cells
2.2 棕榈酸对KGN细胞SR-BI表达的影响 KGN细胞脂质转运是受多种基因及蛋白调控的复杂过程,其中SR-BI 是促KGN 细胞胆固醇转运的关键蛋白。为进一步探讨棕榈酸抑制KGN 细胞脂质流出的作用机制,将KGN 细胞用不同浓度的棕榈酸(0、0.000 1、0.000 2、0.000 3 mol/L)处理24 h,采用Western Blot 免疫荧光和免疫细胞化学的方法检测KGN 细胞SR-BI 的表达,与对照组相比发现,随着棕榈酸处理浓度的增加,细胞膜上SR-BI 表达逐渐增加(图2),这说明棕榈酸呈浓度依赖性的方式促进KGN 细胞SR-BI 的表达。
2.3 棕榈酸对KGN 细胞PPARα的表达的影响为明确PPARα是否参与了棕榈酸促进KGN 细胞的脂质增加,将KGN 细胞用不同浓度的棕榈酸(0、0.000 1、0.000 2、0.000 3 mol/L)处理24 h,采用Wetern Blot 和免疫细胞化学的方法检测KGN 细胞PPARα的表达。与对照组相比发现,随着棕榈酸处理浓度的增加,细胞上PPARα表达逐渐增加(图3),这说明棕榈酸呈浓度依赖性的方式促进KGN 细胞PPARα的表达。
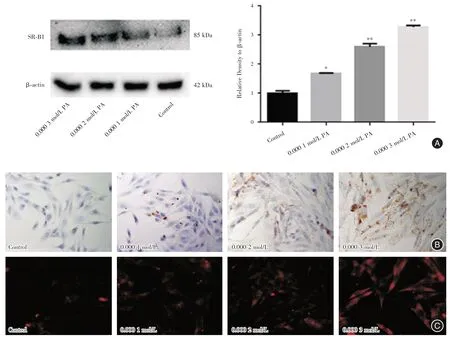
图2 棕榈酸对颗粒细胞SR-BI 蛋白表达的影响Fig.2 The effect of PA on the expression of SR-BI in KGN cells
3 讨论
体内游离脂肪酸分布不均衡直接导致了心脏及外周器官细胞脂质含量增加,并转化为甘油三酯[20]。脂肪酸在颗粒细胞和卵母细胞发育中扮演着重要的角色,但是过量的FFA 是有害的,研究发现卵泡游离脂肪酸(free fatty acid,FFA)升高的女性患有子宫内膜异位症[21-22]。JUNGHEIM 等[23]研究发现卵巢滤泡中的主要FFA 与血清中的FFA 一致,卵泡细胞以不同的速率代谢特异性FFA,或者某些FFA 可能优先转运到卵巢滤泡中,总FFA 升高与卵丘复合体质量较差之间存在关联,进一步表明过量FFA对卵巢滤泡功能有不利影响。HOLTE等[24]发现多囊卵巢综合征患者中,血浆FFA 浓度是增加的。研究发现将人颗粒细胞用0.000 1 mol/L或0.000 3 mol/L PA 培养48 h,棕榈酸诱导的颗粒细胞凋亡伴随着抑凋亡蛋白(B cell lymphoma/lewkmia-2,Bcl-2)的下调和促凋亡蛋白(apoptosis regulator BAX,Bax)的上调[25]。这些结果表明饱和的FFA 诱导由各自的酰基辅酶A 形式的代谢引起的人颗粒细胞的凋亡,因此循环FFA 在人颗粒细胞的凋亡中起关键作用。刘艳等[26]研究发现棕榈酸能导致炎症。而棕榈酸作为一种饱和脂肪酸,它既是颗粒细胞所必需的,但过多棕榈酸会影响颗粒细胞功能。在本研究中,不同于其他研究,发现棕榈酸影响颗粒细胞脂质代谢,促进颗粒细胞脂质含量增加。同时,XIE 等[27]发现用0.5 mmol/L棕榈酸酯处理初级颗粒细胞48 h 或96 h,细胞凋亡增加。此外,研究报道棕榈酸浓度升高会增加IL-1在卵巢颗粒细胞中,其机制可能与颗粒细胞神经酰胺积累增加有关[28]。在本实验研究中,发现棕榈酸用0.000 1、0.000 2、0.000 3 mol/L 培养24 h,颗粒细胞中脂质含量显著增加。本研究中棕榈酸的浓度比较低,在预实验中发现按照文献中高浓度的棕榈酸导致细胞死亡,这说明用低浓度棕榈酸处理影响颗粒细胞脂质含量,增加细胞内脂质含量。
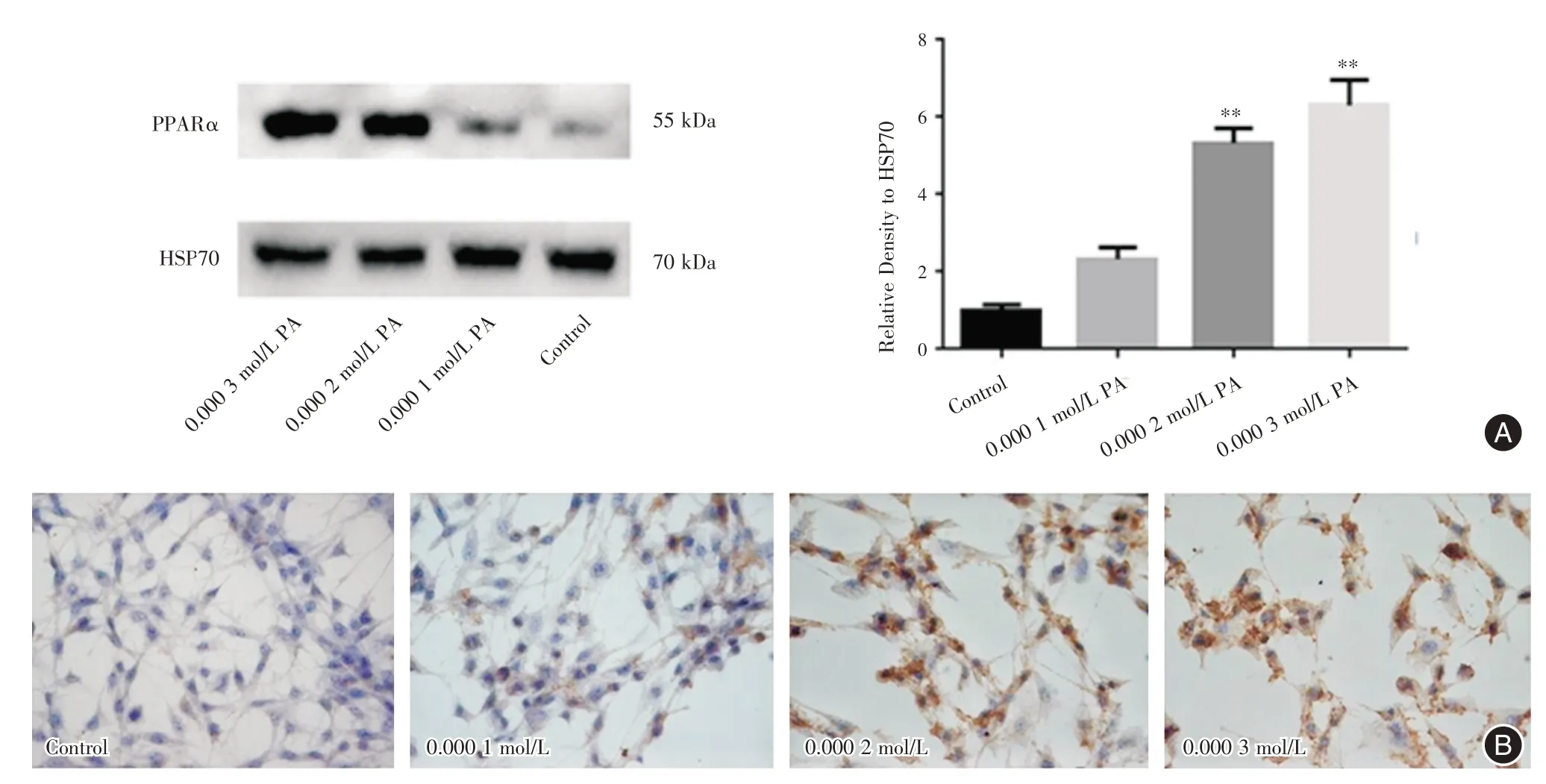
图3 棕榈酸对颗粒细胞中PPARα 蛋白表达的影响Fig.3 The effect of PA on the expression of PPARα in KGN cells
SR-BI 是细胞膜上清道夫受体,它主要介导胆固醇选择性转移,但其机制尚未明确,可能需要辅助蛋白和脂质的参与,质膜的物理化学特性的改变和SR-BI 的物理形式。HU 等[29]报道75%的SR-BI 传递的HDL-胆固醇酯被非溶酶体中性胆固醇酯水解酶水解成游离胆固醇和长链不饱和脂肪酸,脂肪酸可用于能量代谢或许再酯化,储存在脂滴中。既往研究报道SR-BI 参与选择性胆固醇转运,关于脂肪酸是否可通过SR-BI 影响颗粒细胞脂质变化还尚无报道。本研究发现随着棕榈酸的浓度增加,SR-BI 的表达上调,说明颗粒细胞中SR-BI与脂质含量的增加密切相关。但DE FRONZO 等[30]报道脂肪酸与清道夫受体密切相关,其中清道夫受体分化群36(CD36)是脂肪酸的膜受体,CD36在细胞膜摄取脂肪酸进入细胞成为脂滴,参与颗粒细胞的脂质代谢。WEN 等[31]研究发现,棕榈酸诱导了时间和剂量依赖性H9c2 细胞的脂毒性;增强的CD36 和减少短时间后葡萄糖转运蛋白4 型(glucose transporter 4,GLUT4)途径蛋白水平。SR-BI作为清道夫受体家族的成员,它并不是脂肪酸的膜受体,但是在本研究中发现棕榈酸影响颗粒细胞SR-BI 的表达,随着棕榈酸浓度的增加,其表达显著上调,棕榈酸可能通过结合其受体进而影响颗粒细胞的SR-BI 的表达。这些说明SR-BI 是棕榈酸致颗粒细胞脂质含量增加的重要靶蛋白。
过氧化物酶体增殖物激活受体是核受体家族,其通过结合天然配体(例如多不饱和脂肪酸或通过合成配体)而被激活[32]。FFA 是过氧化物酶体增殖物激活受体α(PPARα)的内源性配体[33],PPAR 在哺乳动物的卵巢和胎盘发育过程中起重要作用[32,34]。对于PPARα,VITTI 等[35]通过小鼠卵巢的体内实验表明,非诺贝特抑制卵巢雌激素合成酶的基因表达。PPARα表达在颗粒细胞中,但其表达非常低[36],已证实它的激活是负责减少FFA 的表达和活性[37]。因此,PPARα的上调能够改善在卵泡微环境和生理或病理卵巢老化期间受到损害氧化能量代谢[38]。WEN 等[31]研究报道在心肌细胞中,棕榈酸下调PPARα蛋白的表达,HDL 治疗显着增加CD36 代谢途径蛋白质和减少GLUT4 途径蛋白质。本研究发现,PPARα蛋白在正常颗粒细胞中低表达,但经棕榈酸处理后,PPARα蛋白的表达呈棕榈酸浓度依赖性增加。这与其他文献中的结果不一致,PPARα不仅在颗粒细胞能量代谢中扮演者重要的角色,参与了颗粒细胞脂质转运障碍,导致细胞脂质含量增加,阻碍颗粒细胞的功能,并且调控SR-BI 蛋白的表达。其潜在的机制是棕榈酸通过结合受体(CD36 或者脂肪酸转运蛋白)进入细胞,通过激活PPARα,从而影响SR-BI 蛋白的表达,导致颗粒细胞脂质含量增加。目前,本研究尚还未完成干预实验,棕榈酸影响颗粒细胞的脂质代谢还有待进一步深入研究。
综上所述,本研究以KGN 细胞为研究对象,采用棕榈酸孵育,以胆固醇转运相关蛋白SR-BI 为调控靶点,研究棕榈酸对KGN 细胞脂质流出的影响,并探讨该过程潜在的调控机制,可望从新的视角阐明SR-BI 在卵巢颗粒细胞中的作用及可能机制,为靶向调控SR-BI,有效防治卵巢脂质代谢障碍疾病。通过实验发现棕榈酸在卵巢中参与颗粒细胞能量代谢,并且在本研究中首次发现棕榈酸能促进KGN 细胞脂质含量增加,此外,颗粒细胞膜上清道夫受体SR-BI 表达增加,以及过氧化物酶体增殖物激活受体PPARα增加。这些说明棕榈酸可能通过SR-BI 影响颗粒细胞脂质含量,其机制可能与PPARα有关。
