猪猝死症4种重要病原多重连接探针扩增鉴别检测技术的建立与应用
2019-05-10周莹珊邵春艳宋泉江黄保续王晓杜宋厚辉
周莹珊,陈 琳,孙 静,姜 胜,邵春艳,周 彬,宋泉江,黄保续,王晓杜*,宋厚辉*
(1.浙江农林大学动物科技学院/浙江省畜禽绿色生态健康养殖应用技术研究重点实验室/动物健康互联网检测技术浙江省工程实验室,浙江 杭州 311300;2.中国动物卫生与流行病学中心,山东 青岛 266032)
猪“猝死症”也叫做“暴死症”、“急死症”,病因复杂,甚至在一些地区呈现区域性流行[1]。该类疾病症候群主要特点是呈急性发病,无明显的临床症状,往往由于不能及时治疗而发生死亡[2]。我国是生猪生产、饲养与消费大国,生猪饲养量占全球比例接近70%,猪肉消费占国内肉类消费的60%。猪猝死症每年给我国养猪业造成严重的经济损失。猪猝死症只是一种症状,不是单独的一种疾病,因而引起该病的病因也有很多种,根据猝死症临床症状、流行病学调查、病原分离鉴定等特征,引起猪猝死症的常见疾病有:猪尼帕病(Nipah disease)、非洲猪瘟(African swine fever,ASF)、猪梭菌性肠炎(Clostridial enteritis)及猪传染性胸膜肺炎(Porcine pleuropneumonia)等传染类疾病。虽然我国尚未发现猪尼帕病,但是我国周边国家和亚洲地区已有该疾病发生的报道[3-4],其流行病学风险不容忽视。
引起猪猝死症的病因有病原学和非病原学因素,在病原学方面,不同菌(毒)株毒力不同,常出现隐性感染或混合感染,使得通过临床症状和病理变化很难对致病原因进行确诊。目前我国动物疾病的检测标准多是针对单一病原,对于不明病原的临床样品,需要多次重复完成检测,耗时耗力。此外,由于猪猝死症病程急,快速检测并确定病原对于疾病早期预防和治疗至关重要。目前,国际上尚无一种方法可以一次性对引起猪猝死的多种病原进行鉴别。因此建立一种能够精准、快速、高效区分不同病原的检测方法,对于猪猝死症的预防和早期干预至关重要。
多重连接探针扩增技术(Multiplex ligation-dependent probe amplification,MLPA)是一种高通量、针对待测核酸中靶序列进行定性和定量分析的新技术。该技术将核酸的杂交检测和PCR链式扩增相结合,实现了对靶分子的高效特异性分析,在同一反应管中可对多达45个不同的靶基因进行检测和定量分析。MLPA的基本程序包括探针和靶序列DNA的杂交,再通过连接酶连接探针,然后进行连接探针的PCR扩增,产物经毛细管电泳,最后通过数据分析得出结论[5]。
本研究建立了一种同时检测4种猪猝死症相关病原体的MLPA技术,该技术特异性强、灵敏度高,为病原体的鉴别诊断和应急检测提供了技术储备。
1 材料与方法
1.1 临床样品和菌(毒)株 129份临床样品来自浙江农林大学动物健康检测中心,包括30份脐带血、34份组织样品(14份淋巴结、9份肺组织和11份小肠组织)、21份全血样本和44份鼻拭子样本。PRRSV JX-07株、CSFV C株、猪圆环病毒2b型(PCV 2b)、猪流行性腹泻病毒(PEDV)、猪日本脑炎病毒(JEV)、猪伪狂犬病毒(PRV)均由本实验室保存。猪产气荚膜梭菌(Clostridium perfringens)A型(CVCC1126)、猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)CVCC3559株、猪细小病毒(PPV,CVCC3559)购自中国兽医药品监察所。
1.2 主要试剂 MEGAscript T7试剂盒购自Ambion公司;反转录试剂盒购自TOYOBO(上海东洋纺);One Step Ahead RT-PCR Kit购自QIAGEN公司;DNA/RNA共提取试剂盒购自Tiangen生物技术有限公司;pGEM-5zf载体购自Promega公司;SALSA MLPA EK1 Reagent Kit(MRC Holland)购自厦门致善生物科技有限公司。
1.3 引物、探针的设计与合成 根据GenBank登录的相应病毒和细菌相对保守的基因序列设计引物和探针(表1),并利用MUSCLE Alignment(Geneious 8.1.4)进行序列比对以确定每个基因中相对保守的区域,用于特异性反转录和预扩增。这些引物扩增的片段包含MLPA探针结合的区域。探针设计参照MRC-Holland公司公开的流程(Designing synthetic MLPA probes,Version 15)。探针分别结合NPV的N基因、ASFV的p27基因、C.perfringens的plc基因、A.pleuropneumoniae的Apx IVA基因中相对保守的区域(表2)。左侧探针(Left Probe,LP)由两段核苷酸组成,一段是病原特异性序列(Left Hybridising Sequence,LHS),一段是用于扩增的通用序列;右侧探针(Right Probe,RP)由两段核苷酸组成,一段是病原特异性序列(Right Hybridising Sequence,RHS),一段是用于扩增的通用序列,且右侧探针的5'端磷酸化处理。通过设计不同长度的探针区分不同病原。引物和探针均由金唯智(苏州)生物有限公司合成。

表1 反转录和预扩增引物名称和序列Table 1 Sequences of the primers used in this study

表2 MLPA探针信息Table 2 Target genes and sequences of MLPA left and right probes
1.4 重组质粒的构建和体外转录RNA的制备 分别以C.perfringens和A.pleuropneumoniae菌株提取的DNA为模板,以GTCGACAGAGAACATGCATGA/ACGCGTTCCTCTTTGCCATTCA和GTCGACGTGCG GGGTAATGATA/ACGCGTCGGCTAAACCAAAGT为引物,PCR扩增C.perfringens的plc基因和A.pleuropneumoniae的Apx IVA基因,回收扩增产物酶切纯化后分别克隆至pGEM-5zf载体,并转化DH5α感受态细胞得到重组菌,PCR鉴定阳性的菌液经测序正确后获得阳性重组质粒pGEM-plc和pGEMApxIVA。通过数据库中的序列比对,体外合成猪尼帕病毒(NPV)N基因和非洲猪瘟病毒(ASFV)p27基因中相对保守的序列,分别克隆至pGEM-5zf载体,构建重组质粒pGEM-N和pGEM-p27。将重组质粒pGEM-N线性化之后,采用MEGAscript T7试剂盒体外转录后LiCl沉淀,70%乙醇洗涤后溶于无RNase的ddH2O中,核酸电泳检测RNA合成的完整性和正确性。测定上述质粒和RNA浓度,换算成拷贝数后备用。
1.5 样品DNA或者cDNA及预扩增的制备 利用DNA/RNA共提取试剂盒同时提取129份临床样品、各菌株和各病毒株的DNA和RNA,按照One StepAhead RT-PCR Kit说明书进行一步法RT-PCR反应。25μL反应体系:10μL One Step Ahead RT-PCR Master MIX,1μL One Step Ahead RT-MIX,5μL 样品DNA或RNA,5μL反转录和预扩增引物混合液(终浓度为每条引物0.5μM),4μL H2O补足。反应条件:50℃10min,95℃5min;95℃15 s、55℃20 s、72℃20 s,40个循环;72℃2min。
1.6 检测4种病原的MLPA方法的建立 MLPA反应程序按照SALSA MLPA EK1 Reagent试剂盒说明书进行。取0.2m L PCR反应管,每管加入上述ASFV、NPV的cDNA以及C.perfringens、A.plearopneumoniae的DNA各1μL再加入1μL TE,使模板量达到5μL后进行下列反应:98℃变性5 min,降至室温25℃,加入3μL混匀的探针(每种病原探针终浓度为1.33 nm)混合液,95℃温育1 min,60℃杂交4 h,54℃温育,加入32μL连接酶混合物,54℃温育15 min,98℃加热5 min灭活连接酶。室温下加入10μL PCR混合物,开始PCR反应,反应条件为:95℃30 s,60℃ 30 s,72℃ 60 s,35个循环;72℃孵育20 min,降至15℃。扩增产物经全自动核酸分析仪(Qsep100 DNA Analyzer,BIOptic)进行毛细血管电泳分析。
1.7 特异性测试
1.7.1 单一探针特异性试验采用每种病原探针分别对该4种病原的DNA/cDNA进行MLPA扩增,对每种病原探针分别与不同病原探针对应的反应体系进行特异性试验,以验证不同病原探针之间是否会发生交叉反应。
1.7.2 混合探针特异性测试将4种病原探针混合分别对NPV、ASFV、C.perfringens、A.pleuropneumoniae、PCV2、PEDV、JEV、PRV、PPV、PRRSV、CSFV的DNA/cDNA和无病原对照(TE)为模板进行MLPA扩增。测试混合探针能否从各自的病原核酸中扩增出单一的特异性扩增峰,验证探针混合之后是否会引起非特异性交叉反应。
1.8 灵敏度试验 将pGEM-N体外转录的RNA,pGEM-p27、pGEM-plc和 pGEM-Apx IVA质粒 DNA各10倍倍比稀释,每个浓度取5μL进行MLPA反应,以确定各病原的检测限,按以下公式计算拷贝数:(拷贝 /μL)=(6.02×1023拷贝 /mol)×(浓度 μg/μL)/(MW g/mol)。
1.9 临床样品的检测 将129份临床样品按照前述方法提取其总核酸后进行预扩增,用本研究建立的多重MLPA检测方法进行检测。同时,取5μL样品DNA/RNA利用TOYOBO反转录试剂盒反转录后,采用国家或行业标准[6-9]对NPV、ASFV、C.perfringens、A.pleuropneumoniae进行PCR检测,比较二者检测结果,并计算两种方法的符合率。对结果不一致的样品再用行业标准进行两次PCR检测,对检测结果进行统计以评估MLPA临床检测效果。
2 结果
2.1 重组质粒的构建和体外转录RNA的鉴定 以C.perfringens和A.pleuropneumoniae菌株提取的DNA为模板,利用设计的引物进行PCR扩增,结果获得预期大小的片段,回收纯化后克隆至pGEM-5zf载体,经测序正确后表明正确构建了重组质粒pGEM-plc和pGEM-ApxIVA。体外合成的重组质粒pGEM-p27和pGEM-N经测序正确后表明构建成功。将重组质粒pGEM-N线性化并体外转录,通过核酸电泳检测显示体外转录的RNA片段大小正确,且完整性良好(图略)。经计算各质粒及体外转录的RNA 分别为 1.4×1010拷贝 /μL、3.7×1010拷贝 /μL、3.5×1010拷贝 /μL、3.5×1010拷贝 /μL。
2.2 探针特异性测试结果 分别以NPV、ASFV、C.perfringens与A.pleuropneumoniae的DNA/cDNA和无病原对照(TE)为模板,利用相应的特异性探针进行MLPA扩增。结果显示,单一探针只能从对应病原中扩增得到特异性条带,大小分别为116 bp、126 bp、135 bp和144 bp,均与预期一致(图1)。表明本研究设计的4种猪病病原MLPA探针及对应的反应体系特异性良好,均仅能检测出对应的目的病原,与其他病原无交叉反应。
分别以不同病原的DNA/cDNA和无病原(TE)对照为模板,采用这4种病原体的混合探针进行MLPA扩增。结果显示,仅NPV、ASFV、C.perfringens、A.pleuropneumoniae分别在约118 bp、128 bp、137 bp、148 bp处有单一特异性扩增峰,均与预期相符,其它病原体无任何扩增信号(图2)。表明本研究设计的4种探针特异性较好,混合后其特异性没有受到影响。
2.3 检测4种病原的MLPA方法的建立 将NPV、ASFV、C.perfringens与A.pleuropneumoniae的混合DNA/cDNA按照1.6的方法进行MLPA扩增。结果显示,以混合病原为模板,一个MLPA反应同时扩增出了116 bp、126 bp、135 bp、144 bp的4条特异性条带,分别对应于上述各病原的N、p27、plc、ApxIVA基因片段,与预期上述相符(图3)。表明建立的MLPA方法可以同时检测到样品中的NPV、ASFV、C.perfringens、A.pleuropneumoniae4种病原。

图1 单一探针特异性MLPA扩增结果Fig.1 The specificity test of MLPA assay by using a single pair of probes
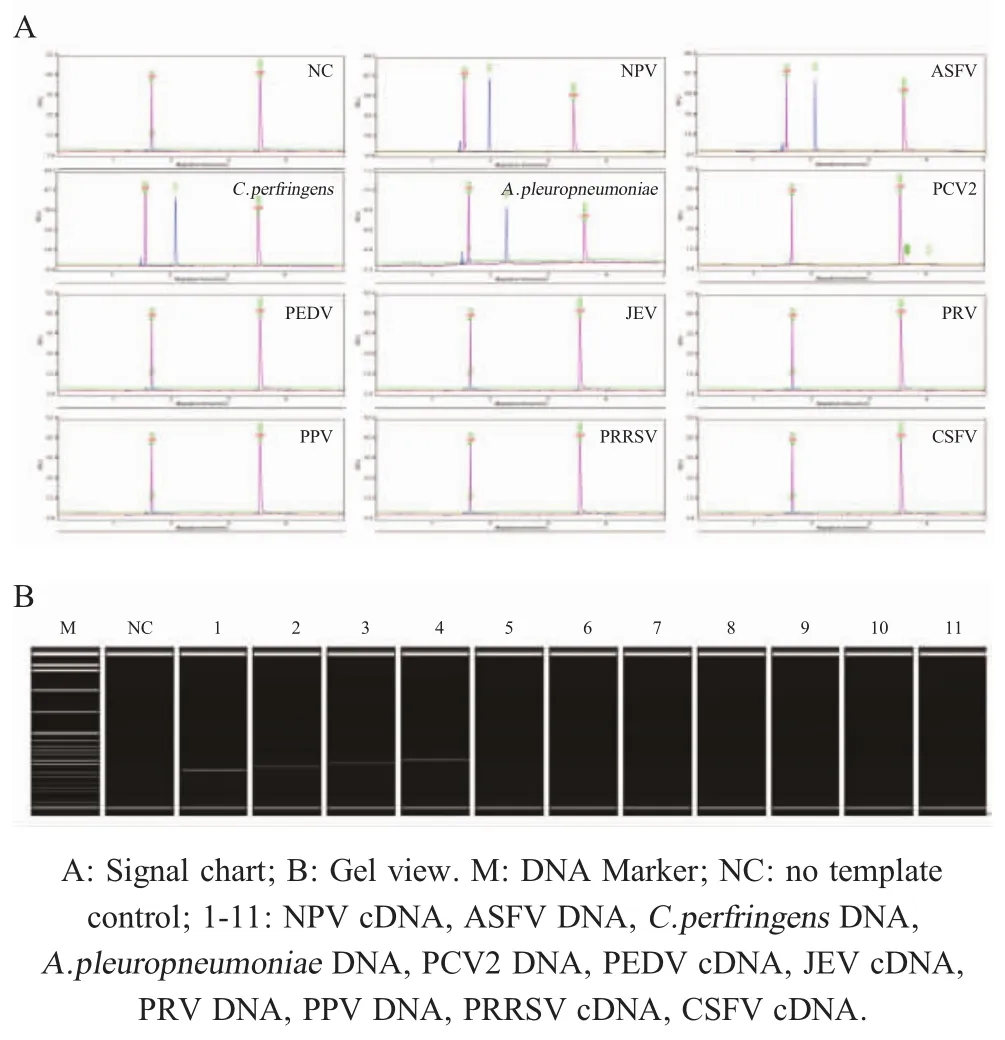
图2 混合探针特异性扩增结果Fig.2 The specificity test of the MLPA assay by usingmixed probes
2.4 灵敏度测试结果 以不同稀释度的含4种病原的质粒作为模板进行MLPA扩增。结果显示,该方法最低检测到的 NPV、ASFV、C.perfringens和A.pleuropneumoniae4种病原体的拷贝数分别为3.5×102拷贝 /μL、1.4×102拷贝 /μL、3.7×102拷贝 /μL、3.5×102拷贝/反应。表明该方法对4种病原检测灵敏度均较高。
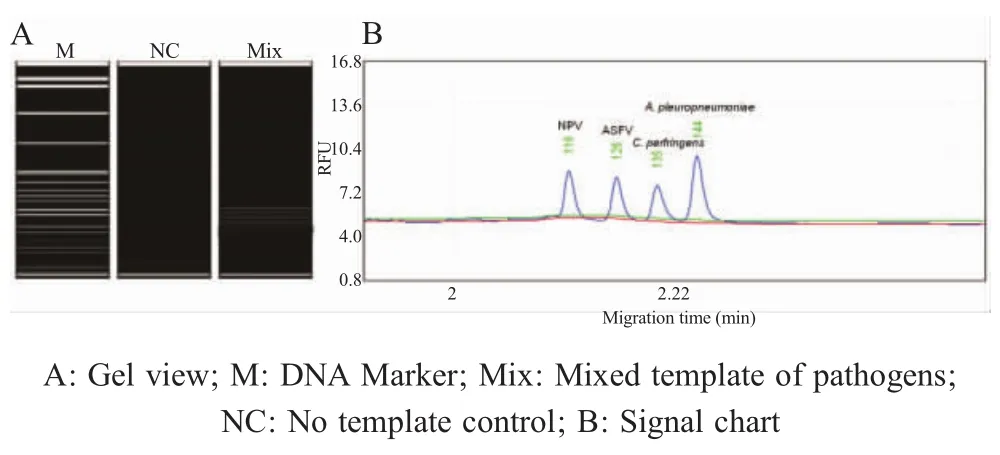
图3 4种病原的MLPA扩增结果Fig.3 Amplification of four target pathogens by MLPA assay
2.5 临床样品检测结果 对129份临床样品进行反转录和预扩增后进行MLPA扩增,结果显示,建立的MLPA方法可检测出5份C.perfringens阳性样品和5份A.pleuropneumoniae阳性样品,未检出NPV或ASFV阳性样本。采用国家或行业标准检测结果与MLPA方法检测结果一致(表3),二者的符合率为100%。经计算,MLPA方法的特异性、敏感性均为 100%(表 4)。C.perfringens和A.pleuropneumoniae的Kappa值均为1(表4)。Kappa值大于0.75说明MLPA方法与国家或行业标准所用的PCR方法检测结果的一致性较好。表明本研究建立的MLPA方法可用于临床检测。
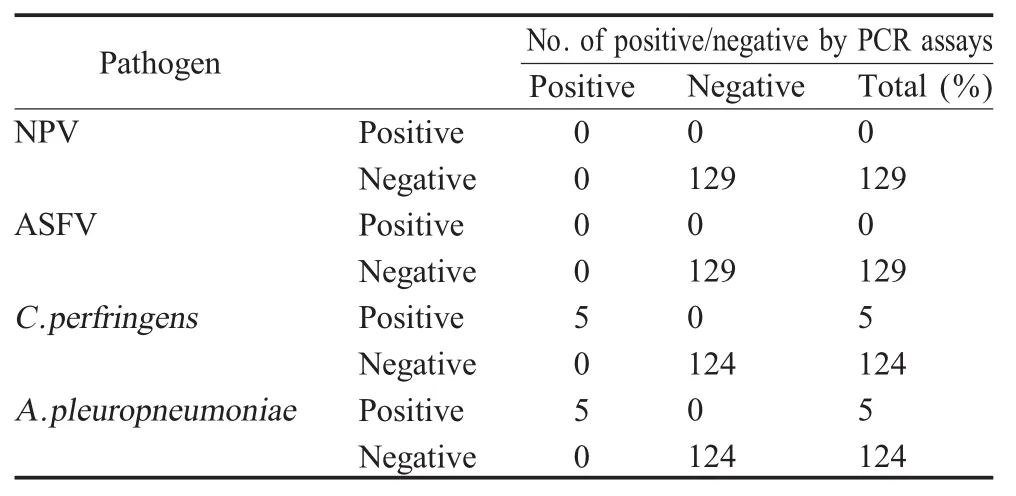
表3 129份临床病料中MLPA检测方法与PCR检测方法的结果分析Table 3 Comparison of the results obtained by the MLPA assay with PCR assays in 129 clinical specimens
3 讨论
病原学检测是确诊动物传染病的主要手段,但病原的分离鉴定相当耗时,而且由于诸多因素的干扰,其敏感性很低,不适合疾病的快速诊断。PCR技术具有敏感性高、特异性强等优点,但其多是针对单一病原进行的,而动物疾病的流行却出现了多种病毒细菌混合感染,现有诊断技术不能很好地满足快速、高通量检疫的需求,动物疾病多重检测新技术的研究已经成为动物疫情监测、疫病控制领域关注的焦点。MLPA最早于2002年由荷兰的Schouten报道[10],该技术已经在人类基因或基因片段的缺失或重复,单核苷酸多态性(SNP)和点突变,染色体重排,基因甲基化定量以及传染病的高通量检测等多个领域中得到广泛应用[11-12]。MLPA具有高度的特异性,能够检测单个碱基的突变和拷贝数的微量变化。该方法敏感度也很高,只需要50 ng DNA或3 000个细胞即能检测。MLPA在基因遗传性疾病研究及临床监测中发挥了重大作用,如MLPA已用于遗传性非息肉性结直肠癌的鉴别以及卵巢癌和乳腺癌患者的预后检测等。近些年该方法逐渐应用于传染病高通量检测,应用前景广阔。Reijans等建立了可以同时检测15种呼吸道病毒的MLPA方法,敏感性与单重荧光定量PCR相当,但检测通量大幅度提升[13]。Muvunyi等建立了MLPA同步检测7种性传播疾病的方法,结果用单重荧光定量PCR验证,符合率达到100%[14]。De Smet等建立了可以同时检测10种蜜蜂病毒的逆转录-MLPA(RT-MLPA)高通量检测技术,并能同时区分RNA病毒的正负链[15]。史喜菊等建立的猪流感病毒、伪狂犬病病毒、口蹄疫病毒、猪传染性胃肠炎病毒和猪繁殖与呼吸综合征病毒共5种病毒的MLPA检测方法,实现一次采样,同时检测5种猪病病原的目的[16]。Kim等利用MLPA技术建立了同时检测13种食源性致病菌的高通量技术[17]。

表4 与行业标准相比MLPA检测方法敏感性与特异性结果分析Table 4 Sensitivities and specificities of MLPA in relation to reference standards
MLPA技术的关键是引物的设计。本研究针对病毒和细菌相对保守的基因设计了4对探针。并在NCBI数据库中进行BLASTn分析比对,以确保探针的特异性。为了保证易于区分不同病原体,每个病原体的大小区分至少在5 bp以上,各扩增片段长度相差要满足此要求才能直接判断结果。本研究中每个病原体的探针大小均相差9 bp~10 bp。为了使MLPA检测的灵敏度与荧光定量PCR相当,本研究增加了反转录和预扩增环节。MLPA扩增的目的片段长度差距比较小,一般凝胶电泳无法区分,检测结果需要毛细管电泳才能分离。通过设立阳性质粒对照,可以通过读取扩增片段的碱基数直接进行结果的判定。
PCR是一种快速灵敏的检测方法,但是传统的PCR方法无法做到4重病原以上的检测,难以用于高通量病原检测,且检测成本较高。MLPA方法能够检测多达45种靶标,可以满足临床快速、高通量鉴别诊断的要求。由于所有反应在一管内进行,可以减少繁琐的操作以及降低检测成本。通过比较129份临床样品的MLPA和PCR检测结果确定了MLPA方法的敏感性和特异性。临床样品检测表明,细菌性疾病发病率较低。本实验未检出ASFV和NPV,但是今年8月以来,非洲猪瘟首次传入我国,辽宁沈阳、河南郑州、江苏连云港、浙江温州先后发生了4起非洲猪瘟疫情,需要引起重视。NPV是一种新出现的人畜共患病,被列为生物安全4级病原,虽然我国未有该病的报道,但我国毗邻东南亚和南亚地区的疫情国家,导致该病传入我国的风险始终存在。
本研究建立了一种快速鉴别检测NPV、ASFV、C.perfringens和A.pleuropneumoniae4种病原体的高通量检测技术。该方法特异性强、敏感性高,可在20 h内检测出4种病原。显著降低了检测多种病原体混合感染的人力、物力和财力。适用于临床病原体的鉴别检测和相关疫病的应急诊断。
