miR-132在动脉粥样硬化中的表达及对缺氧诱导的血管内皮细胞增殖凋亡的影响
2019-05-10梁慧敏李玉珠郑永丽孙娇高洋
梁慧敏 李玉珠 郑永丽 孙娇 高洋
(河南大学淮河医院神经内科,河南 开封 475000)
研究表明,小分子RNA(miRNA)在动脉粥样硬化斑块形成及发展过程中起重要的基因调控作用〔3〕,其参与血管平滑肌细胞的增殖和迁移、巨噬细胞功能形成及内皮细胞功能变化〔4,5〕。miR-132是内皮细胞特异性miRNA之一,在心血管疾病调节方面发挥重要作用〔7〕。在内皮细胞中,miR-132可通过调节鸟苷三磷酸(GTP)酶活性蛋白P120RasGAP,参与静态内皮细胞的增殖、活性、迁移及毛细血管生成〔8〕。对患有视网膜疾病及癌症的小鼠眼球miR-132的拮抗剂可抑制小鼠病变部位血管生成,阻止病情发展〔9〕。在动脉硬化发生及发展中miR-132的作用研究的尚未清楚。本研究探讨miR-132在动脉粥样硬化中的表达及对缺氧诱导的血管内皮细胞增殖凋亡的影响。
1 材料方法
1.1研究对象 收集河南大学淮河医院2014年2月至2016年6月动脉粥样硬化患者50例为动脉硬化组,患者均符合动脉粥样硬化入选标准,其中男23例,女27例,年龄51~80岁,平均年龄为(68.8±10.5)岁。患者均未曾服用过心血管药物或自行停服1 w以上,患者均无吸烟史、慢性心力衰竭、血液循环疾病、急性心脑血管病、恶性肿瘤、严重肝肾功能异常等。另选择50例性别、年龄等相匹配的体检正常者作为对照组,其中男25例,女25例,年龄48~79岁,平均年龄(66.2±9.7)岁。
1.2主要试剂和仪器 胎牛血清、ECM培养基、LipofectamineTM2000转染试剂盒均购自美国Gibco公司;二喹啉甲酸(BCA)试剂盒、CCK8试剂盒、膜联蛋白V-FITC(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡试剂盒均购自碧云天生物技术研究所;总RNA提取试剂盒、逆转录试剂盒均购自大连TaKaRa;活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-3、磷脂酰肌醇3-激酶(PI3K)、磷酸化的蛋白激酶B(p-AKT)抗体均购自美国abcam公司;酶标仪、流式细胞仪均购自美国Bio-Rad公司;PCR扩增仪购自德国Eppendorf公司。
1.3miR-132基因mRNA表达水平测定 RNA提取试剂盒提取对照组及动脉硬化患者全血中的总RNA,反转录试剂盒将总RNA逆转录为cDNA,以U6作为内参,以cDNA为模板按照试剂盒的操作说明扩增miR-132基因。所有引物通过Oligo7.0软件设计,由上海生工合成。实验数据(Ct值)采用2-△△Ct法进行统计。
1.4细胞培养 人脐静脉血管内皮细胞(HUVECs)从脐带静脉提取,用ECM完全培养液置于37℃,5% CO2培养箱中培养,24 h后更换培养液去除未贴壁的细胞,之后每2 d换液1次直至细胞生长融合。实验为对数生长期的细胞。
1.5细胞转染及转染效果检测 细胞转染按照LipofectamineTM2000转染说明进行操作。转染前将人脐静脉血管内皮(HUVECs)细胞接种至6孔细胞培养板中,细胞生长达到80%融合时可进行转染。转染分为3组,即空转染组(细胞加入脂质体)、阴性对照组(细胞加入脂质体及阴性对照组试剂)和转染组(细胞加入脂质体及miR-132抑制剂)。转染48 h后,按照1.3方法检测各组细胞中miR-132 mRNA表达量。
1.6细胞增殖检测 HUVECs细胞分为3组:正常培养组、缺氧组、缺氧+miR-132抑制剂组。利用AnaeroPack-Anaero厌氧培养产气袋建立内皮细胞缺氧培养模型。缺氧培养HUVECs细胞48 h,收集细胞。每孔细胞中加入10 μl的CCK8溶液,37℃孵育4 h。利用空白对照孔调零,酶标仪490 nm波长下测定各孔吸光值(A),实验重复3次。
1.7细胞凋亡检测 Annexin V-FITC/PI双染法检测细胞凋亡。取按照1.6分组培养48 h的细胞,加入预冷的磷酸缓冲液洗涤细胞,调整细胞浓度为1×106个/ml。按照细胞凋亡试剂盒的操作说明检测各组细胞的凋亡情况。
1.8Western印迹法 取上述分组培养48 h的细胞,加入适量的RIPA裂解液提取细胞中的蛋白,应用BCA试剂盒将各样本蛋白定量,每泳道30 μg蛋白样品经10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转法将凝胶上蛋白质转移至聚偏氟乙烯(PVDF)膜上,5%的脱脂奶粉封闭,4℃孵育Cleaved Caspase3、PI3K、p-AKT(1∶1 000稀释)、GAPDH(1∶5 000稀释)一抗过夜,充分洗膜后加入辣根过氧化物酶标记的羊抗鼠免疫球蛋白(Ig)G,再次洗膜后置于暗室中显影、定影。
1.9统计学方法 采用SPSS21.0软件进行单因素方差分析、t检验。
2 结 果
2.1动脉硬化中miR-132的表达 对照组及动脉硬化组中miR-132 mRNA表达分别为(0.904±0.173)、(6.265±0.827),miR-132在动脉硬化组中的表达显著高于对照组(t=10.990,P=0.000)。
2.2各组细胞中miR-132 mRNA的表达 空转染组、阴性对照组及转染组miR-132 mRNA表达分别为(1.000±0.110)、(1.005±0.112)、(0.218±0.051),阴性对照组miR-132 mRNA表达与空转染组差异无统计学意义(t=0.055,P=0.959),而转染组miR-132 mRNA表达显著低于空转染组(t=11.171,P=0.000)。
2.3抑制miR-132表达可促进缺氧诱导的HUVECs细胞增殖 缺氧组及缺氧+miR-132抑制剂组细胞的增殖均显著低于正常培养组(均P<0.05),而缺氧+miR-132抑制剂组细胞的增殖显著高于缺氧组(P<0.05)。见表1。
2.4抑制miR-132表达可降低缺氧诱导的HUVECs细胞凋亡 缺氧组及缺氧+miR-132抑制剂组的细胞凋亡率显著高于正常培养组(P<0.05),而缺氧+miR-132抑制剂组的细胞凋亡率显著低于缺氧组(P<0.05)。见表1。
2.5抑制miR-132表达对缺氧诱导的HUVECs细胞Cleaved Caspase3、PI3K、p-AKT蛋白表达的影响 见表1、图1。

表1 各组细胞增殖、凋亡率及Cleaved Caspase3、PI3K、p-AKT的蛋白表达比较
与正常培养组比较:1)P<0.05;与缺氧组比较:2)P<0.05
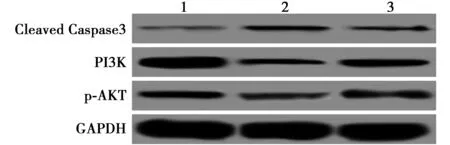
1:正常培养组;2:缺氧组;3:缺氧+miR-132抑制剂组图1 Western印迹检测Cleaved Caspase3、PI3K、p-AKT的蛋白表达
缺氧组及缺氧+miR-132抑制剂组Cleaved Caspase3的蛋白表达显著高于正常培养组(P<0.05),PI3K、p-AKT蛋白表达显著低于正常培养组(P<0.05);缺氧+miR-132抑制剂组Cleaved Caspase3蛋白表达显著低于缺氧组(P<0.05),PI3K、p-AKT蛋白表达显著高于缺氧组(均P<0.05)。
3 讨 论
动脉粥样硬化是心血管疾病的一个主要危险因素,内皮细胞功能异常是其一系列改变的始动者。研究发现,miRNA可能在动脉粥样硬化的进程中发挥重要作用〔10〕。miRNA是一种内源性表达的非编码小分子RNA,在转录后水平调节基因的表达,其表达模式的改变可影响血管内皮细胞的功能〔11〕。在动脉粥样硬化形成过程中,血管内皮细胞的变化发挥重要作用〔12〕。血管内皮细胞的增殖及迁移促进了粥样斑块的形成,加速了冠状动脉粥样硬化的进程〔13〕。而内皮细胞的增殖、迁移受到miRNA的调控。如miR-221可通过靶向p27促进血管内皮细胞增殖〔14〕;miR-143的缺失或减少可促进血管内皮细胞的增殖、迁移和分化,从而促进冠状动脉粥样硬化的发生〔15〕。miR-132在动脉粥样硬化中的研究较少。有研究显示,在正常血管内皮细胞形成及再生中,血管壁内皮细胞miR-132表达升高,在人脐静脉内皮细胞中,miR-132可通过抑制信息调节因子2相关酶(SIRT)1表达,控制胆固醇及脂肪生成〔16,17〕。这提示miR-132在动脉粥样硬化中有重要作用。
本研究中检测到miR-132在动脉粥样硬化中高表达,通过建立内皮细胞缺氧培养模型,并经脂质体将miR-132的抑制物转染至细胞,检测细胞的增殖及凋亡情况。结果显示,缺氧可显著降低细胞的增殖,诱导细胞的凋亡,上调Cleaved Caspase3蛋白表达,而miR-132的抑制物可减弱这种效应。细胞凋亡受到多种途径的调控,其中Caspase家族在细胞凋亡过程中发挥重要作用。Caspase3是Caspase家族的关键酶,在正常组织中主要以无活性的形式存在,多种凋亡途径最终都会引起Caspase3的活化,其活化是凋亡进入不可逆阶段的标志〔18,19〕。有研究显示,在动脉粥样硬化中Caspase3的表达上调〔20〕。这说明miR-132可通过调节Caspase3表达降低血管内皮细胞凋亡。
PI3K/AKT信号通路在炎症反应、多种肿瘤细胞中均发挥重要作用,该通路中相关的分子、基因的表达异常可引起细胞的增殖、侵袭、凋亡的异常〔21〕。研究显示,PI3K/AKT信号通路参与动脉粥样硬化的形成,包括平滑肌细胞功能异常、内皮细胞凋亡、血管收缩、炎症细胞聚集等〔22〕。在动脉粥样硬化发展过程中,缺氧、炎症因子、氧化应激等可导致PI3K及磷酸化的AKT迅速失活,使凋亡基因表达上调,从而诱导内皮细胞的凋亡〔23〕。本研究为了进一步研究引起血管内皮细胞增殖凋亡的机制,通过Western印迹检测PI3K/AKT信号通路PI3K、p-AKT的表达,结果显示,抑制miR-132表达可上调PI3K、p-AKT的表达。这说明抑制miR-132表达可通过激活PI3K/AKT信号通路影响细胞的增殖凋亡。
综上所述,miR-132在动脉粥样硬化中高表达,抑制其表达可减弱由缺氧诱导的血管内皮细胞的增殖降低及凋亡增加,其机制与激活PI3K/AKT信号通路有关。
