MSCs来源外泌体在脑卒中中的研究进展
2019-05-10孙思茂王笑竹严晓铭综述3审校
孙思茂, 李 浩, 王笑竹, 严晓铭综述, 薛 群,2,3审校
脑卒中(Stroke)为脑血管疾病的主要临床类型,以突然发病、迅速出现局限性或弥散性脑功能缺损为共同临床特征,是目前导致人类死亡的第二原因,它与心脏病、恶性肿瘤构成人类三大致死疾病。脑卒中包括缺血性脑卒中(ischemic stroke)和出血性脑卒中(hemorrhagic stroke),在中国,70%~80%脑卒中为缺血性脑卒中,缺血性脑卒中治疗的主要目标是症状出现后尽快恢复血流,实现再通的两种主要方法是静脉溶栓治疗和血管内介入治疗,而这两种有效途径均存在严格的治疗时间窗(therapeutic time window,TTW)。对于出血性脑卒中而言,具体治疗包括内科保守治疗及外科手术治疗,良好的脑保护可有效降低死亡率[1]。数千种在动物模型中测试有效的神经保护药物在临床试验中却失败了[2],因此,寻找治疗脑卒中的替代疗法迫在眉睫。
值得注意的是,一种新型治疗手段-外泌体治疗脑卒中已经有相当多的研究及报道,例如,MSCs来源的外泌体被发现在卒中促进神经血管重构和神经功能恢复的主要机制中发挥重要作用[3]。本文就外泌体对脑卒中特别是缺血性脑卒中的应用及其可能的机制进行综述,并对其临床应用所面临的问题及使其进一步优化的技术进行探讨。
1 间充质干细胞(Multipotent mesenchymal stromal cells,MSCs)
间充质干细胞(MSCs),是由骨髓、脂肪组织、皮肤、脐带血和外周血以及其他器官共同获得的间充质干细胞和祖细胞组成的异质性亚群,具有高度自我更新能力与多向分化潜能,目前已应用于临床治疗心肌损伤性疾病、神经损伤性疾病(包括神经系统疾病、外伤及卒中)等[4]。骨髓间充质干细胞扮演多个角色,他们可以分化成为多个谱系,可以参加组织细胞治疗。骨髓间充质干细胞产生多种细胞因子和生长因子(见图1),这些物质可以影响其他细胞生成、减轻炎症、增强祖细胞的增殖、改善组织修复和减轻感染。目前普遍认为,MSCs通过旁分泌抑制炎症、重组免疫细胞、激活内源性修复途径来治疗疾病。然而,干细胞治疗仍存在许多问题,干细胞自身存在着异常分化、免疫排斥、技术操作难度较大、潜伏着极大的生物安全和医疗隐患风险等,因此,干细胞移植治疗在诸多疾病中的应用的到了限制。最新研究表明,MSCs产生一种胞外的囊泡,这种囊泡携带mRNAs、miRNA和蛋白质,通过传递这些物质可以起到治疗疾病的作用[5]。这些囊泡在先前用细胞本身测试的实验系统中进行测试。 值得注意的是,囊泡制剂的治疗在许多情况下显示出与MSCs移植治疗非常相似的结果,同时避免了与细胞移植相关的许多风险。
2 外泌体(exosomes)
外泌体(exosomes)是细胞分泌的具有磷脂双分子层的囊泡结构,与其他直径为100~1000 nm直接起源于细胞膜的胞外囊泡(extracellular vesicles,EVs)不同,外泌体起源于细胞的内体系统。首先细胞膜内陷形成初级内体,内体膜再次内陷形成多个管腔内泡(intraluminal vesicles,ILVs),此时包含多个ILVs的内体即次级内体也叫做多泡体(muihivesicular body,MVB)[6]。MVB膜与细胞膜融合而释放的直径为30~100 nm的脂质双分子层囊泡即为外泌体(见图2)。外泌体主要运载内源性蛋白、脂质、核酸等物质,通过靶细胞内化、受体-配体间相互作用或脂质膜融合在细胞间进行传递[5~7]。
外泌体具有的脂质双分子层用于运输和保护腔内的物质免受细胞外环境的破坏,这种脂质双分子层表面还包含多糖和多聚糖,主要由多乳糖胺、α-2,3和α-2,6-唾液酸,甘露糖以及复杂多链肽聚糖。此外,脂质双分子层还包含各类蛋白,其中很多已被证实是外泌体特殊的生物标记物。Keerthikumar等在外泌体中发现的CD9、CD81、CD63以及TSG101都可以用来区别外泌体及其他囊泡结构[8]。
外泌体腔内还包括各种物质(如RNA、DNA、蛋白质、肽和脂质衍生物): 2007年,Valadi等人首次证实外泌体内存在RNA,包括mRNA、miRNA和一些非编码RNA[9]。此外,外泌体还携带单链DNA、双链DNA、扩增的致癌基因序列、转录因子和线粒体DNA。外泌体也可以携带蛋白质和多肽,Laura Otero-Ortega所在团队通过蛋白组分析,已经在MSCs来源的外泌体中鉴定出2416种蛋白质,它们全面涉及分子调节、结合和催化功能[10]。此外,外泌体含有参与脑修复功能的蛋白质,包括突触传递、神经干细胞的神经分化、血管生成、神经投射、突触生长等。同时,外泌体中还包含一系列与细胞类型无关的共同存在的蛋白质(包括外泌体形成的调节蛋白)以及不同组织细胞所特有的特异性蛋白[11]。
除了RNA、DNA和蛋白质外,外泌体还富含某些脂质,主要是神经酰胺、胆固醇、磷脂酰丝氨酸和鞘脂质[11]。
3 缺血性脑卒中的病理生理学
缺血性脑卒中是脑梗死核心组织缺氧、缺糖所致[1,12],发病后不久,由于缺乏ATP,能量生产中断,钠钾泵不能维持细胞膜电位,这导致去极化和细胞内钙离子浓度的增加,细胞内钙离子的增加会引起活性氧、磷脂酶和蛋白酶的过量产生导致细胞死亡,引起炎症及免疫反应,进一步破坏血脑屏障(blood-brain barrier,BBB)[12]。
缺血性脑卒中病灶区可分为梗死核区和缺血半暗带。缺血半暗带位于梗死核心区和正常组织之间。虽然梗死核核心内的脑细胞在最初几分钟内受到了不可逆转的损伤,但血流的恢复可以减轻细胞损伤和梗死进展到缺血半暗带,因此缺血半暗带可以被挽救。血供恢复时间越短,缺血损伤越小,再灌注损伤的诱导机会越小。挽救缺血半暗带是急性脑梗死治疗的一个主要目的;而恢复缺血脑组织的供血以及对缺血脑组织实施保护是挽救缺血半暗带的两个基本治疗途径[13]。
4 MSCs来源外泌体在缺血性脑卒中治疗和诊断中的发现
与肿瘤外泌体的研究相比,外泌体在脑卒中中的应用研究较少,主要集中于MSCs来源的外泌体的神经保护和神经修复作用,其可能存在的修复机制总结(见表1)。然而,由于缺乏对外泌体的严格定义,以及缺乏分离外泌体的有效和经济的方法,外泌体的研究受到了限制。
脑卒中过程按时间分为4个阶段,即超急性期缺血性脑卒中(HIS,6 h内);急性期缺血性脑卒中(AIS,第1~7天);亚急性期缺血性脑卒中(SIS,第8~14天);缺血性卒中恢复期(RIS,d>14)[1]。研究表明,外泌体中的miRNA在卒中的不同时期存在差异;SIS和RIS的血浆外泌体miR-21-5p水平高于对照组,HIS的miR-30a-5p水平明显高于对照组,AIS(第1~ 3天)则低于对照组。血浆来源的外泌体miR-21-5p和miRNA-30a-5p联合应用有望成为诊断缺血性卒中和区分不同缺血性卒中分期的生物标志物[18]。
5 外泌体在缺血性脑卒中诊断和治疗中的应用
5.1 外泌体与缺血性脑卒中诊断 外泌体携带了反映母体细胞起源和病理生理条件的核酸和蛋白质,此外,与直接存在于血液中的miRNA相比,由于囊泡结构的存在,外泌体miRNA受到保护不被降解,使得外泌体miRNA成为更有用的生物标志物载体。外泌体在包括血液、血浆和血清在内的所有体液中均存在,具有特异性,易于分离和分析,是一种有易得的诊断应用的生物标志物载体[19]。
不同缺血时间血浆外泌体rno-miR-122-5p和rno-miR-300-3p含量差异较大,可作为TIA的潜在生物标志物。Li等人检测了55名缺血性脑卒中患者和25名健康志愿者的外泌体;检测miR- 422a和miR-125b-2-3p血浆外泌体水平,探讨其在不同IS分期(急性期和亚急性期)的潜在预测价值。亚急性期血浆外泌体miR-422a和miR-125b-2-3p表达水平明显降低,急性期miR-422a表达水平较对照组升高[20]。血浆来源的外泌体miR-21-5p和miRNA-30a-5p联合应用是诊断IS分期和鉴别缺血性卒中持续时间的一种有理论上十分可行的生物标志物。急性缺血性脑卒中患者的外泌体miR-223、miR-9和miR-124明显高于健康人,外泌体miR-223、miR-9和miR-124的表达与美国国立卫生研究院卒中量表(NIHSS)评分呈正相关[21]。这意味着外泌体miR-223、miR-9和miR-124是诊断AIS和评估缺血性损伤程度的有潜力的生物标志物。
5.2 MSCs和外泌体治疗缺血性脑卒中 MSCs是一种多功能干细胞,具有分化成多种组织特异性细胞的能力,可从骨髓、胎盘、脐带、脐血和脂肪组织中分离提取[4]。MSCs疗法在脑卒中的治疗中具有广阔的应用前景,除了用MSCs替代受损细胞外,MSCs还可以促进神经可塑性、血管生成和免疫调节作用。最近的研究发现,骨髓MSCs通过外泌体实现神经系统的恢复。Doeppner等人将MSCs与局部脑缺血后给予小鼠的MSCs源性外泌体进行了比较,发现MSCs和MSCs源性外泌体均能促进缺血性脑卒中后28 d血管生成和长期神经保护改善[22]。
在急性缺血性脑卒中中,抑制自噬可改善缺氧缺血的炎症作用。脂肪来源的干细胞分泌的外泌体(ADSC)含miR-30d-5p可抑制自噬介导的少突胶质细胞向M1分化,从而预防脑损伤[23]。将有谷氨酸兴奋毒性的皮质神经元与脂肪源性间充质干细胞(AMSC)共培养(AMSC-CM),与未处理对照组相比,实验组神经细胞损伤减少,乳酸脱氢酶(LDH)释放减少,凋亡细胞数量减少[24]。
此外,有研究表明,MSCs治疗后,miR-133b水平升高,MSCs通过外泌体传递miR-133b从而调节神经生长。MSCs分泌的外泌体过表达的miR -133b通过刺激星形胶质细胞外泌体的二次分泌,可以更好地促进神经功能的恢复,增加神经的可塑性[25]。富含miR-17-92的MSCs源性外泌体通过激活PI3K/Akt/mTOR/GSK-3b信号通路,促进神经恢复和神经可塑性[24]。
研究表明,MSCs主要通过分泌外泌体在神经保护和修复中发挥作用。然而,注射骨髓间充质干细胞可能导致血管闭塞,并始终存在肿瘤发生的风险。与细胞疗法相反,外泌体无细胞疗法堵塞血管的风险,外泌体本身可以穿过血脑屏障并被修饰[26],MSCs来源的外泌体的特征总结(见表2)。尽管外泌体具有明显的优势,但如何在临床安全有效地应用外泌体仍存在一些问题需要解决,如何大规模获取外泌体,以及鉴别哪些外泌体具体神经修复作用以及如何提高外泌体治疗的靶向性亟待研究。

表1 MSCs来源的外泌体对脑卒中可能的治疗机制

表2 MSCs来源的外泌体的特点

图1 间充质干细胞的分化与分泌图谱
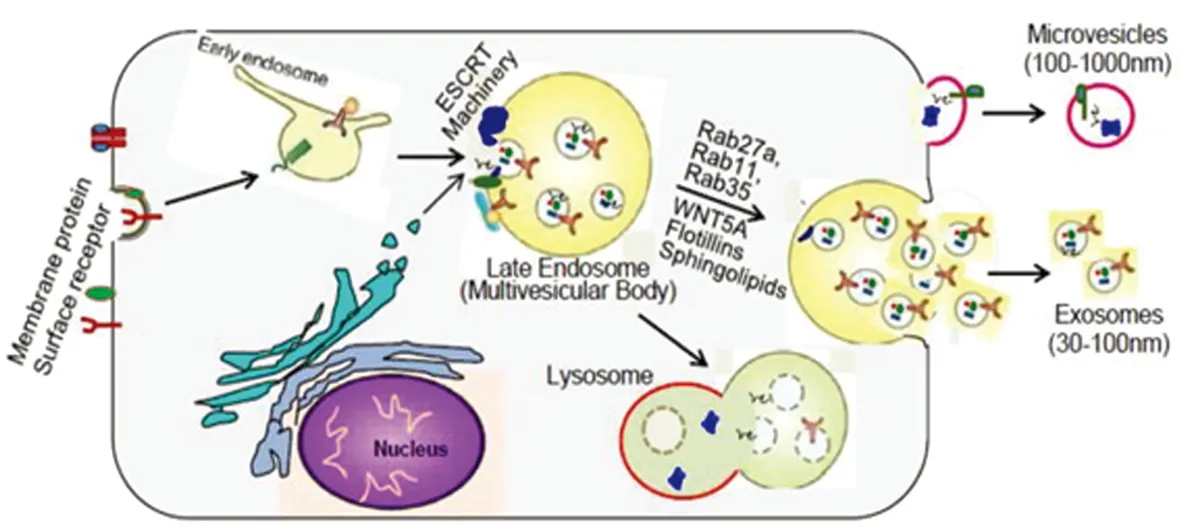
图2 外泌体的形成过程
6 外泌体在脑卒中治疗中的其他进展
在脑卒中的药理学治疗中,药物的安全性和有效给药给病灶区仍存在问题。外泌体作为药物载体具有免疫原性低、固有稳定性好、传递效率高、能跨BBB等优点[12]。然而,外泌体靶向能力的不足限制了其临床应用,一些研究人员对外泌体表面进行了修饰,增加了外泌体的靶向能力。有报道表明通过将c(RGDyK)肽结合到外泌体表面后治疗缺血性脑卒中,梗死区域的免疫抑制和抗凋亡作用均增强[29]。
外源性治疗可通过MSCs来源的外泌体或miRNA放大内源性神经修复过程,达到脑卒中后神经修复的作用。为了更有效地将miR-124传递到梗死部位,一些研究人员已经以融合了狂犬病毒糖蛋白 (RVG)以及与溶酶体相关的糖蛋白2b (Lamp2b)从而对外泌体进行修饰,发现修饰后的外泌体可以将基因药物输送到大脑起到治疗作用[30]。来自人类心源性细胞(CDCs)的外泌体具有许多可能对治疗急性缺血性脑卒中有益的特性,在兔的卒中模型中,栓塞后1 h静脉注射CDCs源性外泌体可有效降低行为缺陷,且无颅内出血危险。
7 目前在治疗方面的挑战
由于人群的异质性和卒中机制的复杂性,只有少数几种药理学药物在临床试验中获得成功并广泛适用于卒中患者的治疗。MSCs来源的外泌体治疗缺血性脑卒中虽然具有高度的可行性,但在应用于临床试验之前,仍有一些问题需要解决。首先,必须发展以低成本大规模获得外泌体的技术;其次,研发获得可靠的高纯度外泌体的分离技术;第三,进一步研究外泌体靶向药物治疗的准确性。由于外泌体的生物学特性,外泌体可以被认为是一种很有前景的药物载体,它可以使药物穿过甚至是完整的血脑屏障,到达梗死区域。外泌体作为一种外源性疾病治疗的优势在于其低免疫原性、低毒性、低生物降解性和跨血脑屏障的能力。因此,为提高靶向药物的准确性,外泌体修饰值得人们深入地研究与开发。
8 小 结
来自不同组织来源的MSCs可增强脑卒中动物实验模型的神经功能恢复已被证明,尽管有这些发现,但在脑卒中急性期治疗患者的困难性、MSCs移植治疗的风险以及维持干细胞活跃状态的高成本等限制了MSCs的使用。近年来,外泌体以其独特的特性在脑卒中诊断和治疗中的临床应用潜力引起了广泛的关注。由于没有足够的临床数据支持能将外泌体治疗应用于临床,因此,外泌体的诊断及治疗仍处于理论与实验阶段。然而,随着进一步外泌体诱导的分子的研发以及临床级外泌体的生产,外泌体应用于临床指日可待,必将促进新的治疗策略的发展,降低脑卒中死亡率,提高脑卒中患者的生活质量。
