雷洛昔芬通过抑制神经细胞凋亡保护脑缺血大鼠脑细胞的机制研究
2019-05-10刘文娟卢鹏超李志红
管 萍, 刘文娟, 卢鹏超, 李志红
脑血管病是一种常见的多发性疾病,死亡率和致残率较高,近年来我国死亡原因中排名第二[1]。急性缺血性脑血管病占脑血管疾病的43%~65%,死亡率为15%~25%,严重危害人类健康[2]。雷洛昔芬是一种选择性雌激素受体调节剂[3]。它是苯基唾液酚的合成非甾体衍生物,具有一定的组织特异性[4]。在生殖系统组织中,雷洛昔芬作为雌激素受体拮抗剂,可抑制乳腺和子宫肿瘤的生长,在生殖系统外的组织中起部分雌激素受体激动剂的作用,可以防止骨质钙流失和降低血清胆固醇水平[5]。
1 材料和方法
1.1 一般资料 选取体重在(240±20)g的雄性Wistar大鼠为研究。分为空白对照组、假手术组、雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组,每组10只大鼠。
1.2 实验方法
1.2.1 建立大鼠大脑中动脉栓塞模型 腹腔注射3.5%水合氯醛(0.35 g/kg),麻醉后分离右侧颈总动脉、颈外动脉、颈内动脉结扎。在颈总动脉近颈内外支切口处,通过切口将16 mm~17 mm长的尼龙绳插入颈总动脉内结扎。完全插入大脑中动脉。注射尼龙线后,动物的右眼睑下垂。动物在醒来后向左移动了一个圈,说明模型是成功的。假手术组颈总动脉、颈内动脉、颈外动脉分离结扎[6]。
1.2.2 分组及给药 将手术组随机分成3组即雷洛昔芬低剂量组(10 mg/kg bw)、雷洛昔芬中剂量组(50 mg/kg bw)、雷洛昔芬高剂量组(100 mg/kg bw),每天灌胃不同剂量的雷洛昔芬溶液,正常对照组及假手术组每天灌胃等剂量的生理盐水,自由进食,饲养30 d。
1.2.3 海马组织分离及培养 处死大鼠前,用酒精棉球擦拭全身,初步消毒。再次浸泡在75%的酒精中,1 min后取出,打破头部。将头皮和头骨切掉。打开大脑皮层,用眼钳取双侧海马,置于种植培养基培养皿中。显微镜下,用显微眼科钳切除脑膜,切除海马以外的脑组织。用DISGH溶液冲洗3次,用微眼剪(约1 mm)切断海马,加入0.125%胰蛋白酶溶液,在37 ℃培养箱中消化约20 min,加入与组织悬液等量的20%小牛血清培养基10 min,终止胰蛋白酶作用,添加10%胎牛血清和10%小牛血清的培养基,形成细胞悬浮液,细胞计数后,用DMEM溶液调节细胞密度至5×106,将细胞接种到培养皿中,5% CO2,95%空气,37 ℃恒温培养箱中培养,24 h后通过MTT实验测定其生长情况。
1.2.4 神经元加钙 取神经上皮组织,制成细胞悬液,用无镁BSS漂洗3次,加入含3 μmol Fluo-3/AM的无镁BSS 1 ml在CO2培养箱中培养20 min。然后用Fluo-3/AM游离无镁BSS代替原液,在二氧化碳培养箱中培养20 min,确保AM组在Fluo-3/AM细胞质冷却酶的作用下完全去除。
1.2.5 神经元内钙含量测定 细胞内钙浓度与Fluo-3荧光强度成正比,因此细胞内Fluo-3荧光强度代表细胞内钙浓度。激光共聚焦扫描显微镜(CLSM)可实时检测细胞内Fluo-3荧光强度的变化。荧光-3荧光激发波长为488 nm,发射波长为530 nm,激光激发强度调节到最小。在此条件下,Fluo-3本身的荧光猝灭在检测时间(900 s)内可以忽略不计。
1.2.6 神经元活性的测定 通过MTT实验对神经元细胞的活性进行测定。取部分上述分离得到的细胞,利用RPMI-1640完全培养基调细胞浓度至1×107个/ml,加到96孔板中,每孔100 μl,以等体积的完全培养基为调零孔,每组设6个复孔,37 ℃,5% CO2培养箱中培养48 h,向各孔加20 μl MTT溶液(5 mg/ml),培养4 h,弃上清,向各孔中加入150 μl DMSO,水平振动仪中快速震荡10 min,在酶标仪上测定570 nm处吸光度值。
1.2.7 神经元细胞凋亡测定 吸取5 μl Annexin V-FITC凋亡试剂于细胞中,混匀,室温下避光孵育15 min,加入1×binding buffer,重悬细胞,1200 rpm,离心5 min,弃上清,加200 μl×binding buffer,重悬细胞,进行流式细胞仪检测。流式软件Flowjo 7.5 进行数据分析。
1.2.8 细胞中凋亡相关蛋白表达量的测定 采用Western blot 方法对细胞凋亡相关蛋白即caspase-3蛋白、Bcl-2蛋白及Apaf-1蛋白的表达情况进行测定,通过Image J软件对条带的灰度值进行测定,利用灰度值分析各蛋白的表达量。
1.2.9 细胞凋亡RNA表达量的测定 取大鼠血清,利用RT-PCR方法检测血液中miRNA-21、miRNA-29因子的表达水平。利用总miRNA快速提取试剂盒提取总RNA,并使用miRNA特有的逆转录引物,将其与Super M-MLV逆转录酶进行反向转录,反转录体系:(1)5×PrimeScript Buffer 4 μl;(2)1×PrimeScript RT Enzyme Mix 1 μl;(3)Oligo dT Primer (50 μmol)1 μl (25 pmol);(4)Random 6 mers (100 μmol) 1 μl (50 pmol);(5)Total RNA 1 μl;RNase Free dH2O 12 μl 。RT-PCR在实时定量系统中上进行,扩增条件:(1)预变性:95 ℃时10 min;(2)变性:94 ℃时30 s、退火/延伸:60 ℃时1 min,两个步骤40个循环;(3)融解曲线分析:95 ℃时15 s、60 ℃时1 min、94 ℃时15 s和60 ℃时15 s。引物设计(见表1);反应体系(见表2)。

2 结 果
2.1 神经元形态完整性分析 神经元形态完整,胞体和突起清晰,胞体呈椎体或多角形,突起明显。用大鼠特异性烯醇化酶(NSE)抗体鉴定培养细胞,表明神经元(NSE阳性细胞)纯度达95%(见图1)。
2.2 神经元钙含量的测定 以3×104mol/L谷氨酸培养海马神经元细胞1 min后,细胞内钙浓度迅速升高。大约95%的细胞有反应。用无镁BSS洗涤2.5 min后,雷洛昔芬组,再次给予谷氨酸,治疗前后谷氨酸诱导细胞内钙浓度升高。结果表明,不同浓度的雷洛昔芬可显著降低谷氨酸诱导的细胞内钙的增加。空白组、假手术组、雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组各组细胞的荧光强度分别为(230.2±10.3)、(233.5±11.3)、(342.3±12.4)、(302.5±14.5)、(312.3±13.5),5组比较差异有统计学意义(F=160.033,P<0.001)。与空白对照组的荧光强度相比,假手术组无显著变化(P>0.05),雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组荧光强度均显著增加(P<0.001),但与雷洛昔芬低剂量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组荧光强度均显著降低(P<0.001)。
2.3 神经元细胞活性及凋亡率测定 通过MTT实验对神经元细胞增殖能力进行测定,利用流式细胞仪对其凋亡率进行测定,实验结果表明,空白组、假手术组、雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组各组细胞的增殖率分别为(0.68±0.02)、(0.66±0.02)、(0.21±0.01)、(0.59±0.03)、(0.54±0.04),5组比较差异有统计学意义(F=534.265,P<0.001)。假手术组细胞增殖率与空白组相比无显著性(P>0.05),雷洛昔芬组细胞增殖率均显著低于空白组与假手术组(P<0.001),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率均显著增加(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率无显著性差异(P>0.05)。细胞凋亡率结果表明,空白组、假手术组、雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组各组细胞的凋亡率分别为(1.1±0.03)、(1.2±0.02)、(10.38±0.23)、(8.92±0.12)、(9.01±0.21),5组比较差异有统计学意义(F=9288.651,P<0.001)。假手术组细胞增殖率与空白组相比无显著性(P>0.05),雷洛昔芬组细胞增殖率均显著低于空白组与假手术组(P<0.001),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率均显著增加(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率无显著性差异(P>0.05)。
2.4 细胞凋亡相关蛋白分析 用2-△△Ct法计算细胞中凋亡相关蛋白caspase-3、Apaf-1的相对表达量,5组比较差异有统计学意义(F1=38.328,F2=1151.204,P<0.001),结果(见图2、表3)。 细胞凋亡率凋亡相关蛋白表明,假手术组细胞凋亡相关蛋白caspase-3、Apaf-1与空白组相比蛋白表达量有显著性(P>0.05),雷洛昔芬组细胞caspase-3、Apaf-1蛋白均显著低于空白组与假手术组(P<0.001),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞中caspase-3、Apaf-1蛋白均显著增加(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组caspase-3、Apaf-1蛋白表达量无显著性差异(P>0.05)(见图2)。
2.5 miRNA表达量的测定 通过RT-PCR实验对神经元细胞凋亡相关miRNA表达量进行测定,实验结果表明,空白组、假手术组、雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组各组细胞的miRNA-21表达量分别为(0.14±0.01)、(0.16±0.01)、(0.32±0.02)、(0.21±0.01)、(0.22±0.01),5组比较差异有统计学意义(F=306.250,P<0.001)。假手术组细胞miRNA-21表达量与空白组相比无显著性(P>0.05),雷洛昔芬组细胞miRNA-21显著高于空白组与假手术组(P<0.05),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率均显著降低(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞miRNA-21表达量无显著性差异(P>0.05)。各组miRNA-29表达量分别为(0.17±0.02)、(0.19±0.01)、(0.43±0.03)、(0.31±0.02)、(0.32±0.02),5组比较差异有统计学意义(F=256.364,P<0.001)。假手术组细胞miRNA-29表达量与空白组相比无显著性(P>0.05),雷洛昔芬组细胞miRNA-29显著高于空白组与假手术组(P<0.001),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞miRNA-29表达量均显著降低(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞miRNA-29表达量无显著性差异(P>0.05)。
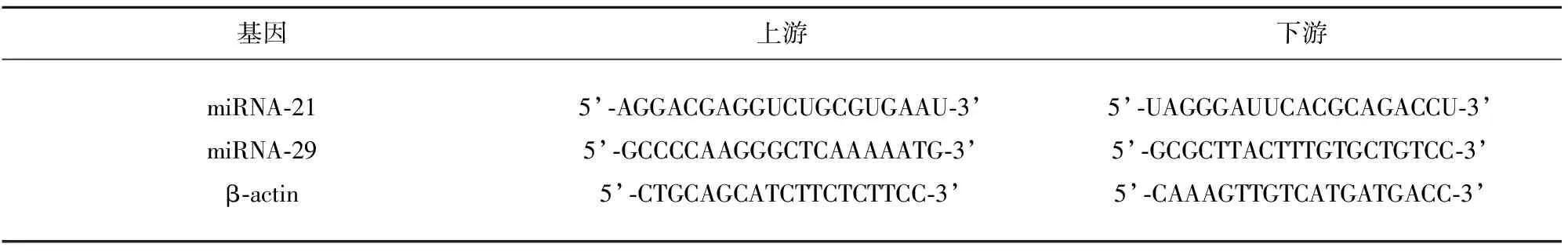
表1 引物设计

表2 反应体系

表3 神经元细胞增殖能力、凋亡蛋白及相关miRNA表达量测定

A:空白组;B:假手术组;C:雷洛昔芬低剂量组;D:雷洛昔芬中剂量组;E:雷洛昔芬高剂量组,雷洛昔芬中、高剂量组荧光强度降低(P>0.05)
图1 神经元形态和神经元钙含量的测定

假手术组细胞凋亡相关蛋白caspase-3、Apaf-1与空白组相比蛋白表达量无统计学差异(P>0.05),雷洛昔芬组细胞caspase-3、Apaf-1蛋白低于空白组与假手术组(P<0.001),与雷洛昔芬低价量组相比,雷洛昔芬中、高剂量组细胞中caspase-3、Apaf-1蛋白增加(P<0.001)
图2 细胞凋亡蛋白表达量的Western blot测定结果
3 讨 论
雷洛昔芬在神经系统中的作用也引起了越来越多的关注[5]。现有的一些体内实验结果表明,雷洛昔芬对氧化应激和β-淀粉样蛋白所致的神经损伤具有保护作用[7]。也有证据表明雷洛昔芬对中枢神经系统多巴胺受体具有雌激素激动剂活性,提示雷洛昔芬可能作为雌激素激动剂在中枢神经系统发挥神经保护作用[8]。此外,雷洛昔芬神经保护作用的细胞和分子机制尚不清楚。
有研究表明[9],雷洛昔芬能抑制过氧化应激所致的神经元死亡,这种作用不是由经典雌激素受体介导的。报道指出[10],雷洛昔芬对雌激素受体α诱导的神经元凋亡有抑制作用,再生的作用还取决于经典雌激素受体介导的。有报道指出[11],谷氨酸可直接激活细胞膜上配体激活的钙通道,引起细胞膜膨胀Ca2+内流,同时引起细胞膜去极化,激活电压依赖性钙通道,进一步引起钙内流和钙超载[12]。本研究以3×104mol/L谷氨酸培养海马神经元细胞,结果表明,不同浓度的雷洛昔芬可显著降低谷氨酸诱导的细胞内钙的增加。与空白对照组的荧光强度相比,假手术组无显著变化(P>0.05),雷洛昔芬低剂量组、雷洛昔芬中剂量组、雷洛昔芬高剂量组荧光强度均显著增加(P<0.001),但与雷洛昔芬低剂量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组荧光强度均显著降低(P<0.001)。
在体内动物实验的结果表明[13],雷洛昔芬在脑缺氧缺血损伤的实验模型中对神经元具有明显的保护作用,同时体外细胞研究也证实[14,15],雷洛昔芬在氧化应激、兴奋毒性及β-淀粉样蛋白引起的神经元损伤中增加了神经元的存活且对其具有保护作用。本研究表明,通过MTT实验对神经元细胞增殖能力进行测定,利用流式细胞仪对其凋亡率进行测定,实验结果表明,雷洛昔芬组细胞增殖率与凋亡率均显著低于空白组与假手术组(P<0.001),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率均显著增加(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞增殖率无显著性差异(P>0.05)。
细胞中凋亡相关蛋白即caspase-3、Apaf-1的表达结果表明,假手术组细胞凋亡相关蛋白caspase-3、Apaf-1与空白组相比蛋白表达量无显著性(P>0.05),雷洛昔芬组细胞caspase-3、Apaf-1蛋白均显著低于空白组与假手术组(P<0.001),但与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞中caspase-3、Apaf-1蛋白均显著增加(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组caspase-3、Apaf-1蛋白表达量无显著性差异(P>0.05)。与雷洛昔芬低价量组相比,雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞miRNA-21、miRNA-29表达量均显著降低(P<0.001),且雷洛昔芬中剂量组、雷洛昔芬高剂量组细胞miRNA-21、miRNA-29表达量无显著性差异(P>0.05)。
综上所述:雷洛昔芬通过抑制神经细胞凋亡蛋白caspase-3、Apaf-1及miRNA-21、miRNA-29的表达保护脑缺血大鼠脑细胞。
