姜黄素调节miR-133a表达对肝癌细胞迁移和侵袭的影响
2019-05-09袁洪波孟佩盈戚柳杰
袁洪波,孟佩盈,戚柳杰
袁洪波,孟佩盈,戚柳杰,诸暨市中心医院内二科 浙江省诸暨市311800
核心提要:姜黄素可抑制肝癌SMCC-7721细胞活力、侵袭和迁移,同时上调miR-133a表达;采用脂质体法转染miR-133a模拟物上调miR-133a表达后,SMCC-7721细胞的侵袭和迁移能力明显减弱,并能够与姜黄素协调起到抑制SMCC-7721细胞侵袭和迁移的作用.
0 引言
有“癌中之王”之称的肝癌是临床上最为常见的恶性肿瘤,术后的复发和转移是影响肝癌治疗的重要因素,如何抑制肝癌的复发和转移提高患者的生存率是临床上的一大难题.除传统的手术治疗外,放疗和化疗的治疗并不理想,往往会伴有毒副作用的产生,慢慢地安全有效的中药及其成分逐渐进入人们的视野.姜黄素是一种具有抗氧化、抗炎、降血脂和抗肿瘤等活性的多酚类化合物,其抗肿瘤的作用备受学者们的关注.越来越多的研究[1-3]发现,姜黄素对胃癌、食管癌和乳腺癌等多种肿瘤的发生发展均具有较好的抑制作用.近年来有研究[4]报道,姜黄素可通过调控miR-133a表达干预胃癌细胞增殖和转移.研究[5,6]已证实,miR-133a在肝癌中低表达,姜黄素可抑制肝癌细胞生长和转移,但其有无调控miR-133a表达发挥抗肿瘤的作用并不清楚.因此,本研究通过体外细胞实验旨在探讨miR-133a在姜黄素抑制肝癌细胞迁移和侵袭中的作用.
1 材料和方法
1.1 材料 肝癌细胞系SMMC-7721和正常肝细胞系LO2购于中科院上海细胞库.RPMI1640培养基购于美国Gibco公司,人工基底膜Matrigel、MTT试剂和姜黄素均购于美国Sigma公司,Trizol试剂购于美国LIFE公司,miR-133a模拟物及阴性对照购自上海吉玛公司.逆转录试剂盒购于大连宝生物公司,Transwell小室(孔径8 μm)购于美国Coster公司.
1.2 方法
并购动因:蒙牛一直以来都处于与伊利的竞争不相上下的状态,但在2012年,蒙牛的销售收入比伊利低了60多个亿,这是自企业成立以来第一次营业收入下跌,对蒙牛的打击无可厚非。蒙牛发现了婴幼儿奶粉这一系列产品方面是自己的短板,而伊利在当年已经开始取得成绩。
1.2.1 细胞培养:采用含100 mL/L胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的RPMI1640培养基,在5%CO2的37 ℃恒温培养箱内常规培养SMMC-7721和LO2细胞.定期观察,每3 d换液一次.当细胞汇合度达85%以上时,加入0.25%胰蛋白酶消化传代.收集对数生长期的细胞进行实验.
1.2.2 RT-PCR检测:在收集到的SMMC-7721和LO2细胞中加入Trizol试剂提取总RNA,并采用紫外分光光度计测定总RNA的浓度.以逆转录试剂盒合成cDNA后,以此为模板配置20 μL反应体系,上PCR仪进行扩增.反应条件:95 ℃预变性5 min,(95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s)×35个循环.其中,miR-133a(上游:5'-GCCAAGCTGGTAAA-ATGGAA-3'和下游:5'-TATGGTTTTGACGACTGTGTGAT-3')和内参U6(上游:5'-CTCGCTTCGGCAGCACA-3'和下游:5'-AACGCTTCACGAATTTGCG-3')引物序列由上海生工生物合成.以2-△△CT法计算SMMC-7721和LO2细胞中miR-133a的相对表达量.
1.2.3 MTT检测:取96孔细胞板,将对数生长期的SMMC-7721细胞以每孔200 μL(细胞浓度为5×105个/mL)进行接种.置于细胞培养箱中培养过夜,次日将细胞随机分为三组:对照组(0 μmol/L姜黄素)、10 μmol/L姜黄素处理组和20 μmol/L姜黄素处理组.另设无细胞的空白组.按照分组,分别给药处理.48 h后,每孔中加入20 μL MTT溶液,于培养箱内孵育4 h后,加入二甲基亚砜震荡反应至紫色结晶完全溶解.采用酶标仪选用490 nm检测波长检测各孔的吸光度值,根据公式:细胞存活率=100%×(药物处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)计算SMMC-7721细胞的存活率.并采用RT-PCR检测各组细胞中miR-133a的相对表达水平.
1.2.4 Transwell小室检测:收集上述对照组和20 μmol/L姜黄素处理组的细胞,以胰蛋白酶消化,加无血清培养基重悬细胞,调整细胞浓度为5×105个/ml.细胞迁移实验:取Transwell小室,于上室中加入200 μL制备的对照组和20 μmol/L姜黄素处理组细胞悬液,下室中加入600 μL含血清的RPMI1640培养基,置于培养箱内培养24 h后,取出小室,以磷酸缓冲液洗涤后,小心擦去上室的细胞.以甲醛于4 ℃下固定15 min,磷酸缓冲液洗涤后,再以结晶紫染色30 min.以磷酸缓冲液洗涤后,晾干.于倒置显微镜下,选取5个视野观察细胞的个数即侵袭细胞数,并拍照,结果以均值表示.细胞侵袭实验:首先以Matrigel基质胶包被Transwell小室,风干成胶后,以无血清的培养基封闭30 min,其他操作均与细胞迁移实验相同.实验重复3次.
1.2.5 细胞转染:取6孔细胞板,以每孔2×105个细胞进行接种.置于孵箱中常规培养,待细胞密度达85%以上时,进行瞬时转染.实验随机分为阴性对照(miR-NC)组和miR-133a组,根据LipofectamineTM2000转染试剂说明书步骤分别将miR-NC和miR-133a模拟物转染至SMMC-7721细胞中,孵育6 h后,换液继续培养.培养48 h后,检测各组细胞的迁移和侵袭情况.另取一个6孔细胞板,以每孔2×105个细胞进行接种,置于孵箱中常规培养,待细胞密度达85%以上时,进行瞬时转染.将细胞随机分为对照组(未做任何处理)、姜黄素组(以20 μmol/L姜黄素处理48 h)、姜黄素+阴性对照组(转染miR-NC后,以20 μmol/L姜黄素处理48 h)和姜黄素+miR-133a组(转染miR-133a模拟物后,以20 μM姜黄素处理48 h).按照如上分组分别进行转染和姜黄素处理后,检测各组细胞的迁移和侵袭情况.
统计学处理数据以mean±SD形式表示,采用SPSS 22.0进行统计学分析,三组组间数据采用单因素方差分析,方差齐性采用SNK-q检验,两组组间采用独立样本t检验.P<0.05为差异有统计学意义.
2 结果
2.1 姜黄素抑制肝癌SMMC-7721细胞的活力 姜黄素(0、10、20 μmol/L) 处理48 h,MTT检测细胞活力,结果见图1.与对照组(0 μmol/L)相比,10、20 μmol/L姜黄素处理组的细胞存活率均明显降低(P<0.05),且在20 μmol/L姜黄素作用下SMMC-7721细胞活力的抑制效果最强.
2.2 姜黄素抑制SMCC-7721细胞的迁移和侵袭 采用Transwell小室分别检测20 μmol/L姜黄素处理后,SMMC-7721细胞迁移和侵袭能力的变化,结果见图2.与对照组相比,姜黄素处理后,SMMC-7721细胞的迁移个数和侵袭个数均明显减少(P<0.05).
2.3 姜黄素促进肝癌SMCC-7721细胞中miR-133a的表达 RT-PCR检测发现,肝癌SMCC-7721细胞中miR-133a的表达水平较正常肝LO2细胞明显降低(P<0.05),见图3A.然而,以10、20 μmol/L姜黄素处理48 h后,SMCC-7721细胞中miR-133a的表达水平呈浓度依赖性升高(P<0.05),见图3B.
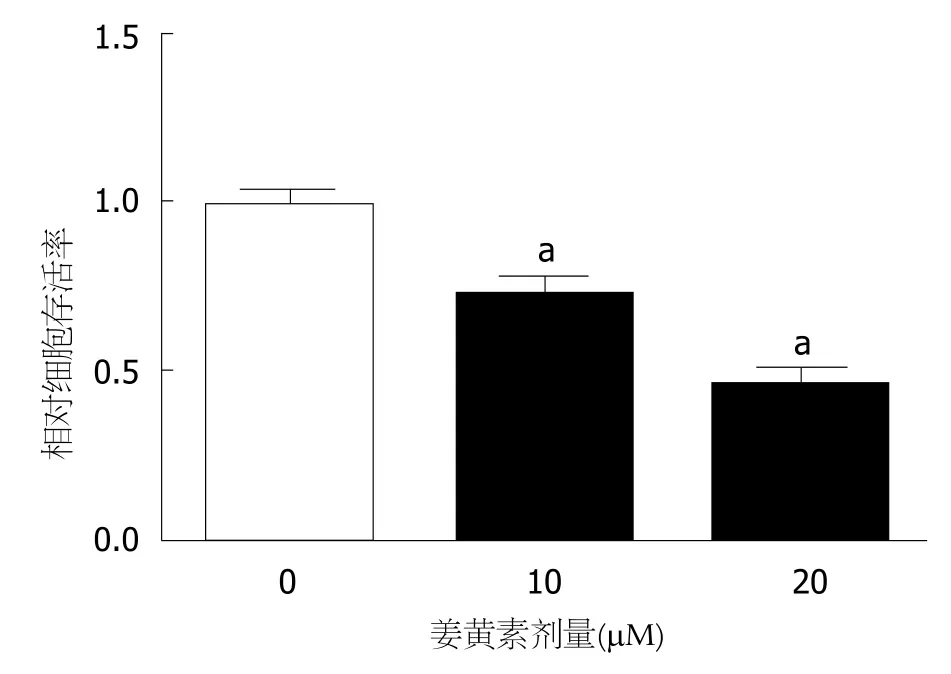
图1 不同浓度的姜黄素对肝癌SMMC-7721细胞活力的影响.aP<0.05,与0 μmol/L组相比.

图2 姜黄素对SMCC-7721细胞迁移和侵袭的影响.A:细胞迁移结果;B:细胞侵袭结果.aP<0.05,与对照组相比.放大倍数:200 ×.
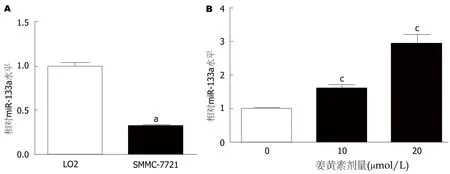
图3 姜黄素对SMCC-7721细胞中miR-133a表达的影响.A:正常肝LO2细胞和肝癌SMCC-7721细胞中miR-133a表达,aP<0.05,与LO2细胞相比;B:姜黄素处理后,SMCC-7721细胞中miR-133a表达,cP<0.05,与0 μmol/L组相比.

图4 miR-133a过表达对SMCC-7721细胞迁移和侵袭能力的影响.A:细胞迁移结果;B:细胞侵袭结果.aP<0.05,与阴性对照组相比.放大倍数:200 ×.

图5 miR-133a过表达对姜黄素作用下SMCC-7721细胞迁移和侵袭的影响.A:细胞迁移结果;B:细胞侵袭结果.aP<0.05,与姜黄素组相比;cP<0.05,与姜黄素+阴性对照组相比.
2.4 miR-133a过表达抑制SMCC-7721的迁移和侵袭 采用LipofectamineTM 2000转染miR-NC和miR-133a模拟物48 h后,以Transwell小室检测SMCC-7721细胞的迁移和侵袭能力,结果见图4.与阴性对照组相比,miR-133a组细胞的迁移个数和侵袭个数均明显减弱(P<0.05).
2.5 miR-133a过表达增强姜黄素对SMCC-7721细胞迁移侵袭的抑制作用 采用Transwell小室进一步检测miR-133a过表达对姜黄素作用下SMCC-7721细胞迁移和侵袭的影响,结果见图5.20 μmol/L姜黄素处理后,SMCC-7721细胞的迁移和侵袭能力均明显减弱,转染miR-NC未能影响姜黄素对SMCC-7721细胞的作用(P>0.05),但转染miR-133a模拟物后,姜黄素对SMCC-7721细胞迁移和侵袭的抑制作用明显增强(P<0.05).
3 讨论
肝癌是我国常见的消化系统恶性肿瘤,严重威胁着人们的身体健康和生活质量.目前,肝癌的治疗仍以手术治疗、放疗和化疗为主.随着医学领域的不断发展,肝癌患者的总生存率虽有所提高,但肝癌的治疗并未得到根本改善,肝癌患者术后的复发率仍较高[7,8].如何安全有效的防治肿瘤细胞的转移对肝癌患者的治疗尤为重要.因中药具有毒性小、效率高和价格低等优势,中药抗肿瘤逐渐成为研究的热点.姜黄素是从中药姜黄根茎中提取的一种活性成分,已被证实在前列腺癌、胰腺癌和结肠癌中具有可喜的抗肿瘤细胞转移的作用[9-11].目前,关于姜黄素抗肝癌细胞转移的作用已有报道.例如:Zhang等[12]研究指出,姜黄素能够增强二甲双胍对肝癌细胞增殖、侵袭、转移和血管生成的抑制作用;邱伟等[13]报道证实,姜黄素可通过下调MMP-2/9和COX-2的表达抑制肝癌细胞的增殖及侵袭.但是,姜黄素应用于临床治疗肝癌的理论依据还不够充分.因此,探讨姜黄素抗肝癌细胞转移的分子机制对姜黄素临床治疗肝癌具有重要意义.
大量研究[14-18]显示,miRNAs与肝癌的发生发展关系密切,在肿瘤细胞的增殖、转移和凋亡等生物学过程中发挥着重要的调控作用.如:miR-23b-3p在肝癌细胞中低表达,与肝癌进展和复发时间关系密切[17];miR-1260b在肝癌组织中高表达,miR-1260b的过度表达增加了肝癌细胞的迁移和侵袭[18].miR-133a作为miRNAs家族成员,在乳腺癌、胃癌和非小细胞肺癌等肿瘤中异常低表达,与临床分期、淋巴结转移及生存时间密切相关,上调其表达可抑制肿瘤细胞的增殖、迁移和侵袭[19-21].有研究[4]报道,姜黄素可通过调控miR-133a表达干预胃癌细胞增殖和转移.已有研究[22,23]证实,miR-133a在肝癌中低表达,姜黄素可抑制肝癌细胞生长和转移,但其有无通过调控miR-133a表达来发挥作用并不清楚.本研究以姜黄素处理肝癌SMMC-7721细胞,结果发现,细胞活力、迁移和侵袭能力均明显受到抑制,这与之前研究[23]的研究结果相吻合.进一步观察姜黄素对肝癌细胞中miR-133a表达的影响发现,miR-133a表达呈浓度依赖性升高.提示,姜黄素可能通过上调miR-133a参与抗肝癌细胞转移的调控过程.为了验证这一猜想,本研究通过转染miR-133a模拟物上调SMMC-7721细胞中miR-133a表达后,检测发现SMMC-7721细胞的迁移和侵袭能力均显著减弱.该结果与miR-133a在胃癌和非小细胞肺癌中的抑癌作用相吻合[20,21].这提示,miR-133a在肝癌细胞的迁移和侵袭过程中发挥着重要的抑制作用.同时发现,上调miR-133a表达还能增强姜黄素对SMCC-7721细胞迁移和侵袭的抑制作用.结果表明,姜黄素可通过上调miR-133a表达抑制肝癌细胞的迁移和侵袭.
总之,miR-133a表达上调是姜黄素抗肝癌细胞转移的一个重要机制,为姜黄素介导miRNAs发挥抗肿瘤作用提供了实验依据.后期我们会进一步探讨姜黄素是如何通过上调miR-133a表达调控下游相关基因参与其抗肝癌转移的调控,以期为姜黄素临床治疗肝癌提供新的参考依据.
文章亮点
实验背景
姜黄素对包括肝癌在内的多种肿瘤的发生发展表现出较好的抑制作用,但其抗肝癌的作用机制尚不完全清晰.有研究发现,姜黄素可通过调控miR-133a表达抑制胃癌细胞增殖和转移;miR-133a在肝癌中低表达的结果已有数据证实,但姜黄素是否介导miR-133a表达发挥抗肝癌的作用并不清楚.
实验动机
本研究旨在探讨miR-133a在姜黄素抑制肝癌细胞迁移和侵袭中的作用,以期为姜黄素抗肝癌细胞转移提供新的实验依据.
实验目标
探讨姜黄素调节miR-133a表达对肝癌细胞迁移和侵袭的影响,以期姜黄素抗肝癌细胞的机制提供新线索.
实验方法
以10、20 μmol/L姜黄素处理肝癌SMMC-7721细胞48 h后,采用MTT法检测细胞活力,Transwell小室检测细胞的迁移和侵袭;RT-PCR检测细胞中miR-133a表达.采用RT-PCR检测正常肝LO2细胞和肝癌SMMC-7721细胞中miR-133a表达;采用脂质体法将miR-133a模拟物转染至SMMC-7721细胞后,Transwell小室检测姜黄素作用前后细胞迁移和侵袭.
实验结果
姜黄素可抑制SMMC-7721细胞活力、迁移和侵袭,上调miR-133a表达.miR-133a在SMCC-7721细胞中的表达水平较LO2细胞明显降低.上调miR-133a表达后,SMCC-7721细胞的迁移和侵袭能力均明显减弱,同时可增强姜黄素对SMCC-7721细胞迁移和侵袭的抑制作用.
实验结论
姜黄素可上调miR-133a表达抑制肝癌细胞的迁移和侵袭.这一结果进一步揭示了姜黄素抗肝癌细胞转移的分子机制,也为姜黄素抗肝癌的发生发展提供了新的实验依据.
展望前景
本研究仅仅发现miR-133a表达上调是姜黄素抗肝癌细胞转移的一个重要机制,但miR-133a是如何调控下游相关基因参与姜黄素抗肝癌转移的还有待深入探讨,后期我们将继续致力于这方面的研究,以期为姜黄素临床治疗肝癌提供新依据.
