52份豌豆种质萌发期耐铝毒性的综合评价与筛选
2019-05-09赵愉风郜欢欢王瑞莉王刘艳周清元
崔 翠 程 闯 赵愉风 郜欢欢 王瑞莉 王刘艳 周清元
52份豌豆种质萌发期耐铝毒性的综合评价与筛选
崔 翠 程 闯 赵愉风 郜欢欢 王瑞莉 王刘艳 周清元*
西南大学农学与生物科技学院, 重庆 400715
随着土壤酸化的日益加重, 铝毒成为影响作物种子萌发质量以及产量的重要胁迫因子之一。本研究采用单项耐铝毒系数(AC值)、综合耐铝毒系数(CAC值)、平均隶属函数值(ASF值)、耐性综合评价值(A值)等指标及相关分析、主成分分析、聚类分析和逐步回归分析等方法, 综合评价豌豆种质萌发期铝毒耐性, 建立综合筛选评价体系, 并筛选萌发期耐铝毒豌豆种质。利用筛选出的适宜浓度40 mg L–1Al3+处理52份豌豆品种(系)种子, 结果显示, 萌发期8个相关性状在处理组及对照组品种间均存在显著差异, 遗传多样性指数分别介于1.43~2.03和1.51~2.06之间。基于AC值聚类分析, 52份豌豆种质可被分为3个耐性级别, 其中, 第I级含2份, 为耐铝毒品种(系); 第II级含19份, 为敏感品种(系); 第III级含31份, 为铝毒极敏感性品种(系)。利用豌豆种子发芽率、发芽势、发芽指数、芽长、根长、芽干重、根干重7项指标, 结合最优回归方程可初步鉴定豌豆萌发期耐铝毒特性。通过综合评价和聚类分析, 筛选出萌发期铝毒耐性极强的种质C175和C145, 可作为豌豆铝毒耐性育种和耐性机制研究的重要资源。
豌豆; 萌发期; 耐铝毒特性; 综合评价; 种质资源筛选
随着酸雨的影响及氮肥的大量施用, 酸性土壤面积呈逐渐扩大的趋势[1]。铝毒是酸性土壤中限制作物生长及作物生产的主要因素[2]。施用石灰进行土壤改良或选择抗(耐)性作物品种是减少铝毒危害的有效措施[3]。由于土壤改良费时费力, 且破坏生态系统平衡, 开发抗(耐)铝毒作物基因型及利用作物耐铝毒品种进行生产是缓解酸性土壤铝毒最经济有效的途径。近年来, 耐铝毒种质资源筛选及其铝毒耐性机制在作物生产中已经引起广泛重视。舒畅[3]从45个基因型不同的水稻(L.)中筛选出苗期耐铝性相对较强材料1份。刘武[4]将141个玉米(L.)自交系按照抗铝能力强弱分为3类, 其中铝耐受型有25个自交系。齐波等[5]通过509份种质资源苗期耐铝毒性鉴定, 认为大豆种质资源存在更大的耐铝毒和敏感性变异, 并遴选出15份强耐铝毒资源。熊洁等[6]从23个油菜(L.)品种中筛选出3个在苗期耐铝类型。由此可见, 作物耐铝毒评价与资源筛选的研究较多, 但主要是针对幼苗期耐铝毒种质[3-6]。萌发期是作物生长发育最重要的起始阶段, 种子萌发过程中胚根及胚芽均处于酸性土壤铝毒条件下, 铝毒对植物种子发芽势、发芽率、发芽指数、根长等存在明显影响[7], 然而关于利用综合性状进行萌发期耐铝毒种质资源筛选研究则少见报道。
豌豆作为世界第四大食用豆类作物, 属于铝敏感作物[8]。从现有豌豆种质资源中筛选耐铝毒种质资源, 并挖掘抗(耐)铝毒基因用于豌豆育种具有重要的理论和应用价值。目前, 关于萌发期耐铝豌豆种质资源筛选未见报道。本研究通过溶液滤纸法模拟酸性土壤铝毒对豌豆种子发芽势、发芽率、发芽指数、鲜重、干重、根长、芽长和根冠比等相关性状的影响, 采用单项耐铝毒性系数、隶属函数、主成分分析、聚类分析等综合评价方法, 筛选萌发期铝毒耐性较强的豌豆种质, 旨在为深入研究豌豆对酸性土壤的耐性和选育高产耐铝毒豌豆品种提供参考依据和理论支持。
1 材料与方法
1.1 供试材料
52份参试豌豆种质是从重庆(合川、南川、白市驿、北碚)、四川(成都、仁寿)、广东(广州)等地收集到的品种(系), 经西南大学农学与生物科学院多年种植并选择的后代选系(表1)。
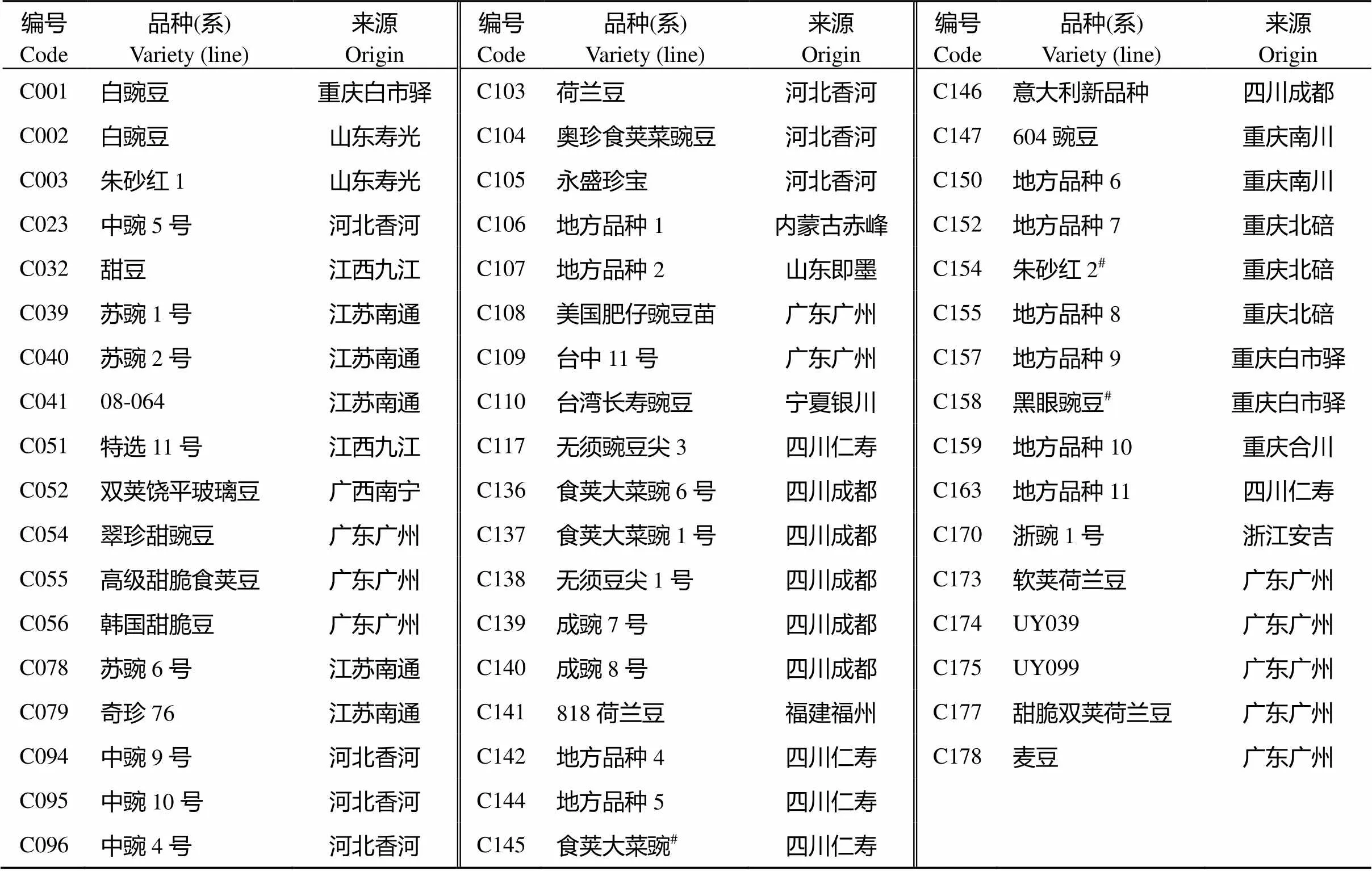
表1 参试品种(系)及其来源
#表示浓度筛选试验选用豌豆品种。#Pea varieties selected for experiment of concentration screening.
1.2 适宜Al3+浓度筛选
以A1Cl3•6H2O为铝源, 分别配制浓度为0 mg L–1(CK)、20 mg L–1、40 mg L–1、80 mg L–1及160 mg L–1的铝离子溶液(pH 5.0); 从供试种质资源材料中选择耐性具有一定差异的C154 (朱砂红-2)、C145 (食荚大菜豌)和C158 (黑眼豌豆) 3份品种为浓度筛选试验材料。在每个品种中选择饱满、大小一致的豌豆种子进行铝毒胁迫试验。先对供试种子采用95%乙醇进行表面消毒15~30 s, 清水冲洗后用1.5%次氯酸钠浸泡5~10 min, 再用无菌水清洗5~6次, 每次清洗2~3 min, 并去除漂浮、软化等劣质种子。选取健康饱满豌豆种子置培养皿中, 加入适量清水(以充分淹没豌豆种子为准), 于(25±1)℃恒温培养箱中进行吸胀作用。24 h后将种子摆放在铺有双层滤纸的培养皿中(=120 mm), 每皿25粒, 处理组分别加入20 mL不同浓度Al3+溶液, 处理及对照均设置4次重复。将培养皿放在RXZ-500C光照培养箱中, 温度为(25±1)℃, 日/夜光照条件为16 h/8 h; 每隔24 h更换培养皿中滤纸并补充20 mL相应浓度的Al3+溶液。7 d后调查根长和芽长, 根据生长情况筛选适宜铝毒胁迫处理浓度。
1.3 耐铝性筛选
按照浓度筛选时方法和培养条件, 以适宜Al3+浓度对52份材料在种子萌发过程中进行铝毒胁迫试验(蒸馏水处理为对照)。参照农作物发芽技术规定(GB/T 35434-1995)在试验第5天统计发芽势(germination energy, GE), 第8天统计发芽率(germination rate, GR), 发芽期内每天统计种子萌发数, 计算发芽指数(germination index, GI)[9]。试验第8天选取每皿10株测量其根长(root length, RL)、芽长(bud length, BL)、根干重(dry weight of root, RDW)、芽干重(dry weight of shoot, SDW)和根冠比(root/shoot ratio, RSR)。
发芽指数(GI) = ∑(Gt/Dt); 根冠比(RSR) = 根干重/芽干重。其中Gt为试验天数内种子萌发数, Dt为相对发芽天数。
1.4 数据处理和统计分析
利用Microsoft Excel 2013、IBM SPSS 19.0[10]和DPS 2006[11]统计软件整理数据, 计算平均数、标准差、变异系数、遗传多样性指数、相关系数、主成分分析、聚类分析等。
根据平均值()和标准差(S)进行分级处理和频次分布统计, 即每个性状进行10级分类, 1级<-2S, 10级≥+2S, 中间每隔0.5S为1级, 每1级的相对频率(P)用于计算遗传多样性指数(¢)[12],' =-∑P× lnP, 其中,P为某性状第级别内材料份数占总份数的百分比。
参考汪灿等[13]方法, 以各品种8个指标测定值作为基础数据, 对各性状测定值进行平均数差异显著性分析、遗传多样性指数分析; 然后, 按照公式(1)和(2)计算各单项指标性状的铝毒耐性系数(aluminum toxicity tolerance coefficient, AC)和综合耐铝系数(comprehensive aluminum tolerance coefficient, CAC)。以AC值为基础数据统计各单项指标性状AC值间的相关性、并进行主成分分析; 按照公式(3)和公式(4)分别计算各品种各单项指标的隶属函数()和平均隶属函数值(average subordinate function value, ASF)。按照公式(5)分别计算每个品种的铝毒耐性综合评价值(aluminum toxicity tolerance value, A值)。
式(1)中, AC表示第个品种第个指标的单项铝毒耐性系数,X、CK分别表示第个指标下第个品种铝毒胁迫和对照处理的指标测定值。代表性状指标数,代表品种数; 式(2)和(3)中, CAC指第个品种的综合耐铝系数,(ACij)指基于单项指标铝毒系数的第个品种的第个指标的隶属函数值, ACmin、ACmax分别表示所有参试材料某一指标耐性系数的最小值和最大值; 式(4)中, ASF为第个品种的平均隶属函数值,R为第个品种的第个指标的隶属函数值。
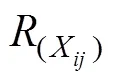
基于豌豆萌发期8个性状AC值, 采用欧式距离和离差平方法进行系统聚类分析, 划分52份材料耐铝毒等级; 同时, 以各指标铝毒耐性系数AC值为自变量, 以A值为因变量进行逐步回归分析, 获得回归方程。
2 结果与分析
2.1 适宜铝离子胁迫浓度的筛选
不同材料对不同浓度Al3+胁迫反应不同(表2)。其中, 20 mg L–1Al3+浓度处理对3个品种根和芽生长影响较小, 尤其是地上部分芽长与对照差异均未达到显著水平, 地下部分除C154较对照显著降低外, C145和C158均较对照显著增加, 说明低浓度铝胁迫促进部分材料根系生长; Al3+胁迫浓度为80 mg L–1时, 3个品种根系生长均受到显著抑制, 当浓度增至160 mg L–1时, 参试品种根和芽生长均较对照受到显著抑制, 甚至萎缩死亡, 表明80 mg L–1及160 mg L–1的胁迫浓度都不利于品种间耐性差异筛选。当胁迫浓度在40 mg L–1时, C154和C145芽长较各自对照差异不显著, 而C158芽长则较对照显著降低; C145和C158根长较各自对照差异不显著, 而C154根长则较对照差异达到显著水平。可见, 在40 mg L–1Al3+胁迫浓度下, 根系和芽生长在品种间受到影响显著性不同, 能够较好地区分其耐铝性差异。因此, 选择40 mg L–1Al3+为豌豆萌发期耐铝毒种质资源筛选的适宜浓度。
2.2 表型特征及遗传多样性分析
从表3可以看出, 8个性状在处理和对照组中各品种间差异均达到显著水平。在对照组中, 52份豌豆种质各性状变异系数介于19.04%~41.24%, 其中芽干重>根冠比>根干重>根长>芽长>发芽指数>发芽势>发芽率。铝毒胁迫处理后, 各性状变异系数介于15.23%~43.03%, 具体表现为根冠比>芽干重>根干重>根长>芽长>发芽指数>发芽势>发芽率。两种条件下各指标性状遗传多样性指数(¢)均大于1.00, 其中, 对照组¢介于1.51~2.06间, 均值为1.91, 根干重、发芽指数、根长、芽干重和芽长5个性状的¢均大于2.00, 8个性状的¢为根干重>根长>发芽指数>芽干重>芽长>根冠比>发芽势>发芽率; 处理组¢介于1.43~2.03之间, 均值为1.84, 低于对照组, 根长、芽长和芽干重¢大于2.00, 8个性状¢为根长>芽干重>芽长>根干重>发芽指数>发芽势>发芽率>根冠比。从各性状在品种间差异显著性检验、变异系数和遗传多样性指数来看, 52份豌豆种质遗传差异较大, 胁迫前后各性状都呈现出丰富的遗传多样性, 因此进行铝毒耐性种质资源筛选具有广泛的遗传基础。
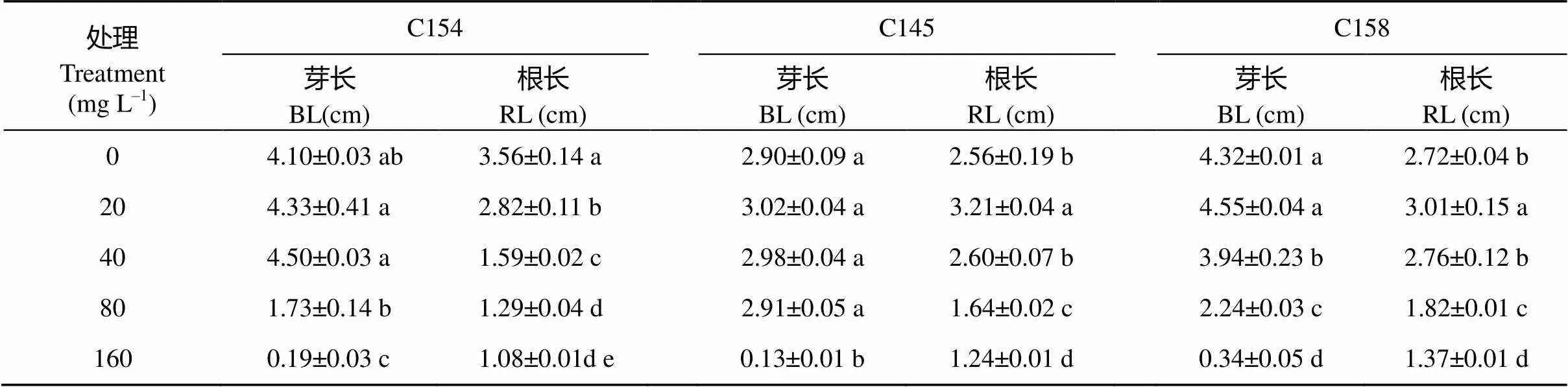
表2 不同浓度的铝胁迫处理对豌豆萌发的影响
BL: bud length; RL: root length.
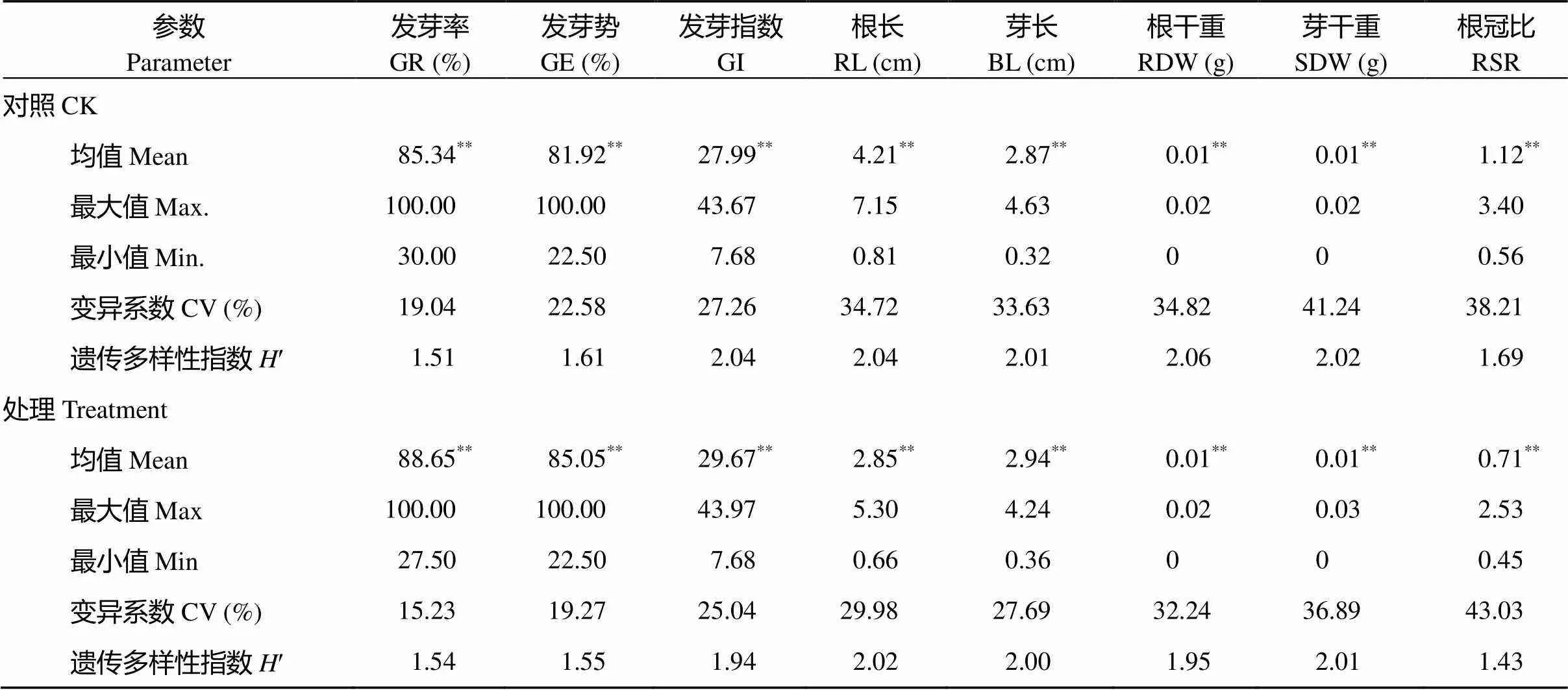
表3 铝胁迫条件下豌豆种质各指标测定值及其均值差异性分析
*和**表示品种间分别在0.05和0.01水平上显著差异。
GR: germination rate; GE: germination energy; GI: germination index; RL: root length; BL: buds length; RDW: root dry weight; SDW: shoot dry weight; RSR: root/shoot ratio.*and**are significant differences among cultivars at the 0.05 and 0.01 probability levels, respectively.
2.3 单项耐铝毒系数(AC值)相关性和综合耐性系数(CAC值)分析
不同基因型间同一指标耐铝毒系数(AC值)存在差异, 变异系数介于19.84%~49.64%之间。从AC值均值结果看, 芽干重、芽长、发芽势、发芽率和发芽指数均大于1.00, 根长、根干重和根冠比都小于1.00, 说明铝毒胁迫对52份豌豆种质萌发期地下部分毒害作用大于对发芽能力和地上部分生长。8个指标在品种间差异达到显著水平, 尽管铝毒胁迫对部分指标影响不大, 但不同基因型对铝毒响应存在较大差异, 所以仅靠均值大小无法判断铝毒对各指标的影响, 也无法说明铝毒胁迫下这些性状在各品种间存在的差异。从表4可以看出, 发芽势、发芽率、发芽指数、根长、芽长、根干重、芽干重7个性状AC值彼此间呈显著正相关, 其中发芽势、发芽率、发芽指数间相关系数均大于0.90, 而根长、根干重、芽长、芽干重4个性状间相关系数均大于0.80。根冠比与其余7个性状均呈负相关, 与芽长和芽干重间相关性达显著水平。同时, 相关分析说明各性状耐铝毒系数所提供信息发生重叠。因此, 仅根据单一性状耐铝毒系数大小进行耐铝毒特性评价具有片面性。按照综合耐铝毒系数(CAC)值大小初步判断各品种耐性大小, 13个品种(系)CAC值大于1.00, 其中C175、C145和C152排序靠前; C155和C163 CAC值较小, 排序靠后。
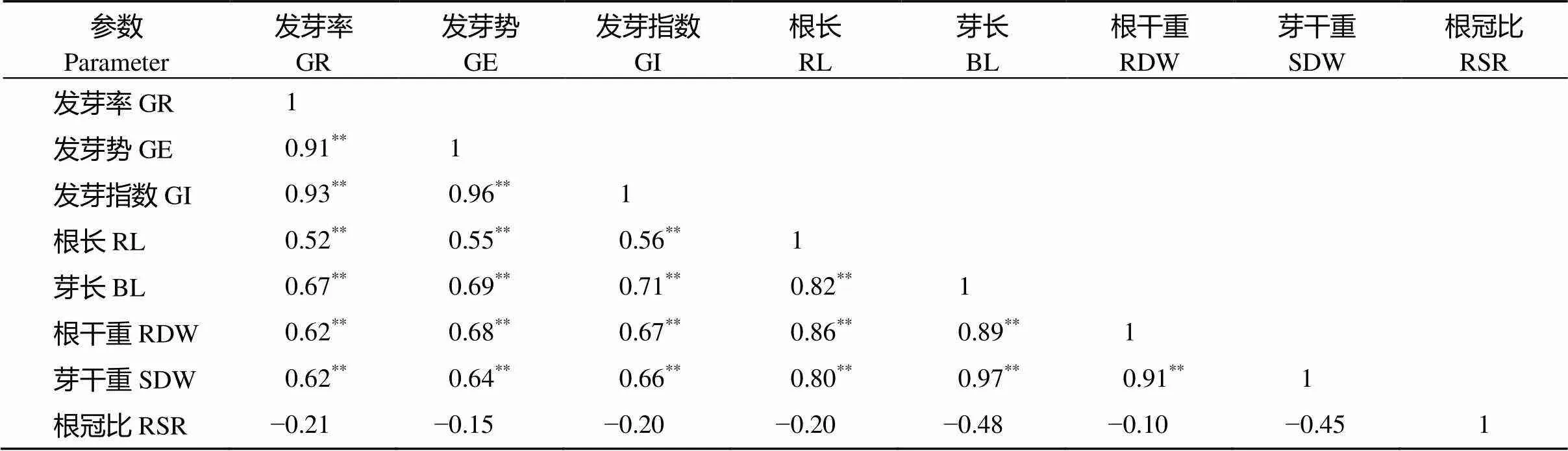
表4 各性状耐铝系数(AC值)相关系数矩阵
*和**分别表示在0.05和0.01水平上显著相关。缩写同表3。
*and**are significant correlation at the 0.05 and 0.01 probability levels, respectively. Abbreviations are the same as those given in Table 3.
2.4 单项耐铝毒系数(AC值)的隶属函数分析
8个性状单项指标的隶属函数值平均值介于0.20~ 0.34之间, 小于中值0.5, 趋近最小值, 说明52份种质多数表现为对铝毒敏感。各品系平均隶属函数值介于0.115~0.848之间, 品系间差异极大, 大于中值(0.5)的仅3份, 分别为C175、C145和C152, 其中C175的发芽率、发芽势、发芽指数3个指标隶属函数值均为1.00, 根长、芽长、根干重、芽干重的隶属函数值均大于0.8, 平均隶属函数值最高, 整体表现为耐铝毒特性最好, 综合排名第1; C145的根长、芽长、根干重、芽干重4个指标隶属函数值均为1.00, 但其发芽率、发芽势、发芽指数和根冠比受到铝毒影响较大, 隶属函数值较C175降低, 综合排位居第2。C155、C163、C173等39份材料平均隶属函数值(ASF值)在0.1~0.3之间, 表明这些品种(系)对铝毒极敏感, 发芽能力、根系和芽的生长受铝毒影响严重。C159、C104、C117等10份品系的ASF值在0.3~0.5之间, ASF居于前两组之间, 但仍低于中值0.5, 所以属于对铝毒较敏感品系。总之, 铝毒胁迫后不同豌豆种质发芽势、发芽率、发芽指数、根长、芽长等各性状的ASF表现出差异, 通过每品种(系)各性状的平均隶属函数值对52份豌豆种质耐铝毒性排序, 全面衡量铝毒对种质发芽能力及根和芽生长的综合影响, 可避免单一性状指标的片面性。
2.5 主成分分析与铝毒耐性综合评价值(A值)评价
利用DPS v7.05软件对8个单项指标耐铝系数(AC值)进行主成分分析, 前2个因子贡献率分别为69.78%和14.33%, 累计贡献率达84.11%, 其特征值λ≥1.15。抽取前2个因子, 将具有相同本质的变量归为一类, 将8个单项指标转换为2个新的相互独立的综合指标, 进一步获得第一和第二主成分因子的载荷矩阵。其中, 主成分1 (PC1)在发芽率、发芽势、发芽指数、根长、芽长、根鲜重、根干重、芽鲜重和芽干重的特征向量值载荷较高, 代表着除根冠比之外的其他7个性状。主成分2 (PC2)在根冠比上载荷量较大。从2个主成分因子包含内容和贡献率来看, PC1包含遗传信息量最大, 贡献率最高, 成为种质萌发期耐铝性筛选的主要指标, PC2作为参考指标。从表5可以看出, 52份材料中, PC1得分大于0的有18份种质, 占比34.62%; PC1得分低于0的有34份, 占比65.38%。PC2得分大于0的有20份种质, 占比38.46%; 得分小于0的有32份, 占比61.54%。考虑到PC1和PC2在铝毒耐性上的贡献率大小不同, 根据综合耐铝毒评价值(A值)大小排序显示, 52份种质A值大于0的有17份, 占32.69%, 其中C175的PC1得分11.11, PC2得分2.43, A值8.10, 在52份种质中排名第1; C145的PC1得分7.50, PC2得分-2.72, 其A值为4.85, 在52份种质中排名第2。A值小于0.00共有38份, 占67.31%, 其中C155、C163、C103等种质A值均小于-1.00, 为铝毒耐性极敏感品种(系)。
2.6 聚类分析
根据单项耐铝毒系数(AC值), 采用离散平均法进行系统聚类, 在欧式遗传距离D = 4.00左右, 将52份种质划分为3类, 其中C175和C145为第I类型, 为耐性较强的品种(系), 占参试材料的3.85%; 第II类包括C105, C152、C104、C137、C154、C109、C136等共19份材料, 占36.54%, 属于对铝毒敏感豌豆种质; 第III类包括C056、C079、CO52、C001、C051、C110等31份材料, 占52份种质的59.62%, 为铝毒极敏感型材料(图1)。对耐性评价指标分级统计表明, 除根冠比外, 其余单项指标AC值、CAC值、ASF值和A值均随铝毒耐性的降低而降低。
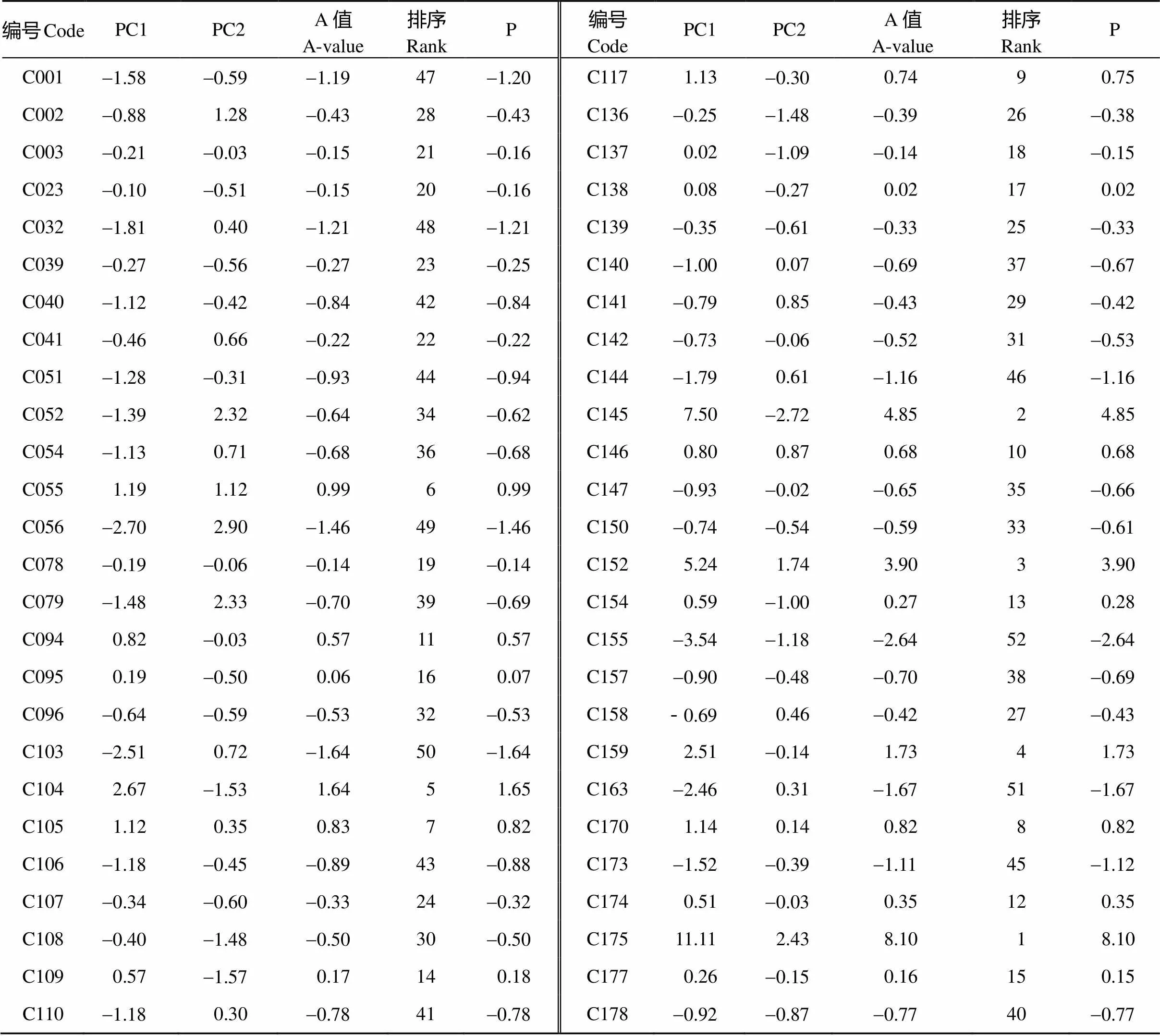
表5 52份豌豆的2个主成分因子得分、综合评价值(A值)及其预测值
PC1和PC2 对应的是每个品种的前2个主成分因子得分; P为根据回归方程计算的预测A值。
PC1 and PC2 correspond to the first two principal component scores of each variety; P is the predicted A-value calculated according to the regression equation.
2.7 回归分析及耐铝毒鉴定指标的选择
为了进一步分析萌发期各单项指标与耐铝毒特性之间的关系, 筛选出耐铝毒鉴定指标, 建立耐铝毒评价的数学模型, 预测耐铝毒性。以8个鉴定指标(AC值)为自变量, 以耐铝毒度量值(A值)为因变量, 进行逐步回归, 建立最优回归方程=-6.95+1.331+1.532+1.253+0.934+ 0.655+0.786+0.437(= 233442.04**,2= 0.9998)。公式中1、2、3、4、5、6、7分别代表发芽率、发芽势、发芽指数、根长、芽长、根干重、芽干重。由方程可知, 除根冠比外7项指标对豌豆耐铝毒特性都有显著影响; 52份豌豆种质的耐铝毒特性预测值P与耐铝毒综合度量值(A值)极显著相关,= 0.9999**(表9), 表明该回归方程对豌豆萌发期耐铝毒特性预测准确度极高、效果较好。
3 讨论
土壤为植物提供生长发育所需要的养分, 与农业生产的可持续发展密切相关。土壤酸化导致铝离子浓度增加, 对植物产生毒害作用[14]。种子萌发是作物形态建成的起始阶段, 然而该过程在表层土壤中进行且所需时间较短而没有引起足够重视。铝毒对种子萌发过程中胚根伸长具有一定抑制作用[7], 从而影响胚芽及幼苗生长, 最终影响作物产量和品质。作物铝毒耐性是由微效多基因或者主基因+微效多基因所控制的复杂数量遗传性状[15]和环境共同影响的。在田间进行耐铝性筛选和评价由于土壤空间变异引起较高的变异系数, 最终影响评价结果的可靠性[16]。溶液滤纸法(soluting-paper method)是用于植物种子Al胁迫研究的一种简单、快速、利于pH控制的方法[17]。本研究为了最大程度地减少其他环境因子对种子萌发的影响, 选择在室内光照培养箱采用溶液滤纸法, 更能体现种质在萌发期对铝毒耐性的遗传行为。
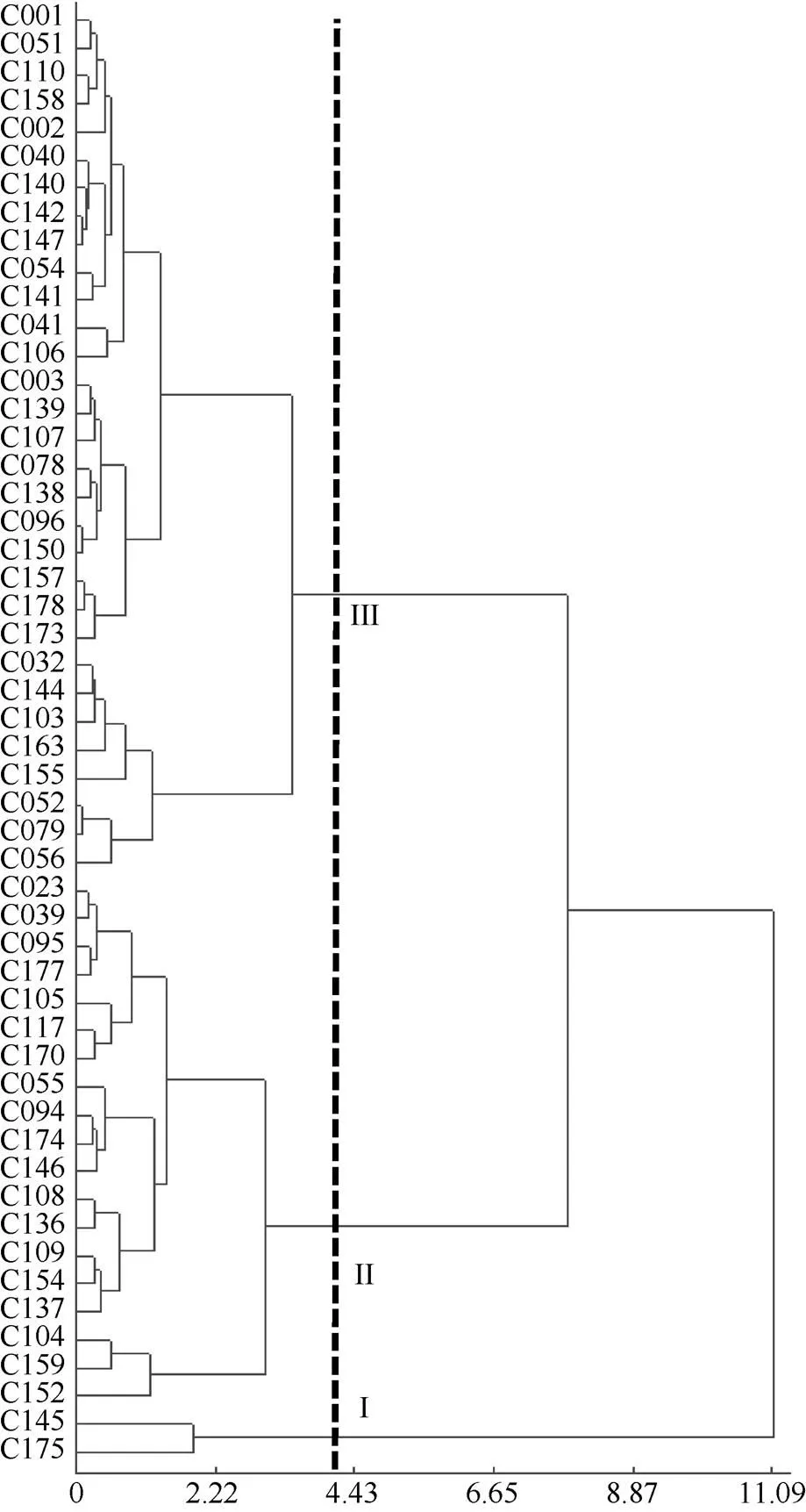
图1 52份豌豆种质资源基于AC值的聚类分析图
适宜的胁迫浓度是作物萌发期耐性资源筛选的关键, 浓度过低难于区分不同材料耐性差异, 过高则抑制种子萌发或很快致死, 因此浓度过高或过低都让作物基因型间的差异倾向于消除[18]。不同作物或同一作物不同处理方式, 胁迫浓度也存在着较大差异[5-6]。Rosado等[18]将8个麻疯树(L.)种质的种子置不同浓度Al溶液发芽室中, 结果85 mg L–1的浓度能够区分8个种质耐铝性水平。然而, Martins等[19]进一步研究发现, 铝离子浓度大于40 mg L–1时, 不同铝毒耐性的麻风树种子根发育已经严重受到抑制, 难以区分品系间铝毒耐性, 因此认为筛选麻风树种子萌发期铝毒耐性的推荐浓度为40 mg L–1。熊洁等[6]利用1 mmol L–1的AlCl3溶液处理23个油菜品种盆栽幼苗, 筛选到耐性较强的品种。应小方等[8]通过溶液培养试验, 以100 mg L–1铝溶液处理18个优质大豆品种(系), 从中筛选到具有较强耐铝毒能力的大豆基因型4个。本试验参考前人研究结果, 预实验确定40 mg L–1Al3+为52份豌豆种质铝毒胁迫浓度, 该浓度与部分学者进行种子萌发期铝毒胁迫浓度相近[19]。40 mg L–1的Al3+胁迫处理有效区分了52份豌豆种质萌发期耐铝毒能力的强弱。
作物耐铝毒特性是指作物在铝毒胁迫下的适应性和抵抗能力。耐铝毒性鉴定就是对不同基因型种质耐铝毒能力鉴定、筛选、评价和归类的一个过程, 因此, 选用合适的鉴定指标和评价方法极为重要。已有研究表明, 植物受到铝毒害的主要作用位点是根尖, 最初表现出的症状是根系伸长生长受到明显抑制[7,20]。根系性状及其对铝毒害的反应已被广泛地用于作物耐铝性筛选。然而, 生物是一个整体, 种子萌发过程中胚根和胚芽生长具有一定相关性。从豌豆萌发期8个性状AC值间相关性来看, 根长与发芽势、发芽率、发芽指数、根干重、芽长、芽干重6个性状均显著正相关, 其中与根干重、芽长和芽干重相关系数分别达到0.86、0.82和0.80, 相关性较强, 表明铝毒胁迫对根系影响程度决定着胚芽的生长质量。8个性状间的相关性说明铝毒影响是综合的, 以单一指标判断铝毒耐性并不全面。主成分分析是一种处理高维数据的方法, 通过降维达到简化数据结构的目的, 在薏苡(L.)、燕麦(L.)等多种作物性状评价与种质资源综合评价中已得到广泛运用[13,21]。本文根据单项耐性系数(AC值)进行主成分分析, 结果PC1和PC2累计代表8个性状遗传信息的84.11%, 所以PC1和PC2可以作为52份豌豆种质的主要评价指标, 但是这2个指标权重并不等同, 为了进一步减少单项指标(主成分)的评价片面性, 本研究根据每个品系的PC1、PC2得分及其贡献率, 计算每个品系铝毒耐性的综合度量值(A值), 再根据A值排序比较各种质相对铝毒耐性大小, 这种排序更全面、更科学。为了分析耐铝性鉴定指标与耐铝性之间的关系, 本研究以萌发期8个鉴定指标(AC值)为自变量, 以对铝毒耐性的综合度量值(A值)为因变量, 进行逐步回归, 建立最优回归方程。从方程结果看, 除根冠比外, 其余7个指标均包含在回归方程中。因此, 在豌豆萌发期耐铝毒种质资源筛选中, 可以测定这7项指标, 利用该公式计算A值, 再根据A值快速预测豌豆种质耐铝毒能力。
通过对52份豌豆种质的综合耐铝毒系数(CAC值)、主成分分析、平均隶属函数值(ASF值)和铝毒耐性综合度量(A值)并结合聚类分析, 发现C175和C145在所有评价体系中均表现为萌发期耐铝性较强。这2个品系将在豌豆耐铝性育种, 尤其是萌发期耐铝毒豌豆新品种选育中发挥重要作用。溶液滤纸法被广泛用于植物种子耐Al性筛选研究[17-19], 然而室内筛选出来的种质和复杂的大田环境筛选结果可能存在一定差异。基因表达存在着一定的时空特性, 作物对非生物胁迫的耐性与生长发育时期有关[22], 因此, 这2个材料在苗期以及成株期是否具有较强的耐铝毒特性还有待验证。
[1] Guo J H, Liu X J, Zhang Y, Shen J L, Han W X, Zhang W F, Christie P, Goulding K, Vitousek P M, Zhang F S. Significant acidification in major Chinese croplands., 2010, 327: 1008–1010.
[2] Arenhart R A, De Lima J C, Pedron M, Carvalho F E L, Da Silveira J A G, Rosa S B, Caverzan A, Andrade C M B, Schunemann M, Margis R, Margis-Pinheiro M. Involvement of ASR genes in aluminum tolerance mechanisms in rice., 2013, 36: 52–67.
[3] 舒畅. 耐铝毒水稻(L.)种质资源的筛选及不同形态N素对水稻幼苗耐铝性的影响. 南京农业大学硕士学位论文, 江苏南京, 2011.Shu C. The Screening of the Rice Germplasm Resources on Al Tolerance and the Impact of Different Forms of N Element on Al Tolerance in Rice (L). MS Thesis of Nanjing Agriculture University, Nanjing, Jiangsu, China, 2011 (in Chinese with English abstract).
[4] 刘武. 玉米抗铝毒自交系的筛选、生理检测和基因芯片分析. 四川农业大学硕士学位论文, 四川雅安, 2013.Liu W. Screening, Physiological Detection and Gene Chip Analysis of Maize Inbred Lines Resistant to Aluminum Toxicity. MS Thesis of Sichuan Agriculture University, Ya’an, Sichuan, China, 2013 (in Chinese with English abstract).
[5] 齐波, 赵团结, 盖钧镒. 中国大豆种质资源耐铝毒性的变异特点及优选. 大豆科学, 2007, 26: 813–819.Qi B, Zhao T J, Gai J Y. Characterization of variation and identification of elite accessions of aluminum toxin tolerance soybean germplasm in China.2007, 26: 813–819 (in Chinese with English abstract).
[6] 熊洁, 邹小云, 陈伦林, 李书宇, 邹晓芬, 宋来强. 油菜苗期耐铝基因型筛选和鉴定指标的研究. 中国农业科学, 2015, 48: 3112–3120.Xiong J,Zou X Y, Chen L L, Li S Y, Zou X F, Song L Q. Screening of rapeseed genotypes with aluminum tolerance at seedling stage and evaluation of selecting indices., 2015, 48: 3112–3120 (in Chinese with English abstract).
[7] 胡萃, 刘强, 龙婉婉, 李芙蓉, 李荣刚. 铝胁迫对芝麻种子萌发和根系生长的影响. 江苏农业科学, 2009, (3): 60–62.Hu C, Liu Q, Long W W, Li F R, Li R G. Effects of aluminum on the seed germinating and root growth in sesame (L)., 2009, (3): 60–62 (in Chinese with English abstract).
[8] 宗绪晓, 关建平, 王述民, 刘庆昌. 中国豌豆地方品种SSR标记遗传多样性分析. 作物学报, 2008, 34: 1330–1338.Zong X X, Guan J P, Wang S M, Liu Q C. Genetic diversity among Chinese pea (L) landraces revealed by SSR markers., 2008, 34: 1330–1338 (in Chinese with English abstract).
[9] 李玲, 沈宝宇, 张天静, 杨涛, 刘荣, 宗绪晓. 豌豆种质资源芽期耐旱性评价及耐旱种质筛选. 植物遗传资源学报, 2017, 18: 778–785. Li L, Shen B Y, Zhang T J, Yang T, Liu R, Zong X X. Evaluation and screening of pea () germplasm resources for drought resistance during germination stage., 2017,18: 778–785 (in Chinese with English abstract).
[10] 刘安芳, 伍莲. 生物统计学. 重庆: 西南师范大学出版社, 2013. pp 279–285.Liu A F, Wu L. Biostatistics. Chongqing: Southwest China Normal University Press, 2013. pp 279–285 (in Chinese).
[11] 唐启义, 冯明光. DPS 数据处理系统: 实验设计统计分析及数据挖掘. 北京: 科学出版社, 2007. pp 636–644, 682–690, 1027–1036.Tang Q Y, Feng M G. DPS Data Processing System: Statistical Analysis and Data Mining of Experimental Design. Beijing: Science Press, 2007. pp 636–644, 682–690, 1027–1036 (in Chinese).
[12] Keylock C J. Simpson diversity and the Shannon–Wiener index as special cases of a generalized entropy.2010, 109: 203–207.
[13] 汪灿, 周棱波, 张国兵, 张立异, 徐燕, 高旭, 姜讷, 邵明波. 薏苡种质资源苗期抗旱性鉴定及抗旱指标筛选. 中国农业科学, 2017, 50: 2872–2887.Wang C, Zhou L B, Zhang G B, Zhang L Y, Xu Y, Gao X, Jiang N, Shao M B. Drought resistance identification and drought resistance indices screening of Job’s Tears (L) germplasm resources at seedling stage., 2017, 50: 2872–2887 (in Chinese with English abstract).
[14] Gupta N, Gaurav S S, Kumar A. Molecular basis of aluminum toxicity in plants: a review., 2013, 4: 21–37.
[15] Korir P C. 大豆耐铝毒的鉴定、遗传和QTL分析. 南京农业大学博士学位论文, 江苏南京, 2010.Korir P C. Evaluation, Inheritance and QTL Analysis of Aluminum Tolerance in Soybean [(L.) Merr]. PhD Dissertation of Nanjing Agricultural University. Nanjing, Jiangsu, China, 2010 (in Chinese with English abstract).
[16] Ouma E, Ligeyo D, Matonyei T, Agalo J, Were B, Too E, Onkware A, Gudu S, Kisinyo P, Nyangweso P. Enhancing maize grain yield in acid soils of western kenya using aluminum tolerance germplasm., 2013, 3: 33–46.
[17] Konzak C F, Polle E, Kittrick J A. Screening several crops for aluminum tolerance. In: Workshop on plant adaptation to mineral stress in problem soils. Maryland: Cornell University Press, 1976. pp 311–327.
[18] Rosado R D S, Fialho G S, Dias B A S, Rosado T B, Martinez H E P, Laviola B G. Screeninggenotypes for aluminum tolerance using the solution paper method.2012, 33: 1273–1280.
[19] Martins L D, Lopes J C, Laviola B G, Colodetti T V, Rodrigues W N. Selection of genotypes ofL. for aluminum tolerance using the solution-paper method., 2013, 31: 81–86.
[20] Kerridge M, Poschenrieder C, Barceló J. Monitoring of aluminum-induced inhibition of root elongation in four maize cultivars differing in tolerance to aluminum and proton toxicity.2010, 93: 265–271.
[21] 陈新, 张宗文, 吴斌. 裸燕麦萌发期耐盐性综合评价与耐盐种质筛选. 中国农业科学, 2014, 47: 2038–2046. Chen X, Zhang Z W, Wu B. Comprehensive evaluation of salt tolerance and screening for salt tolerant accessions of naked oat (L.) at germination stage., 2014, 47: 2038–2046 (in Chinese with English abstract).
[22] Heenan D P, Lewin L G, McCaffery D W. Salinity tolerance in rice varieties at different growth stages., 1988, 28: 343–349.
Screening and comprehensive evaluation of aluminum-toxicity tolerance during germination stage in 52 varieties (lines) of pea germplasm
CUI Cui, CHENG Chuang, ZHAO Yu-Feng, GAO Huan-Huan, WANG Rui-Li, WANG Liu-Yan, and ZHOU Qing-Yuan*
College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China
With increasing acidification of soil, aluminum toxicity has become one of the important stress factors affecting seed germination quality and crop yield. The purpose of this study is to explore the characteristics of aluminum toxicity tolerance in different genotypes of, and establish the comprehensive evaluation system for screening and breeding new varieties with aluminum toxicity tolerance. The identification of tolerance at germination stage was performed according to the comprehensive tolerance coefficient of aluminum toxicity (CAC) value, the average subordinate function value (ASF value), the comprehensive evaluation value of aluminum toxicity tolerance (A-value) in correlation analysis, frequency analysis, principal component analysis, cluster analysis and stepwise regression analysis. Fifty-two pea varieties collected from different places were treated with 40 mg L–1Al3+screened in the pretest. There were significant differences between treatment and control groups in germination rate, germination energy, germination index, root length, bud length, root dry weight, bud dry weight, root-shoot ratio, and the genetic diversity index ranging from 1.43-2.03 and 1.51-2.06, respectively, showing extensive genetic variation. Cluster analysis was carried out based on A value, exhibiting that the tested cultivars were roughly divided into groups with three aluminum toxicity tolerance grades. The first group including two varieties is tolerant to aluminum toxicity, the second group including 19 varieties is sensitive to aluminum toxicity, and the last group containing 31 other varieties is very sensitive to aluminum toxicity. Combined with the optimal regression equation, seven indexes of pea seed germination rate, germination potential, germination index, bud length, root length, bud dry weight and root dry weight were used to comprehensively evaluate and identify the aluminum toxicity tolerance of pea during germination period. Through comprehensive evaluation and cluster analysis, germplasm C175 and C145 were screened out with strong tolerance to aluminum toxicity in germinating stage, which can be used as important resources for breeding near varieties and studying the mechanism of tolerance to aluminum toxicity in pea.
pea; germination period; aluminum toxicity tolerance; comprehensive evaluation; germplasm resources screening
2018-08-21;
2019-01-12;
2019-02-19.
10.3724/SP.J.1006.2019.84110
周清元, E-mail: zhouqy2005@163.com
E-mail: cuigreeny@163.com
本研究由国家现代农业产业技术体系建设专项(CARS-12)和重庆市社会事业与民生保障科技创新项目(cstc2015shmszx80026)资助。
This study was supported by the China Agriculture Research System (CARS-12) and the Science and Technology Committee of Chongqing (cstc2015shmszx80026).
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20190219.0929.003.html
