左旋聚乳酸多孔微球体外动态培养耳郭软骨细胞的研究
2019-05-09孙恒蒋海越马世泽刘霞滕利
孙恒 蒋海越 马世泽 刘霞 滕利
细胞三维培养更接近体内环境,更有利于维持细胞表型或功能[1-3]。研究认为,三维的培养环境和适当的机械刺激有助于组织工程软骨细胞外基质的分泌[4-6]。其中,微载体空间利用率高,成为贴壁细胞大规模培养最常用的技术,微载体三维培养方法可在快速扩增软骨细胞的同时保持软骨细胞的表型[7-8]。
多种商用微载体已经问世,但大部分微载体不可降解,且多是实心结构。后来出现了多孔微载体,可提供的表面积更大。微载体材料方面,也出现了可降解材料,在收获细胞时无需胰酶消化,等材料自然降解即可。多孔微载体除了用作培养软骨细胞的载体,还可用作构建可注射组织工程软骨的支架。目前常用的商业化微载体中,满足孔径合适且可降解要求的仅有Cultispher微载体,其孔径约为20 μm,有研究将其用于构建组织工程软骨[9]。但相比Cultispher微载体,我们制备的PLLA(左旋聚乳酸)多孔微球孔径更大,约为25 μm,且孔隙率更高。本研究主要比较PLLA多孔微球和商业多孔微球Cultispher G对猪耳郭软骨细胞体外三维培养的影响。
1 材料和方法
1.1 试剂和仪器
DMEM 培养基(Hyclone,USA),胎牛血清(Gibco,USA),0.25%胰酶(Hyclone,USA),Ⅱ型胶原酶(sigma,USA),CCK-8试剂盒、DIO细胞膜绿色荧光探针(碧云天,中国), RNeasy mini kit(QIAGEN,德国),Cultispher G 多孔微载体(PercellBiolytica,瑞典),PLLA 多孔微球(中国医学科学院生物医学工程研究所)。
RCCS 生物反应器(Synthecon,USA),LightCyclerR480Ⅱ实时荧光定量PCR系统(Roche,瑞士)。
1.2 猪耳郭软骨细胞的分离、培养
3只健康长枫杂交猪,雌雄不限,50~60日龄,体质量6~8 Kg。无菌条件下切取双侧耳朵,于超净台分离出耳软骨,剪切至1 mm3大小,加入5倍体积0.25%胰蛋白酶于37℃恒温摇床内消化40 min,再加入5倍体积0.2%Ⅳ型胶原酶,37℃恒温摇床内震荡消化8 h。将消化的细胞悬液经滤网过滤后,收集并离心,以2×104cells/mL的细胞密度接种于培养皿中,每3天换液一次。细胞生长达到80%~90%融合时1∶3传代,本实验选用第1代软骨细胞。
1.3 微载体预处理
将PLLA、Cultispher G两种多孔微球各150 mg用无钙、镁离子的PBS浸泡过夜,再用PBS洗涤两次,高温高压灭菌30 min,再以DMEM培养基洗涤两次,并浸泡于DMEM培养基中,置4℃冰箱中备用。
1.4 微球材料接种细胞
将软骨细胞用绿色荧光探针染色(DIO)后,分别接种于两种微球上(各4×107cells),加入到盛有RCCS的容器中,并补加 DMEM培养基至容器内充满液体为止。将RCCS反应器置于培养箱中,于5%CO2、100%湿度、37℃常规条件下培养,调整RCCS容器旋转速度,使微载体可以悬浮于培养容器中,隔天换液。接种后第1天待细胞贴附于微载体后,取样品测量接种率,实验重复3次。接种率=微球上细胞数/总接种细胞数×100%。在体外培养7、21 d时以荧光倒置显微镜观察微球形态和细胞生长情况。
1.5 扫描电镜观察
取两组空白微球和体外培养7、21 d的细胞培养样品,PBS清洗3次,加2%戊二醛固定24 h,随后乙醇梯度脱水,再用乙酸异戊酯置换2次,二氧化碳临界干燥器干燥后,真空喷溅铂金离子,用SU-8010冷场发射扫描电镜观察细胞生长状况并拍照。
1.6 CCK-8检测细胞增殖
于培养 第 1、5、9、13、17、21 天时, 二组分别取1 mL 样品,加入 100 μL CCK-8,培养箱孵育 2 h,荧光酶标仪测量450 nm吸光度值。
1.7 荧光定量PCR
培养14、21 d后,两组分别取适量细胞-微球复合物,根据RNA提取试剂盒使用说明提取RNA,取1 000 ng RNA按逆转录试剂盒使用说明逆转录为cDNA。引物根据标准设计规则在pubmed上设计及验证(表1),由擎科公司合成(中国,北京)。qPCR测量通过Roche480系统完成。采用2^-△△Ct法计算mRNA的相对表达量。
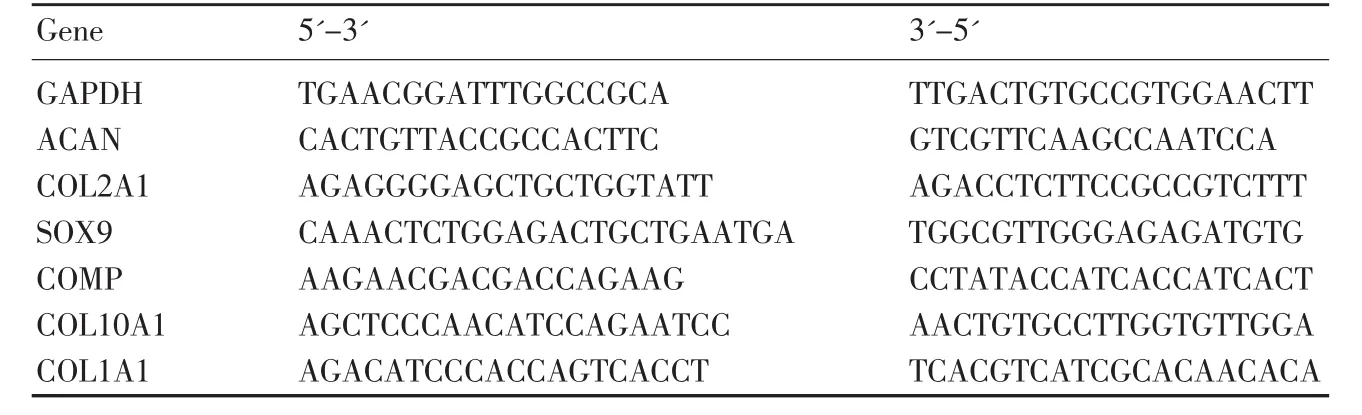
表1 引物序列Table 1 Primer sequences
1.8 统计分析
采用SPSS统计软件进行统计分析,计量资料以(x±s)表示,组间比较采用 t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两种多孔微球形态检测及接种率比较
电镜和组织切片观察两种空白微球可见:PLLA多孔微球表面孔径(25 μm左右)比Cultispher G(20 μm左右)略大,而且PLLA多孔微球孔隙率高,内部孔径也较Cultispher G微球均匀(图1)。PLLA多孔微球的细胞接种率为(37.67%±2.33%),Cultispher G的接种率为(73.67%±3.53%)(图 2)。Cultispher G 高于PLLA微球,差异有统计学意义(P<0.05)。
2.2 微球形态和细胞生长情况
培养7 d时(图3),荧光倒置显微镜下看PLLA组细胞量少于Cultispher G组,电镜观察显示细胞在微球表面呈单层分布,细胞形态呈不规则扁平状,周边舒展,生出伪足,紧附于微载体表面。PLLA组细胞未完全覆盖多孔微球,Cultispher G组细胞已将多孔微球完全覆盖。由于细胞外基质的分泌,微球间产生连接,聚集在一起,但不太紧密。培养21 d时(图4),荧光倒置显微镜下软骨细胞数量在微球上进一步增殖,电镜下见细胞呈多层生长,细胞外基质也明显增加,将微球完全包裹,细胞外基质将多个微球紧紧包裹,形成不易分开的整体。两组材料均长满细胞,但PLLA组微球体积更大,细胞可黏附面积也更大。

图1 空白微球电镜和切片照片Fig.1 SEM and section photos of blank ball

图3 软骨细胞在PLLA、Cultispher G多孔微球生长7 d时DIO荧光和电镜照片Fig.3 DIO fluorescence and SEM photos of chondrocytes on PLLA and Cultispher G porous microspheres in the 7 days
2.3 细胞生长曲线对比
Cultispher G多孔微球组细胞接种量高,也更早趋于饱和,至2周左右后细胞总量不再增加;PLLA多孔微球组接种细胞量低,初始细胞总数少,到达细胞最大量时间较Cultispher G多孔微球组晚,但其细胞总数至观察终点时仍在缓慢增长。虽然PLLA多孔微球组开始接种细胞量少,但是培养21 d后,细胞总数高于Cultispher G多孔微球组(图5)。
2.4 对软骨细胞分化的影响
培养21 d后,PLLA多孔微球组软骨分化基因ACAN、COL2、SOX9、COMP 的表达量均高于 Cultispher G多孔微球组。软骨肥大分化基因COL10表达量在培养14 d后两组未见差异,培养21 d后PLLA多孔微球组表达量更高;COL1表达量在培养14 d后Cultispher G多孔微球组更高,而培养21 d后两组未见差异(图6)。
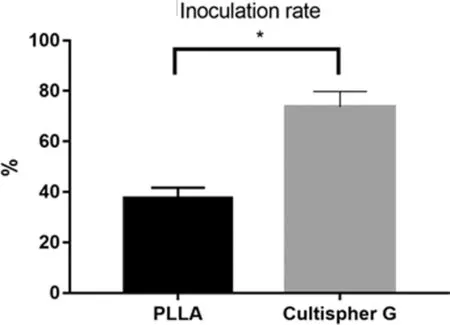
图2 PLLA和Cultispher G多孔微球接种率(P<0.05)Fig.2 Inoculation rates of PLLA and Cultispher G porous microsphere(P<0.05)
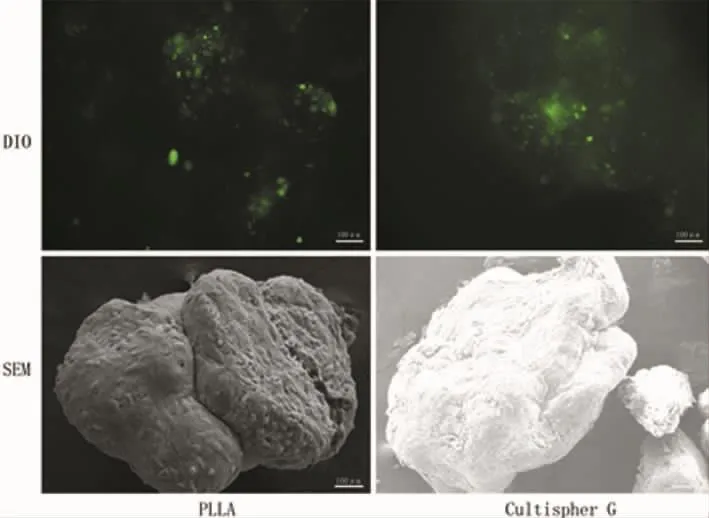
图4 细胞在PLLA、Cultispher G多孔微球生长21 d时DIO荧光和电镜照片Fig.4 DIO fluorescence and SEM photos of chondrocytes on PLLA and Cultispher G porous microspheres in the 21 days

图5 软骨细胞生长曲线Fig.5 Growth curve of chondrocytes
3 讨论
微载体可分为多孔微载体和实心微载体,多孔微载体可以提供更大的表面积,有利于营养物质的交换和吸收及细胞的生长。Chung等[10]发现,软骨细胞不但在多孔微球上黏附和增殖多于无孔微球,且软骨表型维持更好。与无孔微球相比,多孔微球细胞在微球内部可避免外部机械力冲击,更好地生长[11]。另外,同样体积多孔微球材料比无孔微球少很多,降解产物对细胞产生的影响也更小,多孔微球密度也较无孔微球低,在容器中更容易悬浮[12]。
微载体孔径大小对细胞生长也有影响,研究发现细胞在大孔微球上比小孔微球上增殖更快,且分布更均匀;小孔微球仅在表面长出一层细胞,且死细胞比大孔微球多,因为小孔径限制了营养物质和氧气的交流。
Cultispher G是明胶材料,细胞亲和性好、黏附率高,细胞利用率高。合成聚合物材料和天然聚合物相比,细胞亲和性弱,本实验结果也同样显示PLLA多孔微球细胞接种率低。细胞增殖方面可见PLLA多孔微球培养21 d后细胞增殖总量大于Cultispher G多孔微球,可能是因为PLLA多孔微球孔径和孔隙率高于Cultispher G多孔微球,细胞更易长入多孔微球内部,空间更大更有利于细胞的进一步增殖。维持软骨细胞表型方面,Cultispher G多孔微球不如PLLA多孔微球。培养21 d后,软骨相关基因表达均为PLLA多孔微球更高。
本研究对比了软骨细胞在两种微球上的黏附、增殖和分化。PLLA微球虽然细胞亲和性稍差,但总体优于Cultispher G。后续将对PLLA多孔微球进行表面修饰,改善其细胞亲和性。
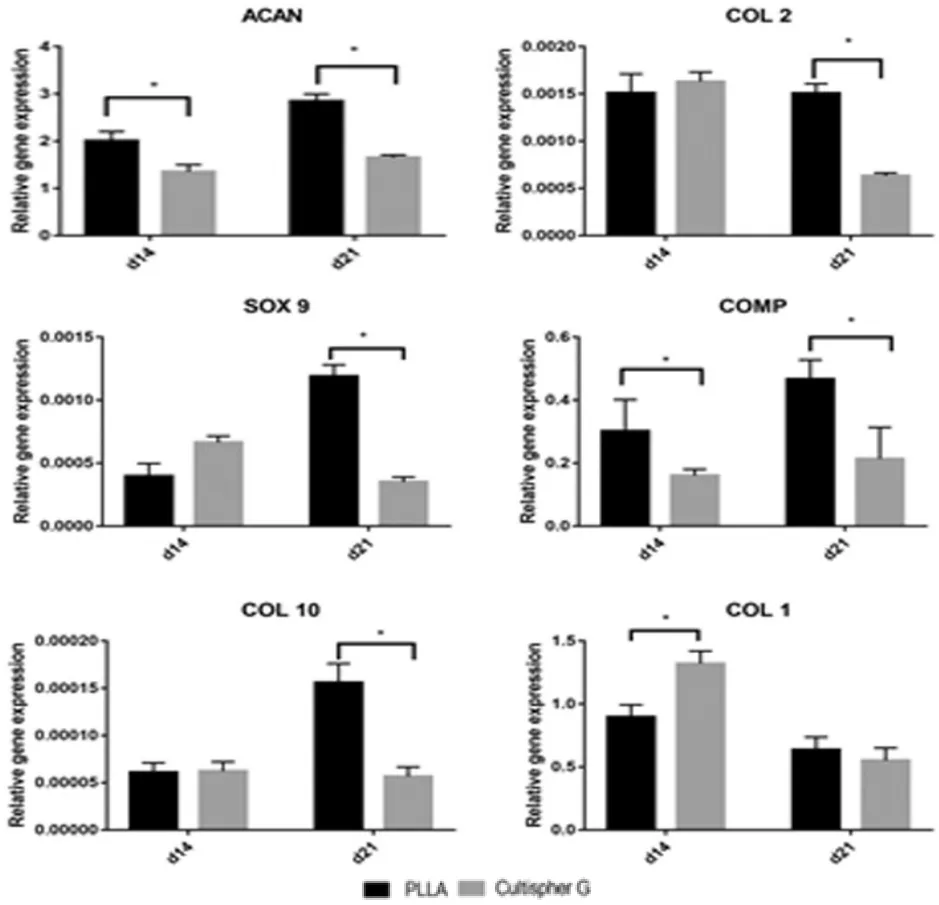
图6 相关基因表达量Fig.6 Related gene expression
