JNK抑制剂对软骨细胞外基质合成的作用研究
2019-05-09刘延群贾立涛刘春燕陈洁周广东
刘延群 贾立涛 刘春燕 陈洁 周广东
骨关节炎(Osteoarthritis,OA)是临床常见疾病[1],病因复杂,目前尚缺乏有效的治疗方法。OA与多种危险因素有关,包括遗传因素、组成因素以及促成OA发展的若干化学和生物力学风险因素,导致关节软骨基质的合成和降解之间的不平衡。大量证据表明,OA是一种退行性关节疾病,其特征是软骨细胞死亡,软骨细胞外基质(ECM)损失[2],这亦是OA发生发展的主要原因[1-3]。
研究表明,JNK抑制剂可以有效减少危险因素对OA细胞外基质的破坏。JNK与ERK途径激活c-Jun,通过调节促炎症细胞因子(如TNFα和IL)的表达,导致蛋白多糖合成减少和软骨降解酶MMP-13的产生增加[4-6]。抑制JNK途径可能是预防和治疗OA的方式之一[7]。本课题拟通过研究JNK抑制剂(SP600125)对软骨细胞外基质合成的影响,为JNK抑制剂在OA治疗中的应用提供前期研究基础。
1 材料与方法
1.1 实验试剂及仪器
DMEM 培养液(Gibco公司,美国)、0.05%胰蛋白酶(Gibco公司,美国)、0.25%Ⅱ型胶原酶、链霉素、青霉素(Gibco公司,美国),胎牛血清(HYCLONE公司,美国),CCK-8试剂盒(同仁化学,日本),无纺聚乙醇酸(PGA)纤维(组织工程国家工程研究中心提供),SP600125(ADOOQ 公司,美国),SEM(Philips XL-30, 荷兰), 连续荧光检测器(Stratagene MX3000P,美国)。
1.2 实验动物
6周龄新西兰白兔1只 (上海甲干生物科技有限公司)。本实验遵守实验动物伦理原则。
1.3 获取兔耳软骨细胞
取兔耳软骨,将软骨片切碎成1.0 mm3大小,置于DMEM中,0.25%Ⅱ型胶原酶37℃消化8 h。然后将收获的软骨细胞接种到含有10%胎牛血清(FBS)和1%青霉素、链霉素的DMEM培养皿(10cm)中,37℃、5%CO2下培养。取第2代软骨细胞进行后续实验。
1.4 实验分组
实验组培养液:含有10%FBS、1%青霉素、链霉素和 JNK 抑制剂(SP600125,浓度 100 nmol/mL)的DMEM培养液;对照组培养液:含有10%FBS和1%青霉素、链霉素的DMEM培养液。
1.5 支架材料的制备
取适量的PLA粉末,用二氯甲烷配制成浓度为0.5%的溶液。称取15 mg PGA纤维放进针筒内,分次滴加少许0.5%PLA溶液,将PGA/PLA聚合物压成直径9 mm、厚2 mm的柱状细胞支架,扫描电镜下拍照,75%乙醇消毒后备用。
1.6 细胞-支架复合物的制备
调整第2代软骨细胞密度为8×107cells/mL,将细胞悬液均匀地滴加在已消毒的PGA/PLA材料上,37℃、5%浓度CO2、100%饱和湿度条件下培养,4 h后样本随机分组,对照组加普通血清培养液,实验组添加SP600125工作液;两组细胞-支架复合物均在37℃、95%湿度和5%CO2下培养8周。
1.7 CCK-8法测定细胞增殖情况
将第2代软骨细胞(P2)以2 000个/孔的密度接种于96孔板,加入100 μL PBS以防止水分丢失。实验组各孔加入100 μL SP600125工作液,对照组各孔加入100 μL普通培养液。两组均常规培养,隔天全量更换相应培养液。体外培养11 d,从第1天开始,隔天每组取5个孔加入10 μL的CCK-8试剂,培养箱内孵育120 min,酶标仪450 nm波长处测定吸光度值,每组均设一个空白对照孔(单纯培养基,没有细胞),实验重复3次,绘制生长曲线。
1.8 RT-PCR
体外培养8周后,每组分别提取组织样品的总RNA,通过反向聚合酶转录(RT)获得cDNA。用连续荧光检测器进行RT-PCR反应,检测软骨特异性基因 IGF、COLⅡ、COLⅨ、TGF-β1 的表达情况。 将 βactin mRNA设为内参(表1)。
1.9 组织学观察
将体外培养8周后的细胞-支架复合物在多聚甲醛中固定48 h,石蜡包埋,5μm切片,行HE染色与Safranin-O染色。
1.1 0 统计学分析
采用 GraphPad Prism软件(Version 5.0,美国)行统计分析,数据以(x±s)表示,组间比较采用非配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 SP600125对体外软骨细胞增殖的影响
CCK-8检测结果显示,实验组软骨细胞的增殖明显快于对照组(图1)。
2.2 细胞-支架复合物的构建
PGA/PLA支架形状规整,表面粗糙;扫描电镜显示,PGA/PLA支架的孔径多大于100 μm;细胞-支架复合物中细胞在支架表面分布均匀,呈淡黄色(图 2)。
2.3 RT-PCR检测软骨相关特异性基因的表达
细胞-支架复合物体外培养8周后,RT-PCR结果显示,实验组 IGF、COLⅡ、COLⅨ、TGFβ1 的表达均显著下降,与对照组差异明显(P<0.01)(图 3)。
2.4 组织学观察
HE染色显示,与对照组比较,实验组经体外培养8周后,再生软骨质量显著下降,软骨厚度降低,软骨陷窝的成熟度较差;Safranin-O染色结果显示,相较与对照组,实验组软骨细胞外基质的合成量显著降低(图 4)。

表1 引物序列Table 1 Primer sequence
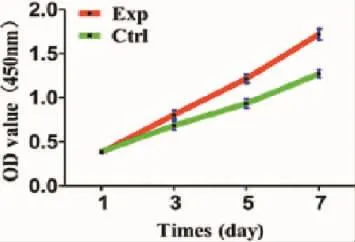
图1 各组细胞增殖曲线Fig.1 Cell proliferation curve of each group

图2 细胞-支架复合物的构建Fig.2 The construction of cell-scaffold complex
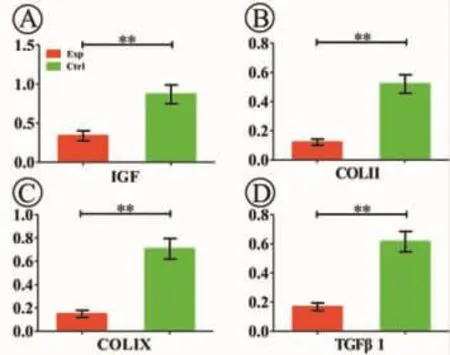
图3 RT-PCR检测各组软骨特异性基因的表达(**:P<0.01)Fig.3 Cartilage specific gene expression of each group detected by RT-PCR(**:P<0.01)
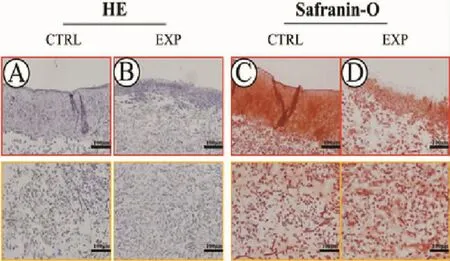
图4 各组组织学观察Fig.4 Histological observation of each group
3 讨论
骨关节炎(OA)是一种以关节软骨退行性变和关节周围骨质增生为病理性特征的慢性进行性骨关节病。关节软骨是由软骨细胞分泌软骨细胞外基质形成的,软骨细胞是维持软骨细胞外基质合成和更新的关键,软骨细胞的逐渐丧失和细胞外基质的降解被认为是骨关节炎发生发展的主要原因[8-9]。其中,TNF-α、白细胞介素等炎症因子,在OA的发生和发展过程中发挥了重要作用。抑制IL-1β和TNF-α的表达可能是治疗OA的有效途径。
研究表明,JNK途径通过激活下游因子c-Jun而促进促炎症细胞因子的表达,如TNFα、IL-6、IL-1等,导致细胞外基质蛋白多糖合成减少和软骨降解酶MMP-13的产生增加。因此,JNK途径抑制剂被认为可能是一种治疗骨关节炎的有效途径[7,10]。JNK信号通路是一种重要的蛋白激酶,在细胞的增殖、分化、存活以及凋亡中扮演重要的角色。然而,JNK通路抑制在不同组织、不同细胞、不同病理环境下,其作用不尽相同。研究显示,JNK通路抑制剂SP600125对胃癌细胞的增殖有抑制作用。Che等[11]的研究表明,在食管鳞癌细胞中可通过激活JNK通路而发挥其抗肿瘤作用。另有研究表明,抑制JNK通路的表达可用来促进肝星状细胞凋亡的发生,最终缓解肝纤维化的程度[12]。目前,JNK通路抑制剂对软骨细胞的增殖作用仍未明确。本研究通过CCK-8检测证实,JNK通路抑制剂对软骨细胞具有显著的促增殖作用。
抑制骨关节炎中软骨细胞的减少是延缓甚至阻断骨关节炎发生发展的关键,促进软骨外细胞基质的合成则是修复关节损伤的重要环节。本研究进一步对JNK通路抑制剂对软骨细胞外基质合成的影响进行了初步探讨。RT-PCR证实了SP600125长期使用可以显著抑制包括 IGF、COLⅡ、COLⅨ、TGFβ1等在内的软骨特异性基因的表达。本实验结果显示,相较对照组,实验组软骨细胞外基质显著降低,并没有形成成熟的软骨陷窝结构。上述结果表明,长期独立使用JNK抑制剂对软骨细胞外基质的合成有抑制作用。
综上所述,本研究结果提示JNK通路抑制剂短期应用对软骨细胞的增殖有促进作用;JNK通路抑制剂长期单独应用对软骨细胞合成软骨细胞外基质具有抑制作用。虽然JNK通路抑制剂短期应用对软骨细胞的增殖具有促进作用,但长期应用可抑制软骨细胞外基质的合成。因此,如何长期安全地应用JNK抑制剂治疗OA是今后研究的重要方向。
