激光打孔脱细胞基质复合骨髓间充质干细胞构建组织工程气管软骨
2019-05-09徐勇刘春燕刘延群李亚强段亮姜格宁
徐勇 刘春燕 刘延群 李亚强 段亮 姜格宁
组织工程气管的研究已有近30年的历史[1],虽然长段气管缺损的修复依然是目前无法解决的难题,但仍然取得了巨大的进展。研究表明,组织工程气管因生物相容性好、免疫排斥反应少、生物活性好,以及相关组织细胞再生培养等多方面的优点,而被认为是最理想、最符合生理要求的气管缺损修复的方向。
骨髓间充质干细胞(BMSCs)具有来源充足、取材方便、创伤小、增殖能力强、无排斥反应、不存在伦理问题等优点,是目前较为理想的种子细胞。但是BMSCs易分化成骨,因此单纯应用BMSCs构建完整气管软骨组织难度较高。寻找一种能诱导BMSCs稳定向软骨分化的材料显得尤为重要。
同种异体气管脱细胞基质具有原始的管状结构、天然的细胞生存环境和适宜的力学性能,被认为是最理想的支架材料。有文献报道,脱细胞软骨基质能诱导BMSCs向软骨分化[2-4],BMSCs与气管脱细胞软骨基质复合构建组织工程气管软骨具有较大的可行性。但气管脱细胞基质的组织结构致密,细胞无法在基质内部深入生长,使得构建的气管管壁软骨再生不全,并会随着基质的降解,而导致移植段气管软化塌陷,而使其无法真正用于临床[5-7]。
本研究采用激光打孔技术对气管软骨基质进行激光打孔处理,以增加其孔隙率,再进行脱细胞处理,形成激光打孔脱细胞基质(LDTM)支架材料。随后复合BMSCs并植入兔皮下,拟在兔体内培养12周,以期能成功构建具有较成熟软骨组织形态和一定力学强度的完整的组织工程气管软骨。
1 材料与方法
1.1 实验试剂及仪器
胰蛋白酶(Hyclone公司,美国);低糖DMEM培养基(Hyclone公司,美国);高糖DMEM培养基(Hyclone 公司,美国);胎牛血清(Hyclone 公司,美国);青霉素-链霉素-两性霉素B(Hyclone公司,美国);磷酸盐缓冲液(Hyclone公司,美国);生物力学分析仪(Instron公司,美国),DNA含量检测试剂盒(天根生化科技有限公司),GAG阿尔新蓝法检测试剂盒(生工生物工程股份有限公司);总胶原蛋白检测试剂盒(北京博蕾德生物科技有限公司)。
1.2 实验动物
6周龄新西兰白兔10只(上海甲干生物科技有限公司),体质量约2.5 Kg,雌雄不限。本实验遵守实验动物伦理原则。
1.3 气管基质的获取
清洁条件下切取新西兰兔气管约2.5 cm(约8~10个气管环),仔细剔除多余组织,置入PBS保存液,4℃备用。共5个样本。
1.4 气管基质激光打孔
将上述气管样本表面水分擦干,往管腔插入相应外径的内支撑棒并放置在打孔处。CO2激光打孔机以10 W功率和17 ms的脉冲时间,重复打孔4次。然后将打孔后的样本浸在PBS溶液中,超声波清洗机持续清洗30 min,直到将气管内碳化的组织去除干净。
1.5 激光打孔气管基质进行脱细胞处理
①将样本浸于蒸馏水中,4℃恒温振荡48 h,每12 h更换一次蒸馏水;②4%脱氧胆酸钠(1∶10)4 ℃恒温振荡4 h;③PBS 4℃振荡漂洗1 h,每15 min更换一次 PBS;④酶消化液(1∶10)25 ℃振荡 3 h;⑤PBS 4℃振荡漂洗1 h,每15 min更换一次PBS;⑥循环重复②~⑤步骤,共计循环12次。
1.6 BMSCs的分离培养及扩增
10 mL注射器吸入含肝素的生理盐水2 mL,于实验兔股骨髁处穿刺入股骨髓腔,反复缓慢轻揉冲洗髓腔,获取含BMSCs的混悬液。按BMSCs常规分离培养方法,获得第2代BMSCs备用。
1.7 BMSCs-LDTM复合物体内培养
将第2代BMSCs制备成1.0×108cells/mL的混悬液,均匀接种于支架上,37℃、5%CO2、饱和湿度下放置4 h。5只新西兰大白兔麻醉后,背部剃毛消毒后作3 cm皮肤切口,并且分离皮下组织,于肌肉上层形成一个小腔隙。再将BMSCs-LDTM复合物植入该腔隙中,缝合伤口。术后连续3 d肌注青霉素200万单位预防感染,每天2次。分笼饲养,自由活动。于术后12周取材检测。
1.8 组织学检测
取脱细胞前后标本以及体内培养12周后的标本,大体观察后将标本以4%多聚甲醛固定24 h,脱水、石蜡包埋,切片 (厚度为5 μm),HE染色及Safranin-O染色,观察组织结构及细胞外基质分泌情况。用免疫组织化学的方法检测Ⅱ型胶原(软骨组织特异性细胞外基质)的表达情况,进一步证明构建组织的软骨表型[8]。
1.9 生物力学与生物化学检测
1.9.1 生物力学检测
取脱细胞前后标本及体内培养12周后的标本,剪成0.5 cm×1 cm的小块,置于生物力学分析仪上,沿垂直气管壁方向以1 mm/min的速度压缩,直到样本组织变形。记录力与位移曲线和最大拉断力,并计算杨氏模量。
1.9.2 生物化学检测
将样品置于木瓜蛋白酶溶液(Sigma-Aldrich)中于65℃消化12 h。按试剂盒方法,用阿尔新蓝法检测硫酸化糖胺聚糖(GAG)含量[9]。在乙醇提取和吸附柱吸附后,在洗脱缓冲液中回收基因组DNA。用核酸蛋白质定量检测器(Nanodrop2000)检测DNA含量。用羟脯氨酸测定法检测总胶原含量。通过碱水解制备样品,根据先前描述的方法测定游离羟脯氨酸水解产物[10]。以上所有样品的分析重复3次。
1.1 0 统计学分析
采用 GraphPad Prism 软件(Version 5.00,Graph-Pad Software,美国),数据以(x±s)表示,组间比较采用非配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 气管软骨激光打孔
兔体内的天然气管是表面光滑的瓷白色管状软骨样组织(图1A),而激光打孔后表面形成规则的点阵状排列的微孔结构,且保留原始管状结构(图1B)。
2.2 激光打孔气管基质脱细胞处理
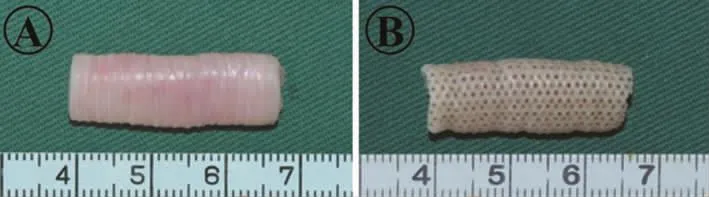
图1 天然气管和激光打孔后的大体观察Fig.1 Gross observation of native trachea and after laser drillin
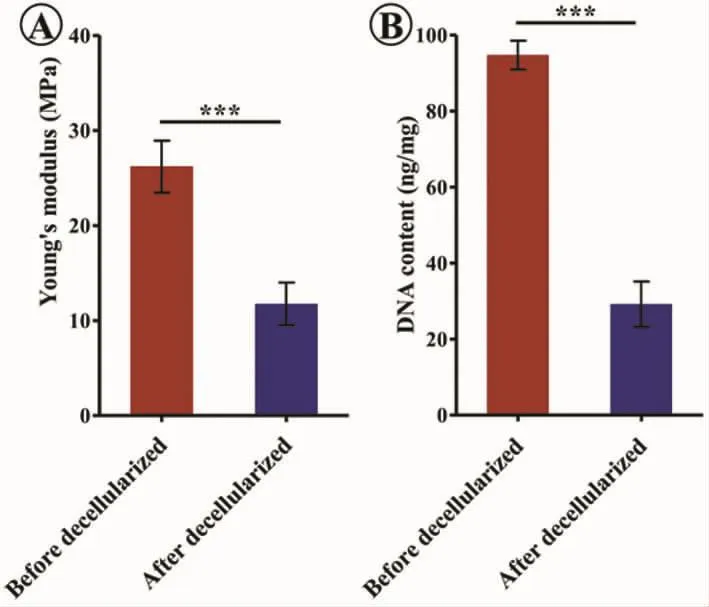
图3 脱细胞前后杨氏模量和DNA残余量对比(P<0.001)Fig.3 Comparison of Young's modulus and DNA content before and after decellularization(P<0.001)
经过脱细胞处理后,气管软骨基质大体基本不g变,且仍能维持其原始的管状结构(图2A、D)。组织学观察显示,软骨陷窝里的细胞成分基本去除 (图2B、C、E、F);DNA 定量检测同样证实脱细胞后比脱细胞前DNA含量明显减少(图3B)。同时,组织学观察显示,脱细胞后气管基质结构出现一定程度松散和破坏(图2E、F);力学测试结果显示脱细胞后气管基质的杨氏模量下降(图3A)。
2.3 BMSCs-LDTM支架复合物体内培养12周
兔体内培养12周后,大体观察显示BMSCs在LDTM支架表面及微孔内均匀分泌基质,并形成新的管状软骨,微孔结构基本上被新生软骨组织填充。该构建的软骨具有明显的瓷白色特征,且具有较好的弹性和韧性(图4A、B)。HE和Safranin-O染色显示,大量软骨细胞外基质和均匀的特异性软骨陷窝形成,Ⅱ型胶原免疫组化进一步证明了所构建的组织为均匀的软骨组织(图4C-F)。组织学显示,新生软骨通过激光微孔完全长入支架内部,并形成完整的整体,且新生的管状软骨保有了原始的气管管状结构。
生物力学(杨氏模量)检测显示,该新生气管软骨具有天然气管类似的力学强度。生物化学(DNA含量、GAG含量和总胶原含量)分析显示新生的软骨均接近天然软骨(P<0.05)(图 5)。
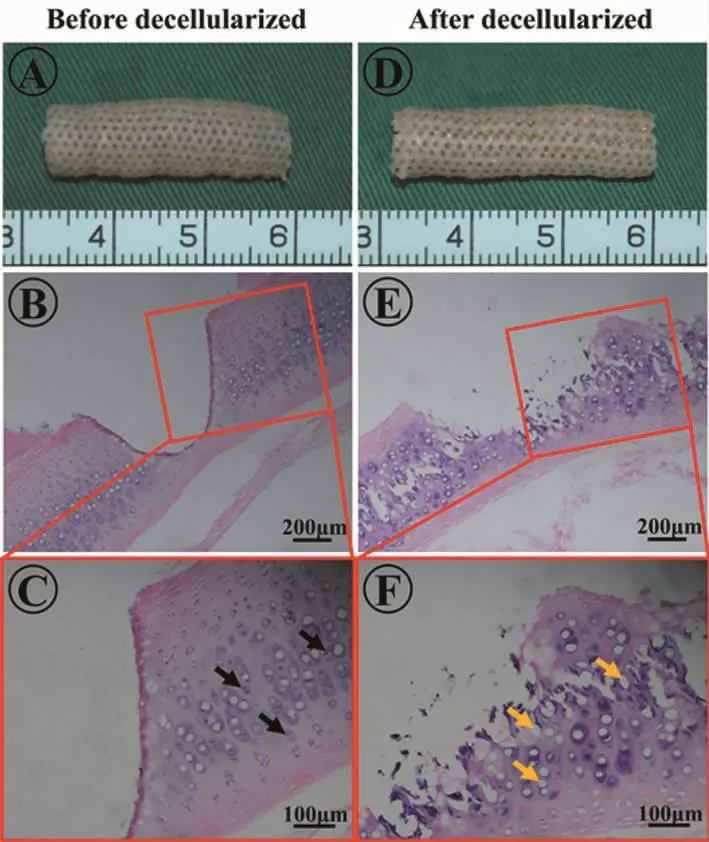
图2 激光打孔气管基质脱细胞前后对比Fig.2 Comparison of laser drilling trachea matrix before and after decellularization
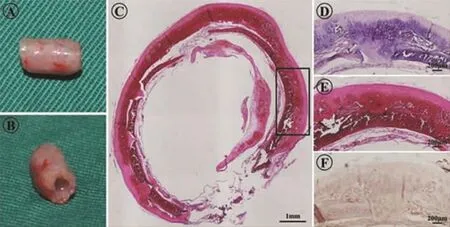
图4 兔体内培养12周的新生气管软骨Fig.4 Engineered trachea cartilage after cultured for 12 weeks in vivo
3 讨论
气管具有重要的生理功能,包括呼吸、咳嗽、清除分泌物等,气管缺损的修复极为困难。组织工程气管被认为是最理想、最符合生理要求的气管替代物。但迄今为止,构建的组织工程气管仍无法真正地应用于临床。
气管脱细胞基质一直被认为是理想的组织工程气管支架材料。本研究将CO2激光打孔技术应用到兔气管基质,以改进其结构致密的缺陷。通过CO2激光打孔技术可以在兔气管基质表面精确地打出点阵状排列的激光微孔,在扩大其孔隙率的同时又能保持其原始的3D管状结构和一定的力学强度。此外,我们设想因为这些微孔的存在,可以增加气管基质与脱细胞液体的接触面积,从而使脱细胞过程更加快速彻底,甚至在接种BMSCs后,这些微孔可以促进营养的渗入,更有利于软骨的再生。
激光打孔的原理是利用激光脉冲束聚焦于材料上,使焦点处的材料因高温而熔化和气化,当脉冲结束后,即可形成圆锥状的微孔。激光束功率越大、作用时间越长,重复次数越多,所得到的激光微孔孔径就越大[11]。如果激光功率过大,作用时间太长,重复次数过多,对气管基质的损伤也越大,甚至破坏气管原有的管状结构和力学强度。如果激光功率太小,作用时间太短,重复次数过少,使得气管基质的孔隙率又太低。为了在保证气管基质完整的3D管状结构和足够力学强度的条件下尽可能增加气管基质的孔隙率,我们对兔气管基质激光打孔参数进行了大量探索。我们认为在10 W的功率、17 ms的脉冲时间和重复打孔4次的情况下,所得到的激光微孔最为理想。
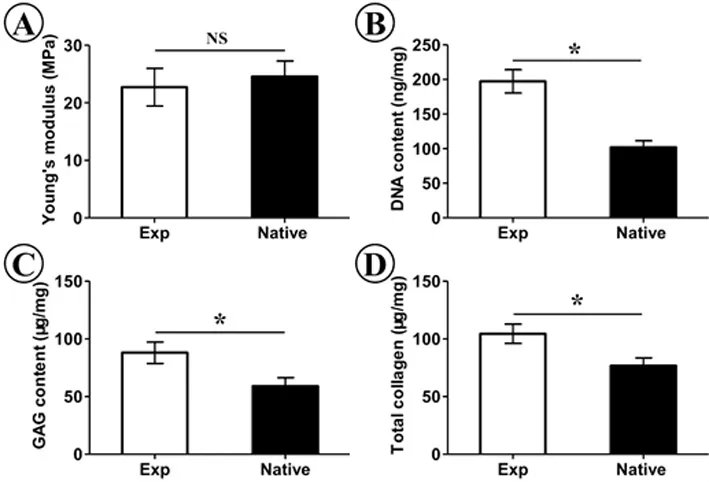
图5 新生气管软骨生物力学和生物化学检测(*:P<0.05)Fig.5 Biomechanical and biochemistry analyses of engineered trachea cartilage(*:P<0.05)
本实验沿用DOA联合核酸酶的方法制备气管脱细胞基质[5,12-13],但这种脱细胞方法应用于气管微孔脱细胞基质制备却是首次,因此需要重新摸索最佳的脱细胞循环次数和最佳的酶消化温度,以制备去除免疫原性且保留一定力学强度的激光微孔脱细胞基质。本实验前期对比了4℃、25℃和37℃的酶消化温度的作用效果,发现在4℃的低温条件下,虽然可以最大程度保护气管基质不受破坏,但是由于该温度下酶消化效率不高,很难将细胞去除干净;而37℃虽然酶消化效率高,但是却对气管基质破坏严重;只有在25℃条件下,才能在保证较高的酶消化效率的同时,又保证气管基质不至于破坏严重。
本研究将BMSCs-LDTM复合物植入兔皮下12周,验证了LDTM体内诱导BMSCs构建软骨的可行性。组织学观察显示,可再生出均质、典型的软骨组织。同时,组织学、软骨特异性基质定量及生物力学结果均显示,兔体内再生软骨组织接近于天然气管。这可能得益于①激光产生的微孔结构,有利于营养交换,又促进了软骨细胞在整个LDTM表面及内部结构的分布,促进了相对均质的软骨再生;②皮下环境丰富的毛细血管系统可为植入组织提供物质交换的动力;③激光微孔脱细胞基质保留软骨的天然成分,如Ⅱ型胶原、糖胺多糖等,为软骨再生提供了理想的微环境,促进了BMSCs向软骨分化[14];④LDTM基于天然材料制备,避免了免疫炎症反应,有利于软骨组织稳定再生;⑤激光微孔脱细胞基质产生了一些生长因子,如转化生长因子β家族、胰岛素生长因子,为软骨分化和成熟提供了促进因子[15-17]。
综上所述,LDTM是一种理想的气管组织工程支架,不仅可解决软骨脱细胞基质结构致密的问题,也可在体内环境诱导BMSCs稳定再生气管软骨。下一步我们将基于该模型探索对长段气管缺损进行修复,以期实现真正意义上的气管功能性修复,并未今后的临床应用奠定基础。
