毛壳菌来源的α-葡聚糖酶酶学性质分析及制糖生产辅料对其活性影响
2019-05-08黎志德梁达奉张九花黄曾慰李雨虹
黎志德,梁达奉*,张九花,黄曾慰,李雨虹
(1广东省生物工程研究所(广州甘蔗糖业研究所) 广东省甘蔗改良与生物炼制重点实验室,广东广州510316;2广东省酶制剂与生物催化工程技术研究中心,广东广州510316)
0 前言
α-葡聚糖酶是一种特异性水解葡聚糖 α-1,6糖苷键的酶。酶促反应终产物包括异麦芽寡糖和少量低聚合度的葡聚糖[1]。在制糖生产中,甘蔗或者甜菜在砍收运输堆放过程中易发生微生物感染并产生葡聚糖,而葡聚糖的出现会对后续生产产生一系列不良影响[2]。传统蔗汁澄清工艺对多糖类物质的清除效率并不高[3],而 α-葡聚糖酶可以有效应对这一问题。目前α-葡聚糖酶在甘蔗亚硫酸法生产耕地白糖[4]、原糖精炼[5]以及甜菜制糖方面均有应用试验报道。此前国内有报道指出,已对朱黄青霉来源的α-葡聚糖酶基因片段进行克隆[6]并在酵母上表达[7],以及对其发酵产物进行进一步纯化和酶学性质分析的研究[8]。此后针对制糖生产的实际条件,在适应已有设备和工艺参数的前提下,对原有的酶制剂提出了更高的要求。本文在此前研究不同基因来源的α-葡聚糖酶基本酶学性质表征的基础上,研究甘蔗制糖生产中常见辅料对其活性的影响,为在实际生产调控时提供理论和实验依据。
1 材料与方法
1.1 试剂与仪器
α-葡聚糖酶冻干粉,聚丙烯酰胺 T1150:广东省生物工程研究所(广州甘蔗糖业研究所);α-葡聚糖:美国SIGMA公司;3,5-二硝基水杨酸:国药集团化学试剂有限公司;柠檬酸,磷酸氢二钠,磷酸,无水亚硫酸钠,氯化钙,氢氧化钠,苯酚,酒石酸钾钠:广州化学试剂厂(均为分析纯)。
DK-S24恒温水浴锅,上海精宏实验设备有限公司;U2800紫外-可见分光光度计,美国Unico公司;FiveEasyTMFE20 pH计电子分析天平,美国梅特勒公司。
α-葡聚糖酶基因序列来源于Chaetomium,广州市微生物所冷冻干燥。
1.2 实验方法
1.2.1 毛壳菌属来源α-葡聚糖酶的酶学性质
1.2.1.1 不同底物分子量对 α-葡聚糖酶反应速率的影响
选取型号 D9260、31387、09184、31392 和 D5376的 α-葡聚糖粉末,其相对分子量分别为 9000~11000、15000~25000、100000、450000~650000、1500000~2800000 g/mol。按质量体积比2.0%加入到柠檬酸-磷酸氢二钠缓冲液(pH 5.5)中,搅拌使之充分溶解,再加入经适当稀释的酶液,测定酶活。以分子量最高的 D5376的测定值为 100%,其余折算成相对酶活。
1.2.1.2 α-葡聚糖酶的最适反应温度
选取pH 5.5,含有2.0% α-葡聚糖D5376的反应底物溶液,加入经适当稀释的酶液,分别在35、45、55、65、75℃下反应10 min,测定酶活,以最高活性的样本为100%,其余折算成相对值。
1.2.1.3 α-葡聚糖酶的最适反应pH
配制0.2 mol/L Na2HPO4溶液,0.1 mol/L柠檬酸溶液作为母液,再分别配制pH 3.0、4.0、5.0、6.0、7.0的柠檬酸-Na2HPO4缓冲液,再按2.0%(m/V)比例加入α-葡聚糖D5376,充分溶解后备用。将经适当稀释的酶液加入到上述底物溶液中,测定酶活。以活性最高的样本为100%,其余折算成相对值。
1.2.1.4 α-葡聚糖酶的最适底物浓度
取 pH 5.5的柠檬酸-磷酸氢二钠缓冲液,按0.5%、1.0%、1.5%、2.0%、2.5%、3.0%和3.5%(m/V)比例加入α-葡聚糖D5376,充分溶解后备用。将经适当稀释的酶液加入到上述底物溶液中,测定酶活,以底物浓度2.0%(m/V)的样本为100%,其余折算成相对值。
1.2.1.5 反应时间对α-葡聚糖酶酶活测定的影响
将 α-葡聚糖酶液稀释至适当倍数,加入到2.0%(m/V)底物溶液中,55℃水浴,分别测定反应时间为 5、10、15、30、45、60、90 min时的酶活,以反应时间为10 min的样本为100%,其他折算成相对酶活。
1.2.2 制糖生产中加入的辅料对α-葡聚糖酶的影响
1.2.2.1 SO32-浓度对α-葡聚糖酶活性的影响
据文献数据[9],制糖工艺中12 mL的硫熏强度相当于向每100 mL溶液里加入2.0 mL浓度为6.0%的H2SO3。现将硫熏强度梯度定为0、9、15、21、30 mL,将最高值样本所含的 SO2折算成等摩尔的Na2SO3,即每100 mL溶液含有0.046 g Na2SO3。取pH 5.5的柠檬酸-磷酸氢二钠缓冲液,分别加入对应量Na2SO3,再调整pH到5.5。最后加入2.0%的α-葡聚糖 D5376充分溶解后备用。加入 Na2SO3的底物溶液与空白底物溶液分别配制成对应硫熏强度的底物溶液,加入经适当稀释的酶液,各组独立空白对照,测定酶活。以空白样本为100%对照,折算成相对酶活。
1.2.2.2 Ca2+浓度对α-葡聚糖酶活性的影响
文献[10]指出,CaO(生石灰)加入到蔗汁后会与蔗糖形成糖化钙。实际生产时,是按0.1%~1.0%的比例将CaO加入到约13%浓度的蔗糖溶液中。现假定钙是完全电离,经折算后选定Ca2+浓度0.05 mol/L作为最高值。取 pH 5.5的柠檬酸-磷酸氢二钠缓冲液,加入CaCl2至0.05 mol/L,待充分溶解后再次将pH调整到 5.5,最后加入 2.0%的 α-葡聚糖 D5376配置成底物溶液。与不含Ca2+的一般底物溶液勾兑成含不同浓度Ca2+的底物溶液,加入经适当稀释的酶液,各组独立空白对照,测定酶活。以不含Ca2+的样本为100%对照,其余折算成相对酶活。
1.2.2.3 P2O5浓度对α-葡聚糖酶活性的影响
甘蔗制糖生产中一般以P2O5来衡量磷酸值,在澄清工段中,蔗汁中 P2O5的残余总量一般不超过500 mg/L[10]。因此选择分析样本的P2O5浓度分别为100、200、300、400、500 mg/L。实验中以相同摩尔数的Na2HPO4代替H3PO4,取 pH 5.5的柠檬酸-磷酸氢二钠缓冲液,加入对应量的Na2HPO4,然后将pH调整到5.5,再加入2.0%的α-葡聚糖D5376,充分溶解后备用。加入经适当稀释的酶液,各留一组空白对照,55℃下测定酶活。以不含P2O5的样本为100%,其余折算成相对酶活。
1.2.2.4 聚丙烯酰胺对α-葡聚糖酶活性的影响
取聚丙烯酰胺(PAM)T1150颗粒充分溶解在pH 5.5柠檬酸-磷酸氢二钠缓冲液中,PAM浓度为0.1%。加入2.0%的α-葡聚糖D5376搅拌使其充分溶解,与空白底物溶液勾兑成不同聚丙烯酰胺浓度。然后各组独立空白对照,测定酶活,各组独立空白对照。以空白样本为100%,其余折算成相对酶活。
1.2.3 主要参数的计算方法
酶活测定按照 3,5-二硝基水杨酸(DNS)法[11],用外标法得到葡萄糖标准曲线:
葡萄糖含量(mg/mL)=A×OD540nm+b。
将 0.1 mL稀释至适当倍数的 α-葡聚糖酶液加入到0.9 mL的底物溶液当中,水浴反应10 min,加入2.0 mL DNS至溶液中反应,沸水浴5 min,定容至20 mL。
测定反应体系的 OD540nm值,按以下公式进行计算:
酶活(U/mL)=(OD540nm-b)/A×稀释倍数×1000/180。
反应以灭活酶液作为空白校准,每次反应前,先将预处理好的酶液进行酶活测定。以起始样本测定所得酶活为100%,然后按百分比折算各个反应后样本的值为剩余酶活。
2 结果与分析
2.1 毛壳菌来源α-葡聚糖酶的酶学性质
2.1.1 底物分子量对α-葡聚糖酶的反应速率的影响
从表1可以观察到α-葡聚糖酶的酶促反应效率受底物的分子量影响。当 α-葡聚糖的分子量小于100000 g/mol时,分子量较高的底物样本单位时间内产生还原端更多,折算后的α-葡聚糖酶活性更高。在分子量大于100000 g/mol区间的数据,经方差分析P=0.085>0.05,即样本间差异并不显著。根据底物分子量减少时酶促反应受分子量的变化趋势判断,用高分子量型号的α-葡聚糖可以使酶活测定受底物降解程度影响更少,数据更稳定。

表1 不同底物分子量对α-葡聚糖酶的反应速率的影响
2.1.2 α-葡聚糖酶的最适反应温度
图 1实验结果表明,α-葡聚糖酶在 55℃到 60℃的区间内酶促反应活性最高且保持平稳。当反应温度下降到45℃或者上升到65℃时,酶的反应速率会下降约一半。温度进一步偏离时,酶活进一步降低,且高温区间下降速度比低温区间要大。考虑到甘蔗制糖生产时压榨工段有较长的停留期以及相对合适的环境温度,还有在高浓度蔗糖条件下,酶的热稳定性也会有明显的增长,α-葡聚糖酶具有在多个工艺位点加入的潜力。
2.1.3 α-葡聚糖酶的最适反应pH
图 2实验结果表明,α-葡聚糖酶具有较好的酸碱度适应性,酶促反应活力最高点在pH 5.5上,而且在pH 4.0~7.0的区间内都有较高的活性,而此范围与鲜榨蔗汁的常见 pH重合。但是当反应环境的pH值低于4.0或者高于pH 7.0时,酶活会大幅度降低。
2.1.4 α-葡聚糖酶的最适底物浓度
图3实验结果表明,当底物α-葡聚糖D5376在缓冲溶液中的浓度达到2.0%(w/V)后,α-葡聚糖酶酶活变化趋于平稳,说明酶与底物的结合位点已经趋于饱和状态,同时高分子量的葡聚糖会提高溶液粘度,不利于反应底物与产物的扩散,反而影响酶促反应的整体效率。可见在确定α-葡聚糖酶添加量时,应该综合考虑葡聚糖含量,物料或样本的成分与性状,反应温度等因素。

图1 α-葡聚糖酶的最适反应温度
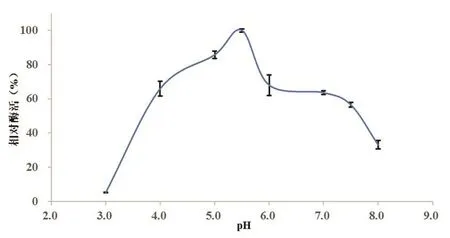
图2 α-葡聚糖酶的最适反应pH

图3 α-葡聚糖酶的最适底物浓度
2.1.5 反应时间对α-葡聚糖酶酶活测定的影响
从图4中可以观察到,取样时间越短测量折算后的酶活就越高,取样时间5 min时折算的酶活比10 min高20%,而90 min则下降60%。此现象说明α-葡聚糖酶活性随着反应时间的延长逐渐衰减。综合各点数据,在pH 5.5和55℃的条件下持续反应1 h,α-葡聚糖酶仍能保持一半以上的相对酶活。因此在实际使用时,若酶加入后有较长的停留时间,可以适当减少其用量。

图4 不同时间取样测得的α-葡聚糖酶活性
2.2 制糖生产中加入的辅料对α-葡聚糖酶的影响
2.2.1 SO2浓度对α-葡聚糖酶活性的影响
图5实验结果表明,溶液中SO32-浓度的增加,对α-葡聚糖酶活性的影响并不明显。与空白对照相比,硫熏强度为9 mL的样本酶活下降约5.3%,SO32-浓度为30 mL样本的酶活下降幅度约14.5%,说明保持反应环境pH稳定,单一SO32-对酶的影响比较轻微。

图5 不同SO2浓度下测得的α-葡聚糖酶活性
2.2.2 Ca2+浓度对α-葡聚糖酶活性的影响
从图6中可以观察到,在控制溶液pH的前提下,酶活随着Ca2+浓度的上升而逐渐降低,但幅度并不大。当Ca2+浓度在最高组的0.05 mg/mL时,酶活的下降幅度也仅为 13.4%。甘蔗制糖生产中,加入生石灰的主要目的是生成亚硫酸钙絮状物和调节pH。由于产生大量游离钙离子的时间很短,对酶产生的实际影响还会进一步减弱。
2.2.3 P2O5浓度对α-葡聚糖酶活性的影响
从图7中可见,在加入的P2O5浓度上升至500 mg/L的过程中,酶活变化范围没有超过 5.3%,可见加入该浓度范围内的P2O5对α-葡聚糖酶活性的影响并不明显。在实验过程中发现,如果直接加入H3PO4后重新调整pH到5.5,底物会发生明显的自然降解,放置时间过程会明显降低酶活的测定值。
2.2.4 聚丙烯酰胺浓度对α-葡聚糖酶活性的影响
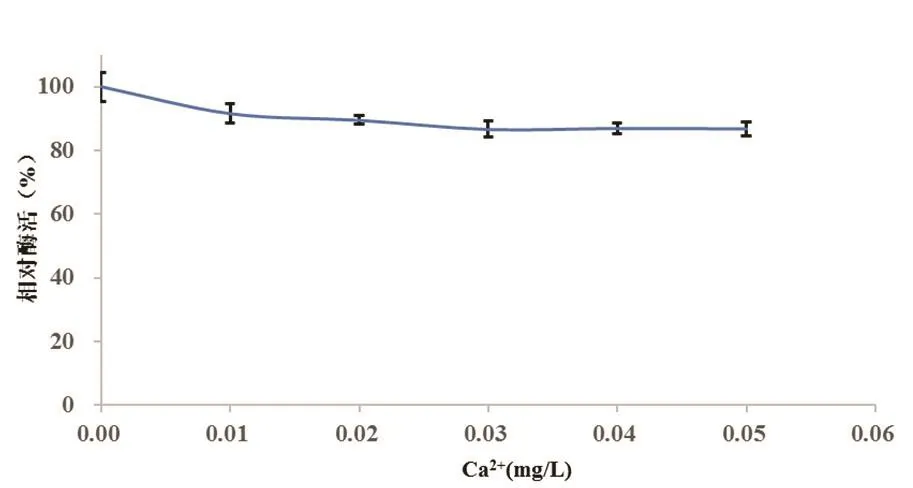
图6 不同Ca2+浓度下测得的α-葡聚糖酶的活性

图7 不同P2O5浓度下测得的α-葡聚糖酶的活性
图8 实验结果表明,聚丙烯酰胺对α-葡聚糖酶的活性影响并不大,不同浓度样本的酶活衰减程度最大不超过 12.1%。同时,底物溶液的粘度随着聚丙烯酰胺浓度的上升而明显加大。
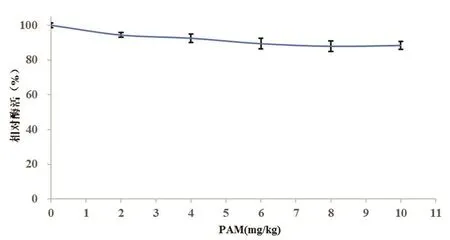
图8 不同PAM浓度下测得的α-葡聚糖酶的活性
3 结论与讨论
经上述研究表明,α-葡聚糖酶的最适反应条件是60℃,pH 5.5,底物浓度为2.0%。制糖生产常见的SO32-,Ca2+,P2O5和聚丙烯酰胺对酶活影响并不明显。在实验中,直接加入H3PO4模拟磷酸值影响测定数据的稳定性和准确性,考虑到惯用的缓冲液体系也含有一定浓度的磷酸盐,这一问题有待进一步实验研究。目前最大的影响因素是 pH和温度,所以酶制剂添加点要避开预灰后和二次加热的高pH和高温环境。实际应用中,若是能够控制反应环境的 pH和温度,或是新研制耐受性更好的酶,那么α-葡聚糖酶在多个位点都有良好的预期效果。
