掺杂CuO微纳米材料及其低温气敏性能的研究*
2019-05-08李思涵胡校兵解丽丽朱志刚
贺 蒙,李思涵,胡校兵,解丽丽,朱志刚
(上海第二工业大学 环境与材料工程学院,上海 201209)
气体传感器是一种能感应到目标气体,并将它的浓度或者含量按照一定的规律转化成可输出的电(或者光)信号的转换器件。目前,应用广泛且技术相对成熟的气敏材料多为n型半导体金属氧化物,如SnO2、ZnO、In2O3等,p型半导体金属氧化物则以禁带宽度仅为1.2 eV的CuO为代表[1]。目前,微纳米氧化铜的制备方法以固相法和液相法为主[2],而本文所用的制备方法为简单的水浴加热法,该方法可以极大地减少能量的损耗,使样品均匀受热成型[3]。
H2S是一种无色、易燃的酸性气体,浓度低时有一股臭鸡蛋味,对眼、呼吸系统及中枢神经系统有损伤;浓度高时,由于人的嗅觉神经被麻痹而没有气味,短时间内吸入少量高浓度H2S会导致死亡[4-5]。H2S气体主要产生于石油炼制、污水处理以及煤矿开采等行业。据美国政府工业卫生学家会议规定,10×10-6是硫化氢气体的极限值(TLV)[6]。因此,迫切需要开发有效的传感装置以在低工作温度下检测低浓度的H2S气体。目前已有研究者们报道了基于CuO的H2S气体传感器,如Kim等人开发的基于Pd功能化CuO一维纳米结构的H2S气体传感器,结果显示其对50×10-6H2S气体的响应值高达167,然而其工作温度高达300 ℃[7]。拉姆吉尔等制备出在室温下对100×10-9~400×10-9的H2S气体有响应的CuO薄膜,发现在低浓度范围内CuO薄膜对H2S的响应是高度可逆的,然而当H2S浓度高于 5×10-6时,响应变得不可逆[8]。牛新书等制备出具有交织和凝聚构象得WO3纳米纤维可以检测10-6级别的H2S气体[9]。郭兰兰等采用静电纺丝的方法制备出的Pt掺杂α-Fe2O3对10×10-6H2S在测试温度为175 ℃时的响应值为157[10]。因此,开发具有高响应、高选择性、快速响应/恢复和低检测下限以及相对较低的工作温度的H2S气体传感器就非常有必要。
本课题组对掺杂CuO已经有了深入研究。胡校兵等用贵金属Pd对纯CuO进行掺杂,发现掺杂1.25 wt% Pd的CuO对10×10-6的H2S气体响应最好,其最佳工作温度为80 ℃[11]。此外,胡校兵等制备出的CuO/CuFe2O4复合材料在120 ℃时对 10×10-6的H2S气体的响应达到了44.8[12]。为了进一步降低敏感元件的测试温度和节约成本,我们选取Au、Ag、Cr等金属元素取代Pd对CuO进行掺杂,研究表明:掺杂后的CuO敏感材料对10×10-6的H2S有良好的响应,特别是当Au掺杂量为1.25wt%时,所制备出的样品对H2S响应性能最佳,工作温度可以下降到40 ℃。最后,我们对不同纳米颗粒掺杂对气敏性能影响的机理做了详细阐述。
1 实验部分
1.1 试剂与原料
主要试剂与原料包括:硝酸铜(Cu(NO3)2·3H2O)、六次甲基四胺(C6H12N4)、氯金酸(HAuCl4)、硝酸银(AgNO3)、硝酸铬(Cr(NO3)3·9H2O)、无水乙醇,均为分析纯,国药集团化学试剂有限公司;实验用水均为超纯水,电阻率为18.2 Ω·cm。其中,硝酸铜为原料,六次甲基四胺为模板剂,氯金酸、硝酸银和硝酸铬为掺杂剂,去离子水和无水乙醇作为溶剂和清洗剂。
1.2 纯CuO以及贵金属掺杂的CuO的制备
将20 mL硝酸铜溶液(0.1 mol/L)和12.62 g 六次甲基四胺的混合,磁力搅拌1 h得到透明的蓝色溶液,将该混合溶液在80 ℃的水浴温度下反应90 min,在此反应过程中,明亮的蓝色氢氧化铜转化成黑褐色的CuO沉淀物。冷却至室温后,在8 000 r/min 的条件下离心三次,期间分别用去离子水和无水乙醇清洗,最后在70 ℃的烘箱中干燥,得到纯CuO 样品。制备贵金属掺杂的CuO时,往上述混合液中分别加入10 mL的氯金酸溶液(1 mmol/L)、9.5 mL的硝酸银溶液(1 mmol/L)和6.8 mL的硝酸铬溶液(5 mmol/L),其余步骤和CuO的合成步骤相同。制备得到掺杂1.25 wt% Au的CuO、掺杂1.25 wt% Ag的CuO和掺杂1.25 wt% Cr的CuO,分别用 1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO。
1.3 测试与表征
采用X射线粉末衍射仪(D8-Advance型,德国Bruker公司生产)扫描样品,扫描区间为20°~80°;采用场发射扫描电子显微镜(FE-SEM,SU8220,日立公司,日本)对样品的形貌进行表征,加速电压为10 kV;金属掺杂的浓度通过电感耦合等离子体发射光谱仪测定(ICP-AES,A-6300,赛摩公司,美国);传感器的气敏性能采用WS-30A气敏测试系统(郑州炜盛科技有限公司),传感器的灵敏度定义为该传感器在空气中的阻值(Ra)与目标气体中的阻值(Rg)的比值(S=Rg/Ra)。
1.4 气敏元件的制备
将产物和去离子水按照4∶1的重量比混合形成糊状物。将糊状物涂覆在陶瓷管上以形成10 μm厚度的敏感膜,然后通过红外干燥。陶瓷管的结构示意图如图1所示。将传感器元件在500 ℃条件下煅烧2 h以除去结合水并在气体传感器的表面形成一层致密的氧化膜。冷却后,将镍-铬电阻丝插入陶瓷管内,焊接完毕后,最后将传感器放置在老化台上,在5.0 V条件下老化7 d待测。

图1 气体传感器的结构示意图
2 结果与讨论
2.1 结构与形貌的表征
采用SEM对纯CuO以及掺杂CuO的形貌进行表征,水浴温度为80 ℃,纯CuO、1.25Ag-CuO、1.25Au-CuO和1.25Cr-CuO 4种样品的显微结构如图2所示。

图2 不同样品的FESEM照片
图2(a)为纯CuO,形貌呈胖橄榄状,尺寸不均匀,粒径范围为2 μm~3 μm。图2(b)为1.25Au-CuO,形貌大部分呈橄榄状,出现纳米片层组成的捧花,直径约为1.5 μm。图2(c)为1.25Ag-CuO,出现比较多的花状形貌,捧花形貌均匀,直径约为2 μm。图2(d)为1.25Cr-CuO,团聚现象很严重,形貌也发生较大改变,呈不规则花状,直径约为2 μm~3 μm。从图中可以看出,样品形貌改变是主要是因为Au、Ag、Cr的成功掺杂,而相貌表现出一定的相似性,是因为底物均是以六次甲基四安为模板剂制备成的氧化铜,而掺杂元素的不同导致在材料形貌上略有差别。
2.2 物相分析
图3为纯CuO、1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO的XRD图谱。纯CuO可以被索引为单斜CuO(PDF卡片编号为48-1548),2θ角分别为32.51°、 35.54°、38.70°、 48.72°、 53.48°、 58.26°、61.52°、66.22° 和 68.12°,对应于单斜CuO的(110)、(002)、(11-1)、(111)、(200)(-202)、(020)和(202)晶面。掺杂不同金属元素的其他3组样品与纯CuO的XRD图谱基本一致,然而放大X射线衍射图案的特定区域(34°~40°),仔细观察就会发现其中的差异。与纯CuO相比,1.25Au-CuO和1.25Ag-CuO的(-111)和(111)晶面向小角度偏移,1.25Cr-CuO样品则向大角度偏移,如图3(b)所示。可以这样解释该现象,Au3+离子半径(85 Å)、Ag+离子半径(126 Å)明显大于Cu2+的离子半径(73 Å),导致Au3+和Ag+离子成功替代Cu2+离子导致晶格膨胀,因此可以确定为Au3+和Ag+成功掺杂进入CuO晶格。与之类似,Cr3+的离子半径(69 Å)比Cu2+的略小,可以导致晶格收缩,造成晶面向大角度偏移,也说明Cr3+成功掺杂进入CuO晶格[13]。同时,我们采用ICP-AES来测定1.25Au-CuO、1.25Ag-CuO 和1.25Cr-CuO 3组样品中金属元素的含量,测试结果表明,3组样品中Au和Cr被有效检测到,其原子百分数分别为0.96 at%和0.63 at%,说明Au和Cr被成功掺杂。

图3 纯CuO、1.25Ag-CuO、1.25Au-CuO和1.25Cr-CuO样品的XRD图谱
2.3 气敏测试
将纯CuO、1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO 4种材料制成气体传感器,考察不同掺杂金属元素对气敏性能的影响。我们首先测试了不同温度下元件对10×10-6H2S的响应,如图4所示。

图4 不同工作温度下传感器对10×10-6 H2S的灵敏度
从图4可以看出,纯CuO的最佳工作温度为100 ℃,1.25Au-CuO、1.25Ag-CuO最佳工作温度为40 ℃,1.25Cr-CuO的最佳工作温度为80 ℃。比较传感器在最佳工作温度下的表现,发现纯CuO的气敏性能较差,响应值仅为4.96;1.25Au-CuO的响应较好,达到128.67;1.25Ag-CuO和1.25Cr-CuO的响应值分别为81.5和20.46。
响应时间和恢复时间是传感器重要的一个指标,快速的响应和恢复才能实现实时监测。因此,我们还测试了工作温度为40 ℃时,元件对10×10-6的H2S气体的响应脱附曲线,如表1所示。对比纯CuO、1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO的响应脱附曲线发现,Cr掺杂CuO的响应时间最短,响应最快;Ag掺杂CuO的响应时间最长,响应最慢。从图 5可以看出,所有样品脱附4 000 s均不能回复到初始值的10%,可以采用一种短电流脉冲来加速H2S分子从CuO表面的分离,从而达到快速恢复。

表1 纯CuO、1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO的响应脱附时间表

图5 纯CuO、1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO传感器的响应-恢复曲线
另外我们还测试了纯CuO、1.25Au-CuO、1.25Ag-CuO 和1.25Cr-CuO气敏元件在40 ℃低温下的选择性、重复性实验。图6(a)是工作温度为40 ℃时,将样品分别暴露于50×10-6的乙醇、氨气、丙酮、NO2、NO、H2以及10×10-6的H2S中,可以发现样品对H2S的响应性能最好,尤其是1.25Au-CuO,灵敏度达到128;图6(b)中是将4种气敏元件暴露于10×10-6的H2S气体中,每种气敏元件进行5次响应/脱附实验,其中脱附采用4.6 V(300 ℃)的脉冲电压,发现所有气件均表现出良好的响应/加热脱附性能,具有较好的重复性。
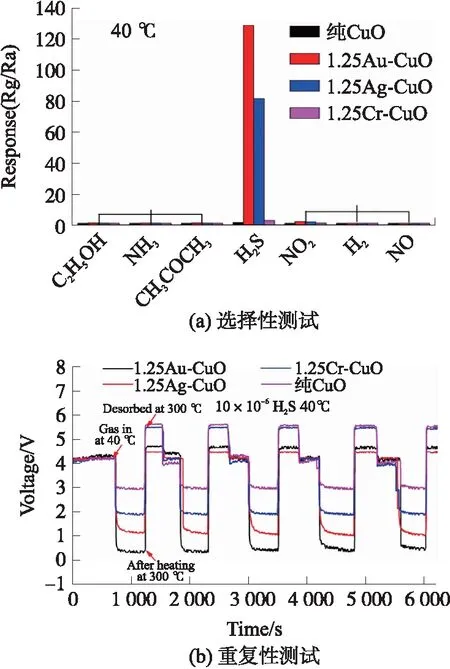
图6 纯CuO、1.25Au-CuO、1.25Ag-CuO和1.25Cr-CuO在工作温度为40 ℃时的选择性和重复性测试
从上面的测试中,综合最佳工作温度、灵敏度、响应脱附时间、选择性和重复性等性能,得到对10×10-6的H2S气体响应性能最好的是1.25Au-CuO传感器。因此,我们对该样品做了进一步的优化测试。我们分析1.25Au-CuO的响应/脱附的V-t及R-t曲线,如图7(a)、7(b)所示,发现1.25Au-CuO传感器的电阻约为0.046 kΩ,当与10×10-6的H2S气体接触后,电阻增加到约5.96 kΩ,根据灵敏度的定义S=Rg/Ra,1.25Au-CuO气敏元件的灵敏度为128。
此外,我们还对样品1.25Au-CuO进行了不同浓度H2S气体的测试,如图8(a)和8(b)所示。我们发现当H2S的浓度低于1×10-6时,传感器的响应与H2S的浓度表现出良好的线性;当H2S浓度高于 1×10-6时,传感器的响应值明显增加。且从传感器对不同浓度H2S对应的响应恢复曲线来看,器件具有良好的连续性;当H2S的浓度为100×10-9时,传感器的响应达到了3.75,由此看来基于Au掺杂的CuO传感器能够检测浓度低至100×10-9的H2S气体。

图7 40 ℃时1.25Au-CuO传感器对10×10-6 H2S的响应恢复曲线和相应的电阻变化曲线

图8 40 ℃时1.25Au-CuO传感器对不同浓度H2S的响应恢复曲线和灵敏度
稳定性也是衡量传感器好坏的重要指标。我们也对样品1.25Au-CuO制成的气体传感器进行了长期稳定性测试,图9为1.25Au-CuO气敏元件在 40 ℃下对10×10-6H2S的灵敏度随着时间的变化图,测试时间为6个周期,每个周期为7 d。结果表明,该传感器在经过35天后仍然具有良好的稳定性,这为气体传感器的实际应用提供了可能性。
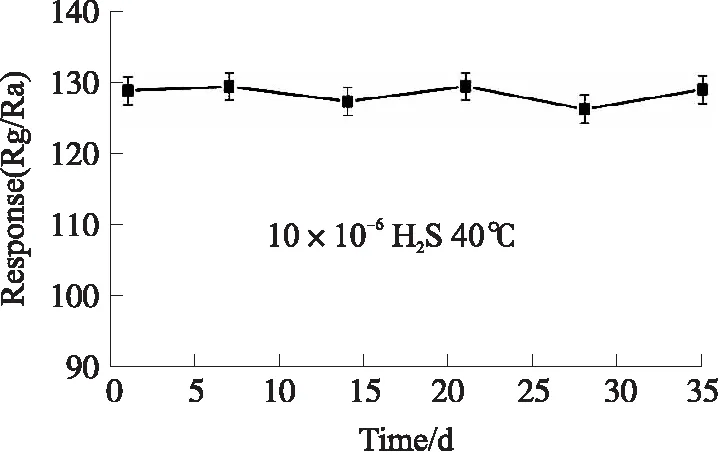
图9 1.25Au-CuO传感器的长期稳定性测试
2.4 敏感机理
纯CuO是一种典型的p型半导体氧化物,它的气敏机理是通过控制载流子的迁移率来改变传感器的电导率[14]。当p型CuO半导体暴露在空气中时,氧分子被吸附在传感器的表面上,被传感材料价带中的电子电离,以形成被吸附的氧离子(O2-,O-,O2-),其反应式如式(1)~式(4)所示。在这个过程中,电子被捕获导致CuO表面的空穴浓度增加,降低了传感器的电阻。一旦传感器暴露于中等温度的H2S(还原气体)气氛中,H2S分子就能够与被吸附的氧离子和释放电子反应[15],如式(5)~式(6)所示。因此,释放的电子将与空穴复合并导致空穴浓度降低。因此,当与H2S气体接触时,CuO基传感器的电阻增加。在恢复过程中,当通过引入空气除去H2S时传感器需要脉冲电压产生短暂高温,用于去除表面形成的CuS,同时自由电子的数量减少。上述机制导致CuO传感器的可逆H2S传感过程[16],使得相同的传感器可重复测试。
O2(gas)→O2(ads)
(1)
(2)
(3)
O-(ads)+e-→O2-(ads)
(4)
(5)
H2S(g)+3O-(ads)→H2O(g)+SO2(g)+3e-
(6)
3 结论
本研究采用简单的水浴法,成功制备出纯CuO及Au、Ag、Cr掺杂CuO的微纳米材料,并制备出相应的气敏元件。测试发现,掺杂1.25 wt% Au的CuO对10×10-6的H2S气敏性能最好,最佳工作温度降低至40 ℃,灵敏度达到128,并具有良好的选择性;此外,该材料的最低检测下限达到100×10-9,具有较好的重复性和长期稳定性,有望制备出低功耗H2S气体传感器。
