不同气干时间大叶榉木材DNA提取及ISSR-PCR扩增方法研究
2019-05-08刘秭攸骆嘉言蒋泽平
刘秭攸,骆嘉言*,蒋泽平
(1.南京林业大学 材料科学与工程学院,江苏 南京 210037;2.江苏省林业科学研究院,江苏 南京 211153)
大叶榉(ZelkovaschneiderianaHand. -Mazz.)又称血榉、榉木、椐木、南榆或榉榆,主要分布在江苏、浙江、安徽、湖南、广西及云南等省区[1].大叶榉是一种传统的家具用材,具有材质坚硬、纹理美观、颜色鲜亮、抗压耐腐等优点,与榉属其他几个种的木材相比,大叶榉品质最好,应用也最为广泛[2].在榉木家具的研究中,常常会将大叶榉与榔榆、欧洲山毛榉等木材混为一谈,榉属几个种之间的区分也不明显,而且明清至民国时期的榉木家具用材与现如今装修所用的榉木是否相同,也存在许多争议[3].
传统的木材鉴别主要利用形态学和解剖学手段,通过实践经验和显微技术结合进行鉴定,而近源物种往往结构相似,难以区分,给准确鉴定带来了困难[4].近年来,木材的DNA分子检测逐渐发展,成为一种新的鉴定手段,但是目前关于木材分子水平的鉴定案例并不多见,主要是因为木材中的DNA难以提取,尤其在经过加工处理后更难提取.如何有效地从木材中提取足量并可用于PCR扩增的DNA成为当务之急.此外,对于不同的树种、不同的保存时间、不同取样部位的木材,适用的DNA提取方法也不尽相同[5].王英等[6]利用CTAB法、CTAB-SDS法和试剂盒法对3种楠木进行了DNA提取,并进行了PCR扩增;Asif 等[7]利用CTAB法、Qiagen试剂盒和PTB法分别对气干的拉敏白木(Gonystylusbancanus)和未知材种的已加工木材进行DNA提取,发现只有PTB法可以提取出合格的DNA;余敏等[8]对比了3种DNA提取方法,发现改良的CTAB法对于气干黄檀属木材边材有较好的DNA提取效果,但心材DNA只有PTB法可以提出;Watanabe等[9]使用Qiagen试剂盒提出了不同树龄、不同采伐年限的日本柳杉(Cryptomeriajaponica)的残余DNA,并用于qPCR扩增;刘金良等[10]针对进口的6类针叶木木材,选出了适合的CTAB-SDS-磁珠相结合的DNA提取和纯化体系.木材本身DNA的降解程度和DNA提取的方法,决定了提取的木材的DNA的数量和质量.
目前对大叶榉DNA提取方法的研究,样品主要是叶片,对木材的DNA提取研究较少.而要从分子层面对大叶榉木制品进行鉴定鉴别,所得样品往往是已经采伐加工过的气干木材,采伐后的使用或存储年限有长有短,适用于叶片的DNA提取方法用于木材无法取得良好的提取效果.因此,针对大叶榉采伐后不同时间保存的气干材,进行DNA的提取和ISSR引物的PCR扩增,笔者采用了6种DNA提取方法,对比选出最适合大叶榉木材DNA提取的方法,对木材DNA的提取方法以及从分子层面进行木材鉴定提供一定参考.
1 材料与方法
1.1 材料与试剂
实验所用材料为大叶榉小枝材和标本心材,新鲜叶片(仅用于引物筛选)详见表1.所有木材样品采集后不做任何处理,立即放入-80 ℃冰箱保存.直到提取DNA时再进行消毒除菌,具体为去除树皮,切除木材表层并用冷冻的70%乙醇浸泡2 min,而后迅速用无菌水冲洗,无菌纸擦干,木材组织切片机切成40 ~ 70 μm厚的碎片,最后放入液氮预冷的密封容器中备用.

表1 实验用材信息
实验所用试剂如下:2%十六烷基三甲基溴化铵(CTAB)缓冲液(Solarbio,纯度>99.0%),20%十二烷基硫酸钠(SDS)缓冲液(Solarbio),0.5 M EDTA(Solarbio,pH 8.0),1 M Tris-HCl(Solarbio,pH 8.0),7.5 M 醋酸铵(阿拉丁,纯度AR),0.1M 苯甲酰溴(PTB)(电询,纯度>98.0%),酚/氯仿/异戊醇(25∶24∶1)(北京天根生化),氯仿/异戊醇(24∶1)(北京天根生化),β-巯基乙醇(Sigma-Aldrich,纯度>99.0%),异丙醇(Kermel,纯度AR),70%乙醇(众望),TE缓冲(Solarbio,pH 8.0),RNase(Solarbio,100 mg·mL-1),植物基因组DNA提取试剂盒(北京庄盟生物),新型快速植物基因组DNA提取试剂盒(上海瑞杰生物),50×TAE电泳缓冲液(Solarbio),无菌水(蒸馏水高压高温灭菌),蛋白酶K(Solarbio,20 mg·mL-1),琼脂粉(Biowest).
1.2 实验方法
1.2.1 大叶榉木材DNA的提取
实验共采用6种DNA提取方法,CTAB法、SDS法、CTAB-SDS法、两种试剂盒法(试剂盒1:植物基因组DNA提取试剂盒;试剂盒2:新型快速植物基因组DNA提取试剂盒)和PTB法对大叶榉木材残余DNA进行提取,详见表2.其中,PTB法仅对B1和B2样本进行DNA提取.提取前用液氮将叶片或木材碎片充分研磨成粉末.

表2 6种DNA提取方法的步骤
1.2.2 ISSR引物筛选
从大叶榉新鲜树叶中提取DNA,用来进行ISSR引物筛选.从52个ISSR引物中筛选出27个具有条带的引物,详见表3及图1.其中,引物818,828,836主条带清晰明亮,片段长度大于1 000 bp,稳定性好,选用于后续木材PCR扩增的检测.
1.2.3 PCR扩增
分别以各样品提取的基因组DNA为模板,用上述ISSR 引物中的828和836号引物进行PCR扩增,反应体系(20 μL):DNA模板(稀释至约50 ng·μL-1),1 μL;ISSR引物(10 mmol·L-1),1 μL;10×Taq buffer(含 Mg2+),2 μL;dNTP mixture(10 mmol·L-1),2 μL;Taq DNA 聚合酶(2.5U·μL-1),0.4 μL;无菌水,14 μL.反应程序:94 ℃预变性5 min,94 ℃变性30 s,退火30 s,72 ℃延伸80 s,循环30次,72 ℃终延伸7 min. PCR产物用5×loading buffer染色后进行凝胶电泳.
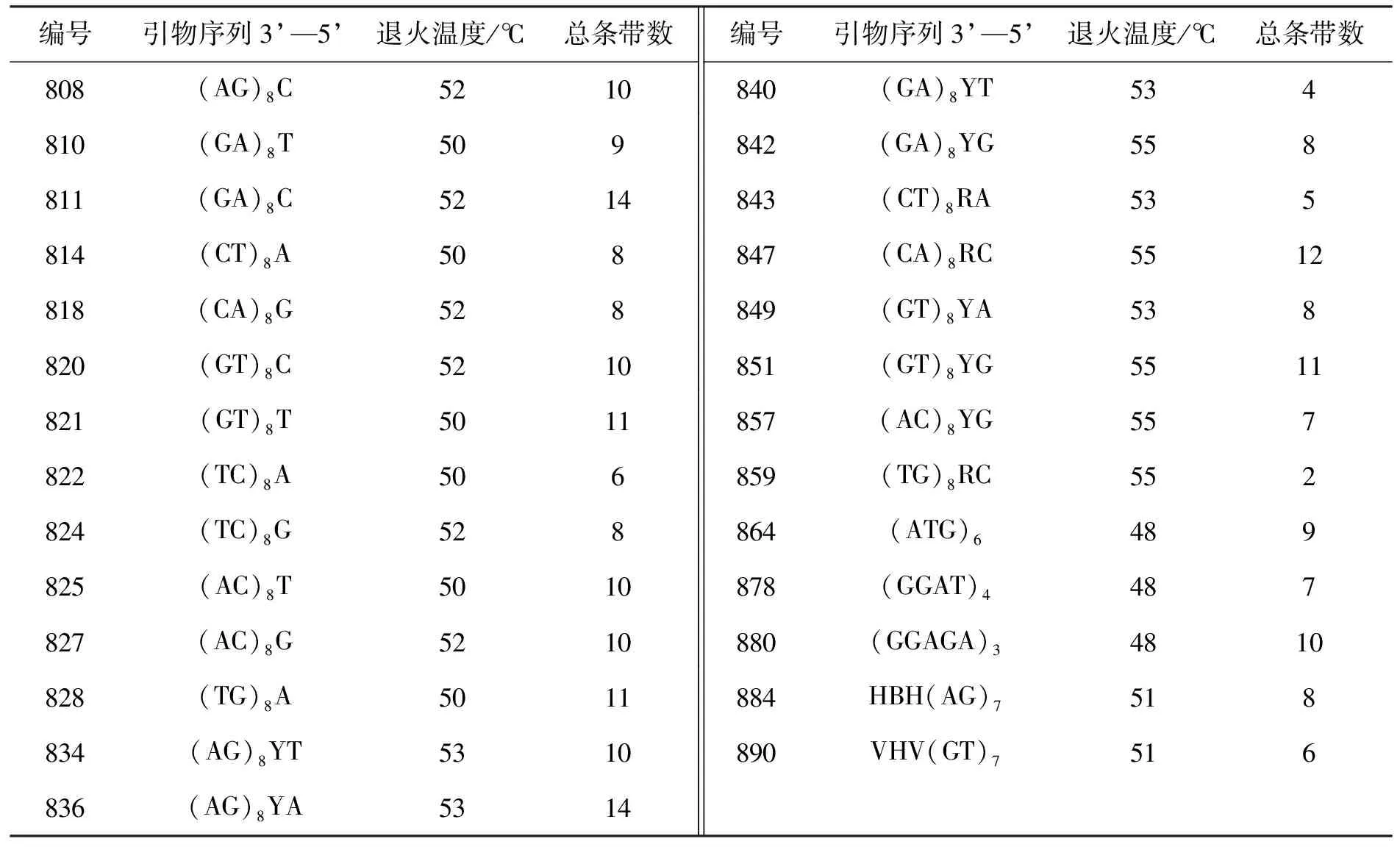
表3 27条ISSR引物及其扩增结果
注:R=(A , G) ,Y=(C , T) ,B=(C , G, T) ,H=(A , C , T), V=(A , C , G).

图1 27条引物ISSR-PCR 扩增电泳图
1.2.4 DNA浓度和纯度检测
用NanoDrop3000光度计测定DNA质量和数量,测定DNA的OD260/280值和浓度.同时使用琼脂糖凝胶电泳检测DNA的量和降解程度,凝胶中琼脂糖浓度1.2%,上样量6 μL,使用marker DL2502与样品对比,电泳缓冲液为 1×TAE,电压200 V,电泳25 min.电泳结束后放入GenoSens凝胶成像系统中观察拍照.
2 结果与分析
2.1 不同方法提取的木材DNA的浓度和纯度
对于提取的基因组DNA,当OD260/280值在1.7 ~ 1.9之间时,DNA质量好、纯度高,RNA、蛋白质、多糖及酚类等杂质含量少,能够进行PCR扩增.杂质的存在会影响紫外分光光度计测量DNA浓度的准确度,当测得的OD260/280值不在1.7 ~ 1.9范围时,DNA浓度值往往不准确[11].此外,杂质中的PCR抑制物会影响PCR的正常扩增,如果无法进行PCR扩增,则说明DNA提取失败.基因组DNA中杂质的来源,除了木材本身含有的,还有提取过程中由于温度变化发生的副反应,使得还原性糖和蛋白质之间交联,阻止了DNA的释放,产生了更多PCR抑制物[12].
6种不同DNA提取方法提取不同气干时间木材样本的DNA,所提DNA的浓度和质量列于表6.
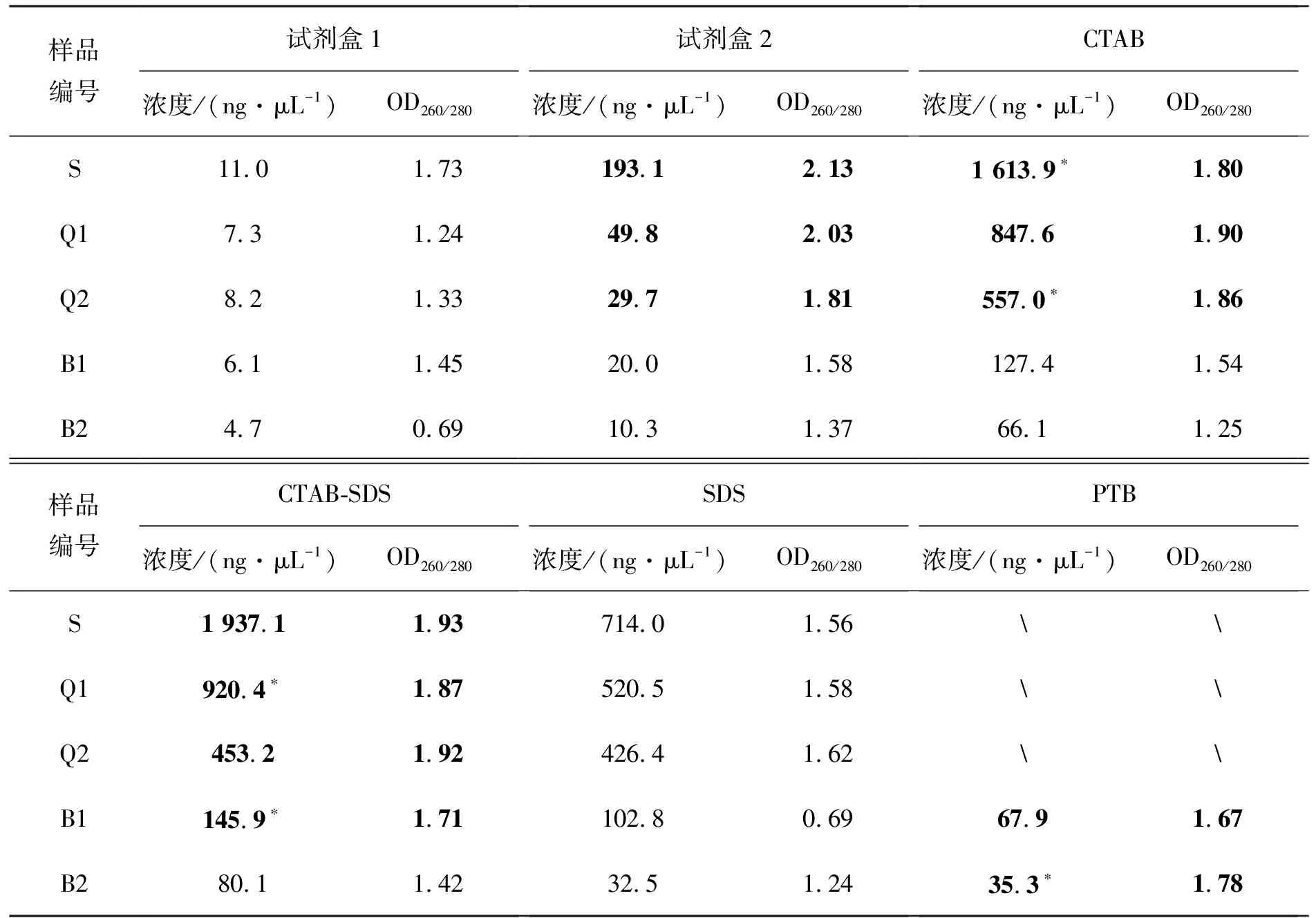
表4 6 种 DNA 提取方法提取不同气干时间木材的 DNA 的浓度和质量
注:加粗项可进行PCR扩增,*标项为2.2使用样品.
通过实验数据可以看出,不论哪种提取方法,随着气干时间的延长,可提取的DNA的量逐渐减少.CTAB法和CTAB-SDS法在提取木材样本时,提出的DNA数量充足,浓度相对其他方法高;对于S、Q1和Q2,提取的DNA纯度很好,能够进行PCR扩增,但是B1和B2 OD260/280值低,只有CTAB-SDS法提取出的4年样本可以进行PCR扩增.SDS法提取各样的浓度虽然高,但OD260/280值在1.60以下,不能进行PCR扩增.SDS能够解聚细胞中的核蛋白,与蛋白质形成复合物,从而造成蛋白质沉淀,但是对于多糖和酚类物质的去除效果不佳[13].酚类物质经氧化后易与DNA共价结合引起褐变,使DNA失活.CTAB-SDS法在提取过程中,上清液表层漂浮一层白色蛋白质层,而CTAB法与SDS法相比则没有,可能是SDS与小分子蛋白质的结合物,比重轻于CTAB上清液从而无法沉淀,吸取上清液时要避开该层;SDS法提取过程中,这类蛋白质悬浮于上清液中难以离心分离,造成一定蛋白质残留.PTB法被用于考古生物材料的DNA提取,对于DNA分子比一般DNA提取方法更敏感,能显著提高DNA提取的数量[14].PTB法在提取DNA时,由于提取时间跨度大,产生许多杂质,必须经过额外的纯化处理,处理后纯度得到提高,但分子较小的DNA同时也被洗脱,浓度低,只有PTB法成功提取出了长期气干样品的DNA.试剂盒提取时,受试剂盒条件限制,使用的木粉原料少,两种试剂盒法提出的DNA数量远少于后三者.试剂盒2法提取的各种DNA浓度远高于试剂盒1法,试剂盒1法所提的DNA浓度低,OD260/280值低,不适合进行大叶榉木材DNA的提取.试剂盒法2提出的DNA数量充足,S与Q1的OD260/280值大于2.0,有RNA杂质残余,但是并不影响PCR扩增,试剂盒2法可用于1 a内的气干大叶榉木材的DNA提取.
当提取的基因组DNA数量多、质量好时,基因组DNA电泳图条带明亮清晰,丰度高、数量充足时甚至有出带现象;拖尾现象则表明DNA存在弥散降解[15].图2为6种方法提取木材DNA基因组的电泳图.
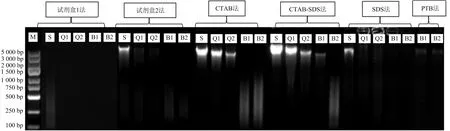
图2 6种方法提取木材DNA基因组DNA电泳图
由图2可以看出,随着气干时间的延长,木材中所能提取出的DNA的量逐步减少,条带变暗,丰度降低.6种方法提取的DNA均存在不同程度的降解,片段范围从100 bp至5 000 bp以上.出现明显条带的基因组DNA才能进行PCR扩增,仅仅只有弥散分布的DNA或没有任何荧光反应的,则无法扩增.对于1 a内大叶榉气干材,CTAB法和CTAB-SDS法的基因组DNA电泳图丰度最高,存在少量DNA弥散分布;对于2~4 a和长期气干的木材,所有方法提出的DNA丰度都低,荧光反应微弱或无,且大多呈弥散分布.
2.2 不同气干时间木材DNA的PCR扩增
从6种方法提取出的大叶榉木材DNA中,选出每种气干时间质量最优的DNA,无菌水稀释后进行ISSR-PCR扩增,引物为818,828,836,扩增结束后进行凝胶电泳分析,结果如图3所示.ISSR引物属于非特异性引物,具有很好的随机性,可以同时扩增多个位点,形成多种不同长度的扩增产物[16].
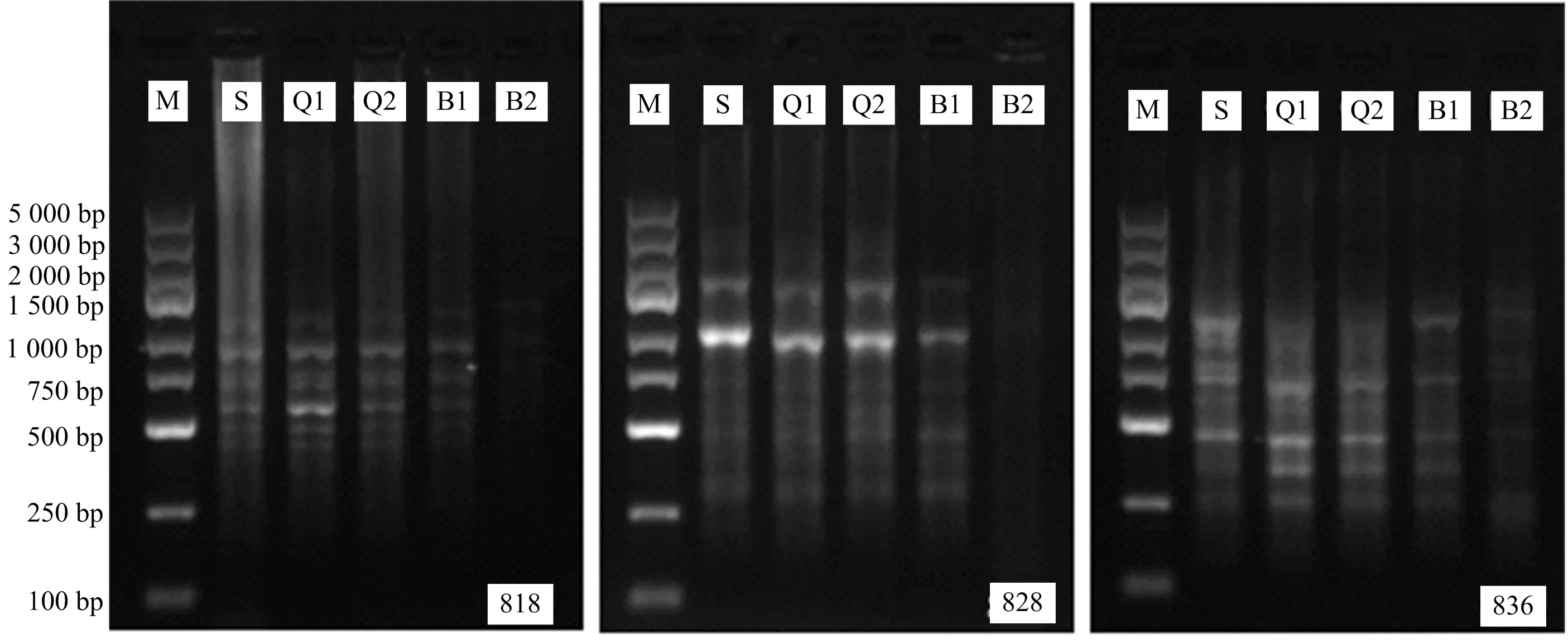
图3 不同气干材ISSR-PCR扩增比较
由图3可知,木材DNA片段随时间变化会有不同程度的降解,出现DNA总量减少,DNA大分子链断裂,小分子片段增多的现象.在ISSR-PCR扩增过程中,除了模板DNA的长度,Taq酶和延伸时间也会影响扩增产物片段的长度[17],实验所用酶的合成效率为1~2 kb·min-1.引物818扩增出的片段分布在300 ~ 1 300 bp之间,引物828在250 ~ 2 000 bp之间,引物836在250 ~ 1 500 bp之间.S、Q1和Q2扩增出的条带明亮,与叶片扩增产物相比没有缺失;B1相对暗淡,可能是因为DNA模板的浓度低、质量差、含有相对更高含量的PCR抑制物造成的.B2条带最暗,由于PTB法纯化过程中洗去了许多分子片段,818只在750 ~ 1 500 bp扩增出了3条条带,其余条带未见;828呈弥散分布,未扩增出条带;836在500 ~ 1 500 bp及1 500 bp以上扩增出了4条条带,说明引物836对B2的DNA模板最敏感,其重复序列和锚定碱基在B2的DNA模板上随机性最高.
3 讨论与结论
木材的形成是具有分生能力的形成层细胞程序性死亡的过程,细胞核皱缩,DNA被核酸酶分解成片段.木质化完成时,木材中占绝大多数的木纤维和导管分子已经不含遗传物质,其中含有质粒的细胞器也溶解消失,只在存活时间较长的薄壁组织和木射线中会含有少量的DNA[18].在大叶榉木材细胞中,薄壁组织含量较低,木射线含量较多,但两者占所有木材细胞的比例不到一半,DNA含量不高.新鲜的木材中,心边材的薄壁组织和木射线均具有活性,尤其是边材还含有较多的细胞核,随着气干时间的延长,细胞死亡,DNA进一步降解,此时,木射线较轴向薄壁组织含有更多的残余的DNA[19].木材中DNA的量少,且随着气干时间的延长持续降解,提取也越加困难.
木材的DNA含量远远少于树木的其他组织,但木材的内含物丰富,尤其是心材,使得影响DNA提取的杂质含量相对其他组织较高.为了能够有效去除这些杂质,在木材细胞研磨和裂解过程中添加β-巯基乙醇和PVP来抑制酚类氧化,增加氯仿-异戊醇的抽提次数来除去多糖和蛋白质[20].大叶榉属于多糖、酚类物质含量较高的树种,这两种物质会影响DNA的释放和纯化[21],木材中多糖相对叶片较少,但酚类物质相对较多.此外,大叶榉木材采伐后,随气干时间的延长,其心材材色会因氧化反应越加偏红,其中的单宁、色素等物质进一步积累增多,给DNA的提取和PCR扩增进一步带来了影响.相对于叶片提取,笔者实验中适当延长了木材细胞的裂解时间,使得残余的DNA得以充分释放,尽可能地提高了DNA的产量.为了保证DNA纯净,实验过程中在每次抽提时,都会加入适量β-巯基乙醇,以防止酚类物质使DNA失活褐变;最终回收上清液中DNA时,使用DNA吸附柱来确保DNA与多糖等杂质的进一步分离,防止离心时未除尽的杂质与DNA一同沉淀,而后再用酒精冲洗.
在分子层面鉴别木材,一般使用DNA分子标记和DNA条形码两种手段,侧重于评估分子标记或者条形码在鉴别时的引物通用性、序列质量和物种鉴定能力等[22-23].DNA分子标记简单、快速、易于自动化,通过指纹图谱反应物种的特异性,笔者实验中利用ISSR分子标记进行PCR扩增.ISSR分子标记技术已较为成熟,其稳定性好,多态性高,可以有效揭示林木种群间及种群内的遗传多样性,并且对DNA质量要求较低,适用于木材中提取的DNA[24].实验中发现,就PCR成功率而言,引物818,828,836适用于大叶榉木材DNA的提取,其他引物虽然在扩增叶片提取的DNA时,PCR成功率较高,可对于木材DNA则难以扩增成功,这主要受DNA质量、片段长度、锚定碱基在DNA模板的重复率以及酶对引物的敏感程度的影响.实验中发现,受到木材DNA降解的影响,一些能从新鲜木材DNA中扩增出的条带位点,随着木材气干时间的延长而无法扩增,条带相比叶片扩增的指纹图谱有较多缺失,这给构建稳定的指纹图谱带来难度.
通过6种DNA提取方法对不同气干时间的大叶榉木材DNA进行提取及ISSR-PCR扩增的结果比较,可以得出以下结论:
(1) 对不同气干时间的大叶榉木材可以使用不同的DNA提取方法,气干1 a之内的可使用新型快速植物基因组DNA提取试剂盒,气干4 a之内的可以使用CTAB-SDS法,而长期气干的只能使用PTB法;
(2) 6种DNA提取方法中,CTAB-SDS法提取浓度最高,质量最好,其次是CTAB法,普通植物基因组DNA提取试剂盒提取效果最差;
(3) 随着气干时间的延长,大叶榉木材可提出的DNA越来越少,质量也随之下降,但4 a内可提出的DNA分子片段的长度,至少达到1 500 bp;
(4) ISSR引物818,828,836可扩增出丰度好、片段超过1 000 bp的大叶榉DNA片段,对于已经降解的大叶榉木材DNA,引物836最为合适,扩增出的DNA分子片段最长接近1 500 bp.
