脑脊液α-突触核蛋白和SWI在早期帕金森病诊断中的价值
2019-05-08焦淑洁刘亚玲朱红灿滕军放
焦淑洁 刘亚玲 朱红灿 滕军放
郑州大学第一附属医院神经内科,河南 郑州 450052
帕金森病(Parkinson’s disease,PD)是一种以黑质致密部多巴胺能神经元和蓝斑部去甲肾上腺素能神经元丢失及路易小体形成为特征的神经变性疾病。目前,PD的诊断主要依赖患者的病史、临床表现及体格检查,不容易早期诊断[1-5]。在帕金森病以往的神经生化和组织生化研究中发现,处于病变过程的不同时期,其主要病变部位的化学成分变化不同[4,6-12]。因此,如何在多巴胺能神经元尚存活时,即帕金森病的早期能够明确诊断,已成为目前帕金森病研究的热点之一[5-8,13-22]。近年来随着磁共振成像技术的发展,弥散张量成像(diffusion tensor imaging,DTI)、磁敏感加权成像(susceptibility weighted imaging,SWI)等新技术应用于临床,有可能发现帕金森病患者早期影像学改变[4,9-12,23-28],从而有助于帕金森病患者的早期诊断。
1 对象与方法
1.1对象(1)PD组:收集郑州大学第一附属医院2015-08—2017-12确诊的PD 患者,男32例,女20例,年龄53~72(59.38±7.99)岁。入组标准:(1)符合2015-10国际运动障碍协会(MDS)公布的帕金森病最新临床诊断标准;(2)能够配合影像学磁共振检查;(3)能够配合各种量表评估。排除标准:(1)有明确脑血管病、感染中毒史、外伤及特殊药物服用史,由上述原因所致的帕金森综合征;(2)有小脑损害症状及体征、锥体束征、眼球运动障碍等神经系统定位体征,或明确诊断为帕金森叠加综合征;(3)严重认知功能障碍,而锥体外系症状不典型者;(4)合并严重内科疾患,包括心功能不全、肝肾衰竭等;(5)有精神疾病史,长期或滥用抗精神病药物。记录所有PD患者的病程、UDPRS-Ⅲ评分、根据Hoehn&Yahr分级,PD患者又分为早期30例,中期10例,晚期12例。由两名经验丰富的神经内科副主任医师以上职称医生临床诊断。(2)健康对照组:同一时期内招募年龄及性别与PD组相匹配的健康志愿者47例,无神经系统症状及定位体征,无其他神经系统疾病史,无严重内科疾患,无精神疾病史,头颅MRI检查无异常。
1.2脑脊液α-突触核蛋白检测征得所有入组患者知情同意后,对其行腰椎穿刺术留取脑脊液标本,收集于聚丙烯管中,提取10 min内以2 000 g离心10 min,随后将上清液储存于-80 ℃。采用酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)试剂盒检测脑脊液α-突触核蛋白。
1.3MRI扫描所有患者及健康对照组均选用Simens 3.0T磁共振成像系统进行图像采集,采用20-通道头颈联合线圈。检查时头部给予泡沫垫固定,以尽量减少运动伪影。所有入组患者及健康对照组均同时行头颅横断位T1WI、T2WI和SWI成像检查。经T1WI、T2WI序列成像检查发现颅内异常者排除出本研究。具体扫描参数:T1WI:TR/TE=2 000 ms/9 ms,slice thickness 6 mm,slice gap 1.2 mm,FOV 240 mm×240 mm,矩阵 320×320;T2WI:TR/TE=5 000 ms/117 ms,slice thickness 6 mm,slice gap 1.2 mm,FOV 240 mm×240 mm,矩阵320×320;SWI:TR/TE=27 ms/20 ms,slice thickness 1.5 mm,slice gap 0.3 mm,FOV 220 mm×220 mm,矩阵256×256。
1.3.1 常规MRI图像评估:所有MRI图像均由两名富有经验并且互不知情的影像科医生独立阅片。
1.3.2 图像处理及评价指标:在SWI校正相位图上以镜像对称方式选择感兴趣区(苍白球内侧部、尾状核、黑质等),由两位经验丰富的影像科医师各自完成对核团的辨认,并分别测量其相位值。每位医师对其所选的感兴趣区测量3次,取3次的平均值作为最终测量值。
1.4统计学分析采用SPSS 20.0统计软件进行数据分析,PD组与对照组不同部位比较采用两独立样本t检验,组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1研究对象一般资料PD组与健康对照组一般资料比较采用χ2检验,差异无统计学意义(P>0.05)。见表1。
2.2PD组与健康对照组脑脊液α-突触核蛋白比较采用ELISA方法检测,PD组脑脊液中α-突触核蛋白水平低于对照组,中晚期PD组脑脊液中α-突触核蛋白水平低于早期PD组,差异有统计学意义(P<0.01)。见表2。
2.3SWI结果分析SWI图像分析发现,由于不同核团铁沉积量不同,导致信号强度明显不同。健康对照组基底节区及中脑黑质、红核的校正相位图,各核团形态饱满,而PD组与对照组比较,灰质核团信号明显降低,提示有异常铁沉积(图1)。
通过测定PD组与对照组组各感兴趣区相位值发现,PD组均有所升高,提示有较多的铁沉积。PD组与健康对照组的苍白球、尾状核头和黑质脑铁沉积比较,差异有统计学意义(P<0.05),而早期PD组与中晚期PD组比较差异无统计学意义(P>0.05);双侧壳核和红核铁沉积比较,PD组与对照组差异有统计学意义(P<0.05),早期PD组与中晚期PD组各感兴趣区铁沉积差异无统计学意义(P>0.05)。见表3。
3 讨论
一直以来,脑组织的黑质多巴胺能神经元变性缺失,残存的神经元出现路易小体,是确诊帕金森病的金标准[29-35]。组织病理学研究显示,α-突触核蛋白是路易小体的主要成分,α-突触核蛋白是由140个氨基酸组成的小分子蛋白质,正常生理情况下形成稳定的α螺旋结构[36-44]。帕金森病患者神经元胞质内线粒体功能缺陷、氧化应激,α-突触核蛋白突变破坏形成β折叠,发生异常聚集、沉积,并产生具有神经毒性的寡聚体,发生神经变性及功能失调,导致帕金森病的发生[13-16,45-52]。因此,若在外周血、脑脊液等体液中检测到α-突触核蛋白,可能为早期诊断帕金森病提供重要线索,是目前帕金森病研究热点之一[17-18,53-66]。本研究显示,PD患者脑脊液α-突触核蛋白含量明显低于健康对照组(P<0.01),中晚期PD组与早期PD相比,α-突触核蛋白含量亦明显减低(P<0.01),与ABBASI等[19]研究相符。α-突触核蛋白聚集具有神经毒性作用,同时也影响突触功能和信号传递,在PD的发病和发展过程中发挥作用[20-24,67-72]。本研究提示,PD不同阶段患者脑脊液α-突触核蛋白含量不同,为早期诊断PD提供了新的思路。
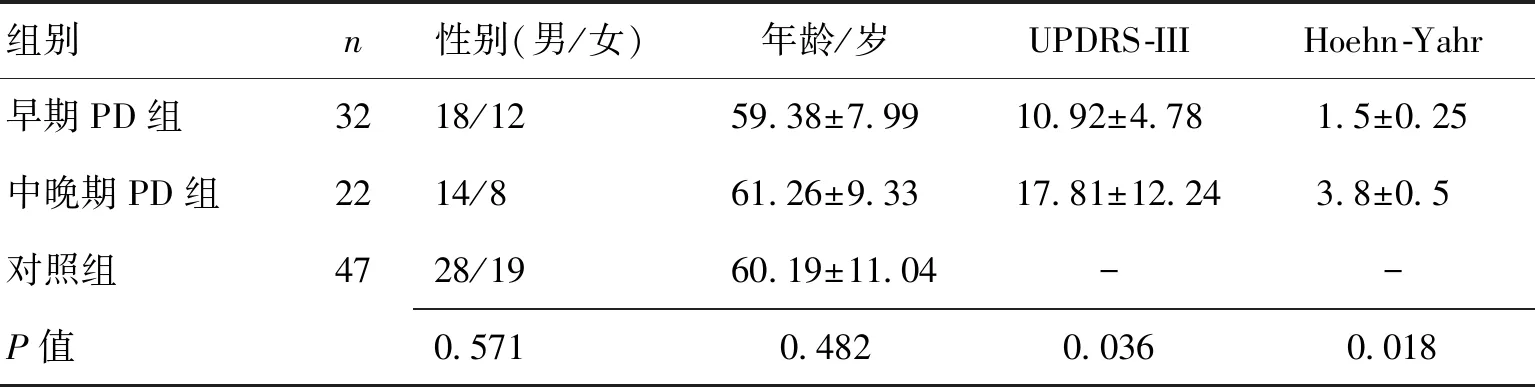
表1 PD组与健康对照组一般情况比较
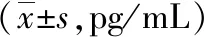
表2 PD组与健康对照组脑脊液α-突触核蛋白测定
注:与对照组相比,*P<0.01;与早期PD组相比,#P<0.01
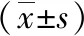
表3 PD各组别及正常对照组各感兴趣区平均相位值比较
注:与对照组相比,*P<0.05,※P>0.05;与早期PD组相比,*P>0.05
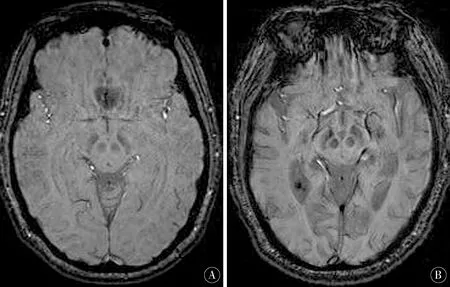
图1 A:对照组SWI中脑黑质红核;B:PD组SWI中脑黑质红核Figure 1 A:The substantia nigra red nucleus of SWI in the control group;B:Brain substantia nigra of SWI in the PD group
帕金森病是一种神经变性疾病,黑质是帕金森病神经元变性的关键部位,尸检及组织病理学研究均发现帕金森病患者黑质内有铁异常沉积,提示铁异常沉积可能参与了帕金森病的发病过程[73-80]。磁敏感加权成像通过测量相位值间接反映了脑铁含量,因此可以进一步研究铁异常沉积在帕金森病中的作用[25-29]。本研究中PD组患者大部分感兴趣区的相位值均低于健康对照组,说明PD组中多个部位均有铁的异常沉积,在黑质、苍白球和尾状核差异有统计学意义(P<0.05)。而依据H-Y分级将PD组分为早期、中晚期,统计学分析提示2组相位值差异无统计学意义(P>0.05),说明SWI通过CP值反映脑内异常铁沉积,可用于PD的诊断[30-34],有助于PD发生机制的研究,但对于疾病分期意义不大[35-39]。
由于帕金森病的复杂性和患者所处的环境不同,选用单一标记物或某种影像学检查很难明确诊断和监测疾病发展的全过程。因此,在帕金森病的不同阶段,采用多种检测方法相结合的方式(如疾病早期影像学检查与生物学指标相结合)[40-45],有助于明确诊断帕金森病和动态监测疾病的进程。
