煤层气中甲烷/氮气分离用椰壳活性炭的制备
2019-05-08张进华曲思建李兰廷李雪飞李艳芳李小亮
张进华,曲思建,李兰廷,王 鹏,李雪飞,李艳芳,李小亮
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083; 2.煤炭科学技术研究院有限公司 煤化工分院,北京 100013; 3.煤炭资源高效开采与洁净利用国家重点实验室,北京 100013; 4.煤基节能环保炭材料北京市重点实验室,北京 100013)
近年来,温室效应所带来的环境问题日益严重,国家也提出了更高的节能减排要求[1]。CO2和CH4是主要的温室气体,其中CH4温室效应是CO2的21倍,是重要的温室效应气体来源;我国煤矿在井下开采过程中,抽采的大量中低浓度煤层气被直接排空,由于其中含有大量CH4,不仅造成恶劣环境影响,由于CH4还是重要的化工原料和清洁燃料,同时产生巨大的能源浪费。中低浓度煤层气利用率较低,主要在于煤层气中甲烷浓度低,不能满足工业和民用对气源的浓度要求[2-3]。由此,近年来,煤层气中CH4的浓缩提纯成为国内外关注的热点[4-8]。
煤层气中主要的气体成分是CH4,N2,O2和少量CO2,脱碳除氧工艺较成熟,所以CH4的提纯难点在于CH4/N2混合体系的分离。针对CH4/N2混合体系分离的技术,目前主要有低温深冷分离[9]、变压吸附分离[10]、膜分离[11]和气体水合物分离[12]等技术。其中,变压吸附分离技术因其工艺简单、自动化程度高、能耗较低等优点,目前在气体分离领域得到广泛的推广应用[13-17]。吸附剂是变压吸附分离技术的核心,目前工业上常用的气体吸附材料主要包括炭材料[18-19]和沸石分子筛[20],另外介孔硅基材料和金属有机骨架化合物(MOFs)也开始受到广泛关注[21-22]。ZHANG等[23]以无烟煤为原料,采用碳沉积工艺制备出分离性能优异的碳分子筛(CMS-2),分离比达到8.62,但对甲烷的吸附量仅有0.99 mmol/g。刘海庆等[24]对ZSM-5沸石的吸附平衡、吸附动力学和真空变压吸附分离进行了理论和实验研究,结果表明ZSM-5对甲烷具有较好的选择性,通过真空变压吸附工艺可将模拟煤层气中20%的甲烷提高至31%~41%,回收率为93%~98%。辜敏等[25]以重庆烟煤为原料,采用炭化-活化-气相沉积工艺制备了变压吸附浓缩 CH4用成型炭,样品分离系数达到3.1,甲烷饱和吸附量达到2.39 mmol/g。在煤层气(CH4/N2体系)分离时,由于CH4,N2均属于非极性气体,且分子直径接近,现有吸附剂均存在分离效率低、吸附量小,导致吸附剂用量大,循环吸附过程能耗较高等关键问题,亟需开发出吸附容量大、分离系数高的高性能吸附剂。
笔者选取海南文昌椰壳炭化料为原料,采用物理活化法工艺制备CH4/N2分离用活性炭(AC)。详细研究不同活化工艺参数对吸附剂分离性能的影响,并对活性炭的孔结构进行表征,最后获得最佳制备工艺参数,明晰不同活化工艺参数的影响规律,开发出分离性能优异的炭质吸附剂。
1 实验部分
1.1 实验原料
实验原料采用我国海南省文昌县所产椰壳炭化料,其工业分析和元素分析见表1;成型黏结剂为高温煤焦油和相关助剂,所用煤焦油分析数据见表2;表征用气体甲烷(高纯99.999%),氮气(高纯99.999%)购于北京氧利来有限公司。
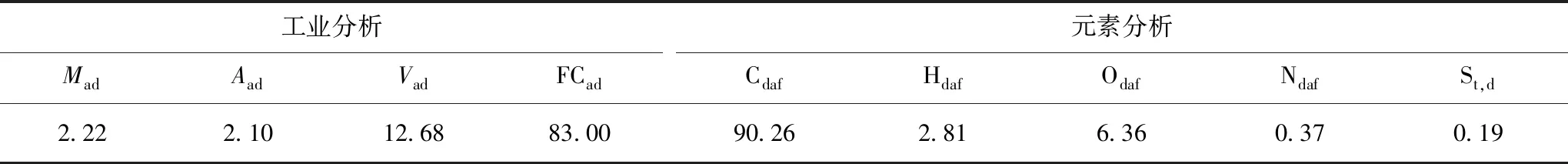
表1 原料工业分析和元素分析Table 1 Proximate and ultimate analysis of raw material%

表2 煤焦油的性质Table 2 Attribute of coal tar
1.2 吸附剂的制备
所购椰壳炭化料原料破碎至2~6 mm,经球磨机研磨至95%过400目标准筛网(0.037 mm)。将炭粉、煤焦油、水按质量比100∶30∶10充分混合后,在捏合机里混捏均匀,将混合料装填至四柱液压机成型模具内并在25 MPa的压力下挤压成型,产出料条为直径4 mm,长度不等的圆柱生料。该成型方法制备料条强度较高,表面光滑。生料条经自然风干后剪切至长度10~30 mm不同长度的圆柱颗粒。
制备活性炭的方法基本可以概括为炭化法,气体活化法,碳沉积法[26]。本文采用水蒸气物理活化法制备椰壳活性炭;炭化和活化过程在电加热管式炉中进行,装置示意如图1所示。炭化过程以N2作为保护气,体积流量为200 mL/min;炭化过程升温速率5 ℃/min,炭化终温650 ℃,炭化恒温时间60 min;活化过程每次进样200 g炭化料,然后分别在不同活化条件下活化制备。辜敏等[25]以烟煤为原料,炭化-活化-气相沉积工艺制备了CH4分离用成型炭,适宜活化温度800~900 ℃,适宜活化时间1~2 h。本研究采用椰壳为原料,椰壳反应性较好,易产生发达微孔,且省略气相碳沉积步骤,因此需缩短活化时间。综合考虑活化条件为:活化温度(650~950 ℃)、活化时间(10~40 min)、水蒸气流速(1.5~3.0 kg/h)。
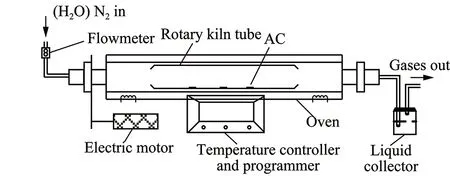
图1 活性炭炭化-活化制备实验装置Fig.1 Sketch diagram of the carbonization-activation unit
1.3 吸附剂性能的表征
采用常压热重分析仪(STA 409 PG,Netzsch)对原料进行热重分析。样品质量为10~20 mg,采用N2气氛,温度范围30~1 000 ℃,升温速率5 ℃/min。
采用高压电子天平(Cahn Thermax500,Thermo Fisher Scientific Inc)重量法测定了298 K下0~1.0 MPa下CH4,N2在活性炭样品上的吸附平衡等温线。采用Langmuir方程对吸附等温线数据进行拟合计算,经线性拟合可获得相应的饱和吸附量VS和吸附特征参数b,按式(1)计算活性炭吸附剂对CH4/N2的平衡分离系数,评价吸附剂分离性能的优劣。平衡分离系数α定义[27-28]如下:
(1)
式中,α为平衡分离系数;VS为吸附剂单分子层饱和吸附量,mmol/g;b为 Langmuir 常数。
采用全自动比表面积及微孔分析仪(Autosorb-1,QuantaChrome)测定活性炭在77 K下的氮气吸脱附等温线,测试压力范围P/P0=10-7~1。采用多点BET法和密度泛函理论(DFT)分析吸脱附等温线计算活性炭的比表面积和孔结构参数。
在自行研制的四塔变压吸附实验装置[29]上对吸附剂进行CH4/N2分离性能测试。装置PLC程序设计为5个步骤:① 均压;② 吸附;③ 顺向减压;④ 逆向减压;⑤ 抽真空。吸附压力为0.6 MPa(表压),吸附时间为210 s,均压时间30 s。采用钢瓶气配制不同浓度CH4/N2混合气模拟预处理后煤层气。进出口CH4浓度采用红外分析仪自动记录。
2 结果与讨论
2.1 炭化过程分析
原料在N2气氛下的TG和DTG曲线如图2所示,TG曲线可以看出料条在500 ℃开始失重明显,600 ℃时,料条的质量分数为95%,表明炭化料原料炭化较为充分,大部分挥发分已经热解析出。图2中DTG曲线可看出,在50~100和500~700 ℃存在2个明显的失重峰,分别对应热解过程中的干燥脱水阶段和分解缩聚阶段,炭化料最大质量变化速率对应在温度600 ℃。因此,后期二次炭化,采用600 ℃炭化,可保证挥发性气体和焦油的析出。

图2 原料氮气气氛下的TG和DTG曲线Fig.2 TG and DTG curves of raw material in N2 atmosphere
2.2 活化过程分析
在炭化过程及前期成型条件固定的条件下,详细考察了活化工艺参数对活性炭吸附分离性能的影响,采用单因素变量实验研究不同活化温度、水蒸气流量、活化时间对CH4/N2吸附分离性能的影响。
2.2.1活化温度对吸附分离性能的影响
为了单独考察活化温度的影响,将水蒸气流量和活化时间分别控制在2 kg/h,40 min。图3,4分别为不同活化温度条件制备活性炭样品在0~1.0 MPa下对甲烷和氮气的变压吸附等温线。比较图3,4中不同温度条件曲线可以看出,随着活化温度的增加,甲烷和氮气的吸附量均呈逐步递增趋势。观察纵坐标吸附量,可见活化温度为650~750 ℃时吸附量较小,整体抬升不明显,当活化温度升至850 ℃,吸附曲线有了显著的抬升,进一步提高活化温度,吸附曲线虽有所抬升,但并不显著。针对每一条吸附曲线,可看出随着吸附压力的增加,饱和吸附量在0.1 MPa有显著的升高,之后缓慢增加趋于平缓。
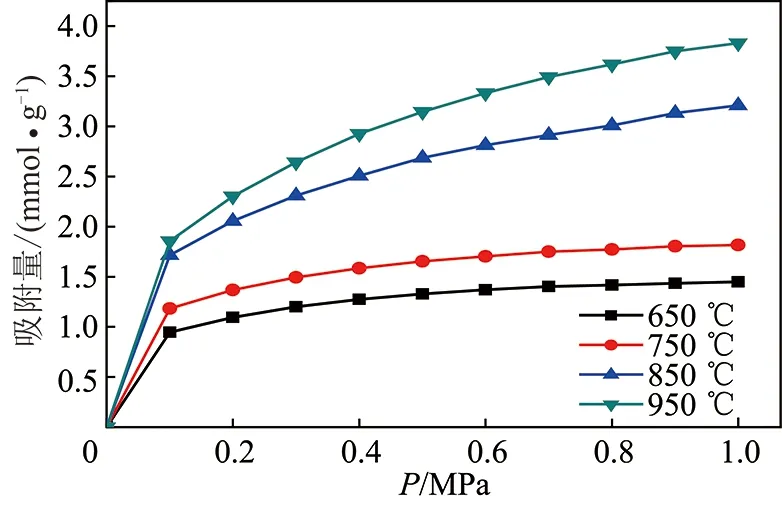
图3 298 K下不同活化温度制备样品甲烷变压吸附曲线Fig.3 Methane PSA curves of samples prepared at different temperatures at 298 K

图4 298 K下不同温度制备样品氮气变压吸附曲线Fig.4 Nitrogen PSA curves of samples prepared at different temperatures at 298 K
从图3,4可以看出:不同活化温度条件下制备得活性炭样品对甲烷、氮气的变压吸附曲线均属于国际理论与应用化学协会(IUPAC)规定的典型I型吸附等温线,即在低压下出现吸附拐点,之后吸附量趋于平稳,出现吸附平台。这说明实验压力范围内的气体吸附符合单分子层吸附机理。采用Langmuir方程对实验数据线性拟合,线性相关系数均大于0.95,表明CH4,N2在样品上的吸附可以采用Langmuir方程来描述分析。拟合结果见表3,表3可看出两种气体在不同活性炭样品上的饱和吸附量(VS)、Langmuir常数(b)及对应的平衡分离系数(α(CH4/N2))。
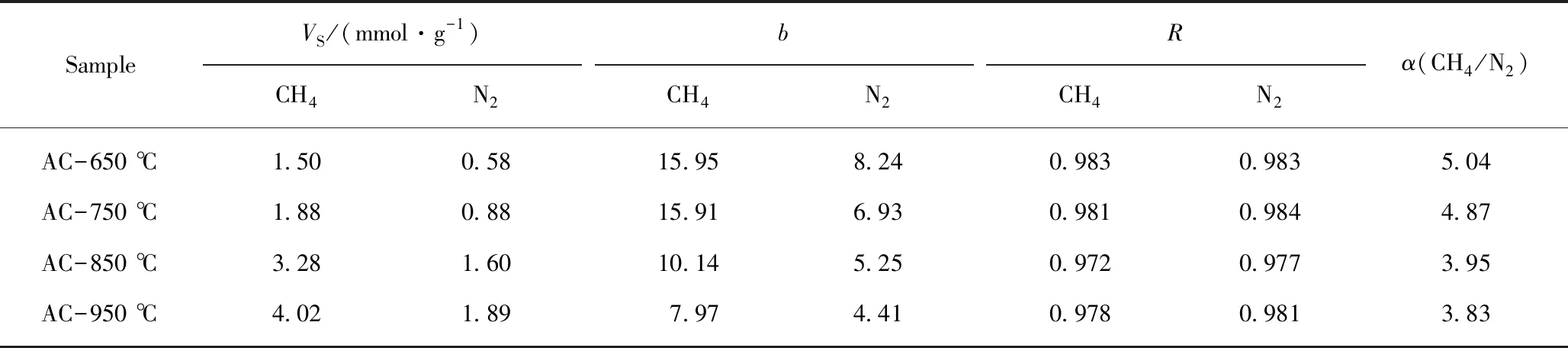
表3 Langmuir方程对不同温度条件制备样品的吸附等温线拟合数据及CH4/N2平衡分离系数Table 3 Langmuir equation fitting data of adsorption isotherms for samples prepared at different temperatures and CH4/N2 equilibrium separation coefficient
吸附剂的分离性能的评价常从2个方面进行考虑:混合气体中不同组分之间的分离选择性和对气体的吸附容量大小[30]。分离系数的大小间接表明吸附剂样品分离混合组分的能力,分离系数越大,表明分离性能越好。本文采用应用较多的平衡分离系数作为判断分离性能的主要依据。
从表3可以看出活性炭样品对CH4/N2混合气体的平衡分离系数随着活化温度的增加逐渐减小,当活化温度达到950 ℃时,平衡分离系数降低至3.83。在变压吸附中,一般认为当CH4/N2的平衡分离系数达到2时,就能够满足气体分离要求,当分离系数达到3时,变压吸附过程具有经济可行性[31],这说明850 ℃和950 ℃条件下制备的样品依然具有较好分离效果。表3同时可看出样品对CH4,N2饱和吸附量的变化,饱和吸附量均随着活化温度的增加逐步递增,在650 ℃及750 ℃条件下活化,吸附容量较低。这说明活化温度过低,不利于水蒸气与炭的水煤气反应发生,尚未发育出较多的有效微孔孔隙;在850 ℃活化,吸附容量显著增加,表明在850 ℃条件下活化,参加活化反应的活化分子数增加,有利于碳反应,活化速度明显加快,促进孔隙的发育形成,形成微孔较多,从而吸附量显著增加;升高温度至950 ℃,吸附量进一步增加,表明活化更加激烈,但增加缓慢,这可能因为微孔增加的同时,部分微孔转化为中孔或大孔,因而总孔容增加缓慢。由于吸附容量决定了吸附效率及变压吸附装置中吸附剂的用量,因此综合考虑活化温度宜在850 ℃。
2.2.2水蒸气流量对吸附分离性能的影响
为了单独考察水蒸气流量的影响,将活化温度和活化时间分别控制在850 ℃,40 min。图5,6分别为不同水蒸气流量条件下制备样品的甲烷和氮气变压吸附曲线。从图5,6中可以看出,随着水蒸气流量的增加,0~1.0 MPa下甲烷和氮气的吸附曲线均呈先整体升高后降低的趋势,其中样品AC-2.5 kg/h样品吸附曲线最高,吸附能力最强;由曲线抬升高度可看出影响强度,甲烷变压吸附曲线抬升幅度大于氮气变压吸附曲线表明不同水蒸气流量对甲烷吸附量的影响明显大于氮气。
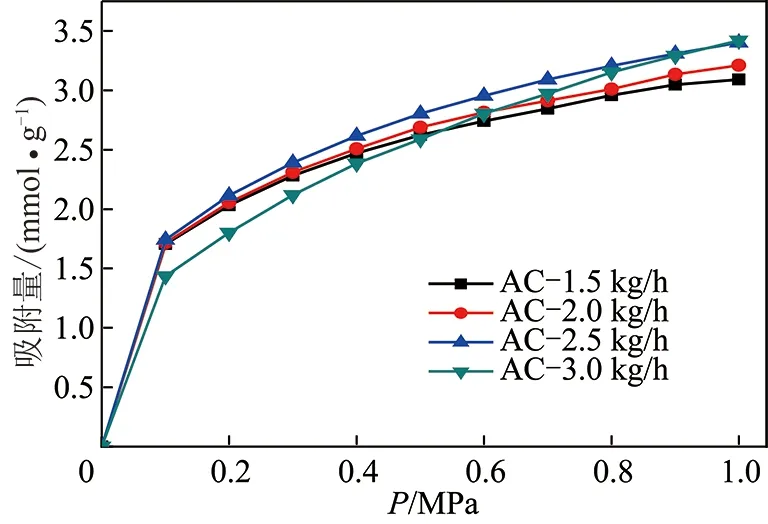
图5 298 K下不同水蒸气流量制备样品甲烷变压吸附曲线Fig.5 Methane PSA curves of samples prepared at different steam flow rates at 298 K

图6 298 K下不同水蒸气流量制备样品氮气变压吸附曲线Fig.6 Nitrogen PSA curves of samples prepared at different steam flow rates at 298 K
观察图5和6可以看出:不同水蒸气流量条件下制备得样品对甲烷、氮气的变压吸附曲线均属于典型I型吸附等温线;因此亦采用Langmuir方程对吸附等温线数据进行线性回归拟合,线性相关系数R均大于0.97,拟合结果见表4。

表4 Langmuir方程对不同水蒸气流量制备样品吸附等温线拟合数据及CH4/N2平衡分离系数Table 4 Langmuir equation fitting data of adsorption isotherms for samples prepared at different steam flow rates and CH4/N2 equilibrium separation coefficient
由表4可以看出CH4/N2平衡分离系数随着水蒸气流量的增加呈先增加后减小的趋势,当水蒸气流量为2.0 kg/h时,平衡分离系数α达到最大值,达到3.95;之后随着水蒸气流量进一步增加,平衡分离系数α迅速降低,当水蒸气流量达到3 kg/h时,平衡分离系数α仅有3.43。结合图5和6曲线,样品对两种气体的平衡吸附容量亦呈先增加后减小的趋势,吸附容量在水蒸气流量为2.5 kg/h的达到最大。
出现这种现象的原因可能是:柱状椰壳炭化料在二次炭化过程中,由于焦油物质的析出和分解,大量孔隙被挥发出的无定形碳充填或阻塞;活化起始阶段,当水蒸气流量较小时,随着水蒸气的通入,堵塞孔隙的焦油物质和无序碳首先被除去,打开封闭的孔隙,同时基本微晶石墨层中的一部分炭与水蒸气反应,形成新的孔隙。因此,在水蒸气流量较小时,合适CH4/N2分离的微孔逐渐形成,分离比和吸附量均呈增加的趋势,但是当水蒸气流量大于2 kg/h时,分离比开始降低,当水蒸气流量大于2.5 kg/h时,吸附量急剧降低,这可能因为水蒸气流量过大造成的,水蒸气活化反应过度,导致产生的合适微孔被活化扩孔,孔径范围变大,从而不适合气体的分离。经分析水蒸气流量应该控制在2.5 kg/h以内,结合水蒸汽流量对平衡分离系数的影响,优先考虑平衡分离系数的作用,建议水蒸汽流量为2.0 kg/h。
2.2.3活化时间对吸附分离性能的影响
为了单独考察活化时间的影响,将活化温度和水蒸气流量分别控制在850 ℃,2.0 kg/h。CH4,N2在不同活化时间条件下制备的样品上0~1 MPa下的变压吸附曲线如图7,8所示。由图7,8可看出随着活化时间的延长,活性炭对甲烷和氮气的吸附曲线均抬升明显,表明吸附量逐渐增大,对比图7和8观察吸附量可看出活化时间对甲烷吸附的影响大于氮气吸附的影响。

图7 298 K下不同活化时间制备样品甲烷变压吸附曲线Fig.7 Methane PSA curves of samples prepared at different times at 298 K
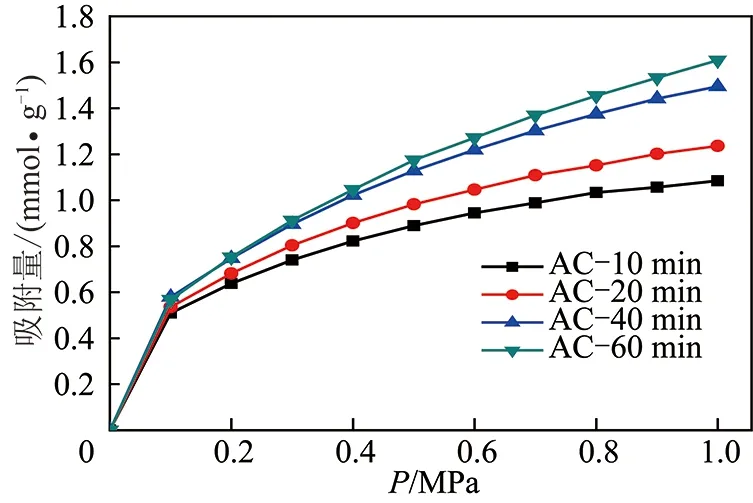
图8 298 K下不同活化时间制备样品氮气变压吸附曲线Fig.8 Nitrogen PSA curves of samples prepared at different times at 298 K
对图7和8吸附曲线采用Langmuir方程进行拟合,线性相关系数均大于0.97,说明此拟合方法可行,符合Langmuir方程理论前提假设。拟合结果见表5。
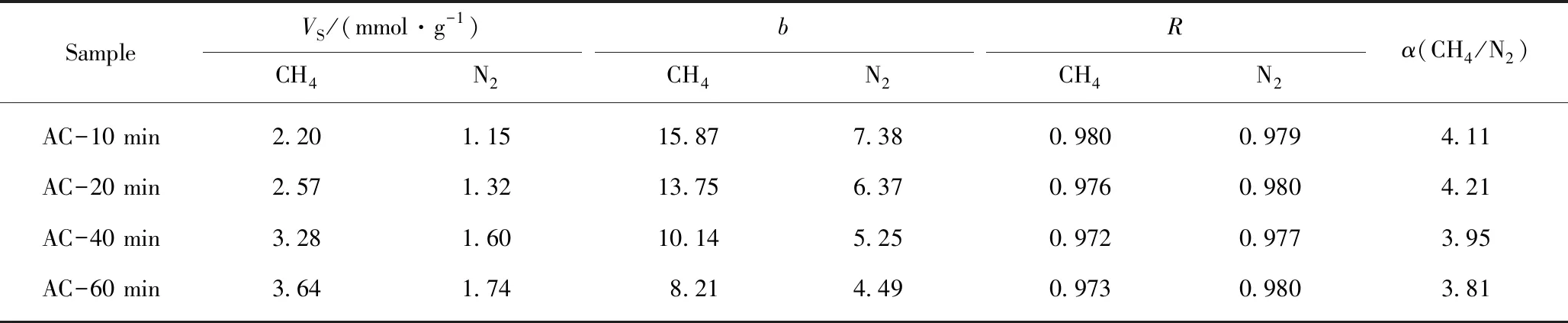
表5 Langmuir方程对不同活化时间制备样品的吸附等温线拟合数据及CH4/N2平衡分离系数Table 5 Langmuir equation fitting data of adsorption isotherms for samples prepared at different times and CH4/N2 equilibrium separation coefficient
由表5可以看出平衡分离系数α随着活化时间的延长呈先增加后减小的趋势,在活化时间≤20 min时,平衡分离系数较高,均在4.0以上,在20 min达到最大4.21,但当活化时间进一步延长,平衡分离系数迅速降低。这可能是由于在水蒸气流量不变的情况下,活化时间越长,更多的水分子扩散到颗粒表面参与活化反应,水分子和孔隙上的碳原子反应,导致合适的微孔结构因反应扩孔而选择性降低。结合吸附容量的大小,活化时间宜在40 min。
2.3 吸附剂的孔结构表征
图9为不同活化温度条件下制备活性炭样品的氮气吸脱附等温线,从中可解析活性炭的比表面积和孔隙结构。按IUPAC对物理吸附等温线的分类,850和950 ℃条件下制备的样品属于Ⅰ型,表明其孔隙结构主要由微孔组成;650和750 ℃条件下制备样品吸脱附等温线重合较差,出现明显的滞后圈,表明材料含有明显的中孔,迟滞环是由中孔发生毛细管凝聚引起[32]。
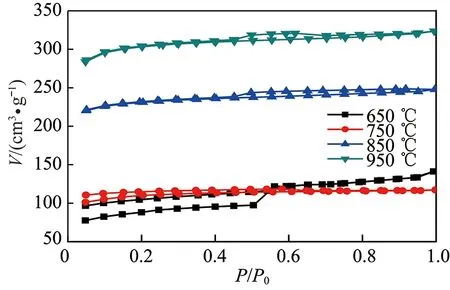
图9 不同活化温度条件下制备活性炭N2吸附-脱附等温线Fig.9 N2 adsorption-desorption isotherm for activated carbon prepared at different activated temperatures
对图9的吸附等温线进行解析,可得到各活性炭样品的比表面积SBET、DR方法微孔孔容Vmic、总孔孔容Vt、平均孔径da,结果见表6。
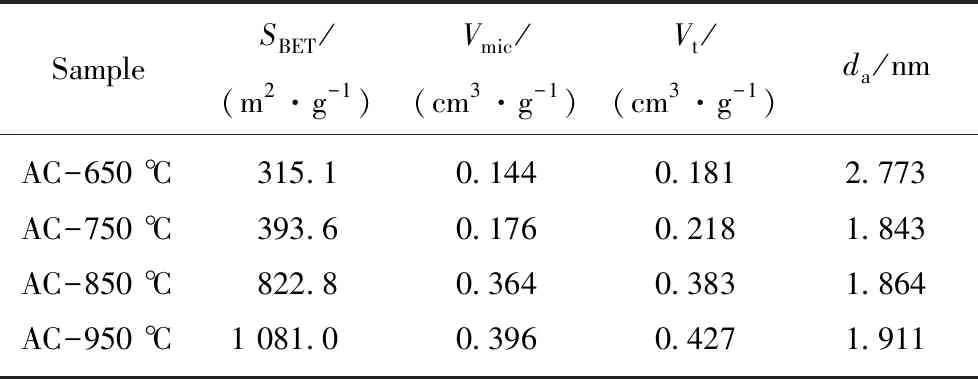
表6 活性炭样品孔结构表征参数Table 6 Textural characteristics of activated carbon
随着活化温度的升高,活性炭的比表面积和微孔孔容呈现规律性变化,比表面积和微孔孔容分别从315.1和0.144递增至1 081.0 m2/g和0.396 cm3/g,这表明随着温度的升高,活化强度逐步增强,产生的微孔逐渐增加,从而体现为比表面积和微孔孔容的增加;从平均孔径可以看出650 ℃活化反应性较差,活性炭孔结构微孔较少,含有较多的中孔和大孔,因而平均孔径较大,之后随着活化温度的升高,微孔的产生数量急剧增加,因而平均孔径显著降低在2 nm以下。为了更加直观的了解活性炭孔径分布情况,利用DFT方程进一步分析计算得到活性炭的孔径分布,如图10所示。
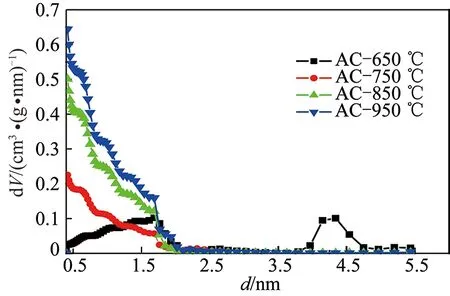
图10 活性炭的孔径分布Fig.10 Pore size distribution of activated carbon
650 ℃活化条件下制备活性炭样品微孔较少,2 nm以下孔容最低,在4.0~5.0 nm有显著凸起峰,表明该条件下样品含有明显中孔,这与上面的分析保持一致;当活化温度升高至750 ℃,可以看出2 nm以上中孔迅速消失,样品以微孔为主;活化温度处于750~950 ℃时,随着活化温度的提高,处于2 nm以下微孔孔容逐步升高,且0.4~1.5 nm微孔增长显著,这说明温度的升高有利于微孔的发育与形成,最终形成主要由微孔组成的微孔活性炭。
2.4 变压吸附性能评价
在上述最佳制备工艺条件(800 ℃,2 kg/h,40 min)下,放大制备活性炭样品(记为BMAC)2 kg,装入变压吸附评价装置,在1.3节所述条件下进行了性能评价,评价结果见表7。浓缩分离效果主要以成品气中CH4体积分数,回收率和产能作为评价指标。回收率=成品气CH4含量(m3)/原料气CH4含量(m3);产能=成品气量(m3)/碳分子筛重量(t)/时间(h)。计算结果均在10个循环以上,成品气浓度稳定之后进行。
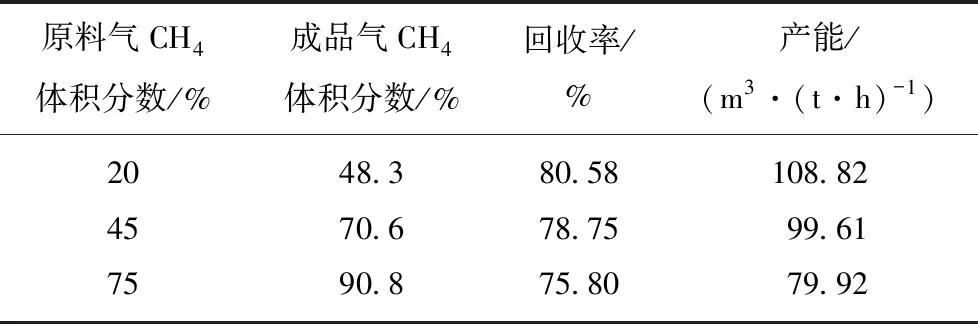
表7 吸附剂BMAC变压吸附评价结果Table 7 Results for PSA process of activated carbon(BMAC)
变压吸附评价实验表明,在最佳制备工艺条件下制备的吸附剂样品对不同浓度CH4/N2混合气均具有一定的分离效果。尤其中低浓度条件下,提浓效果更佳,可将甲烷体积分数为20%的原料气,提高到48.3%,提浓幅度大于25%,回收率为80.58%。随着处理原料气浓度增加,提浓幅度降低,可能与该吸附剂分离机理有关,BMAC吸附剂属于甲烷优先吸附型,基于平衡效应进行分离;高浓度原料气,甲烷含量较高,相同质量吸附剂处理能力降低,这与计算产能结果相一致。
3 结 论
(1)以椰壳炭化料为原料,采用二次炭化-水蒸气物理活化工艺,制备适于煤层气CH4/N2分离用活性炭吸附剂是可行的,最佳条件下制备样品平衡分离系数可达3.95,甲烷饱和吸附容量为3.28 mmol/g,可将甲烷含量20%的 CH4/N2混合气提高到48.3%。
(2)随着活化温度的升高,CH4/N2平衡分离系数逐渐减小,吸附容量逐渐增大,最佳活化温度为850 ℃;随着水蒸气流量的增加,平衡分离系数和吸附容量均呈先增加后减小的趋势,最佳水蒸气流量为2.0 kg/h;随着活化时间的延长,平衡分离系数先增加减小,吸附容量逐步增加,最佳活化时间为40 min。
(3)活化温度是影响活性炭吸附剂孔结构的重要因素,活化温度过低,炭化料的活化反应性较差,不利于微孔的形成与发育,存在明显的中孔结构;当活化温度提高到850 ℃,活化效果显著,可显著提高微孔的含量,形成孔径高度集中的微孔活性炭。
