甘草酸的热回流提取工艺研究
2019-05-07谭勇肖和淼胡爱国唐忠湘黄文飞唐旺
谭勇,肖和淼,胡爱国,唐忠湘,黄文飞,唐旺
(1.邵阳学院 食品与化学工程学院,湖南 邵阳,422000; 2.湖南科瑞生物制药股份有限公司,湖南 邵阳,422900)
甘草具有清热解毒、止咳祛痰和调和诸药的功效。而甘草酸是甘草中最主要活性成分,分子式为C42H62O16,相对分子质量为822.92。甘草酸具有抗肿瘤、抗病毒、抗氧化等作用。它还是一种天然甜味剂,属于一种天然绿色食品添加剂。
根据现实生活中对甘草酸纯度的不同要求,甘草酸产品分为甘草浸膏、粗制甘草酸和精制提纯甘草酸。其中甘草浸膏的制法是:将甘草切片后用一定量水煎煮3次,每次煎煮时间为2h,最后再将3次的煎煮液合并放置过夜,经沉淀后过滤,上清液浓缩至膏状即可得甘草浸膏。粗提甘草酸方法有水提法[1]、稀氨水提取法[2]、乙醇提取法[3]、氨性乙醇提取法、超声强化提取法[4]、微波辅助提取法[5]、超临界流,体萃取法。甘草酸的水溶性盐有低热能、高甜度、起泡性、安全无毒和溶血作用低[6]的特点,且能与多种生物碱、氨基酸、抗生素等生成复方制剂或复盐,具有协同、增溶、增加药物稳定性、提高生物利用率及降低毒副作用的功效。杜文彬等[7]通过水提法提取甘草酸得率为3.04%,通过稀氨水法提取甘草酸得率为9.26%,氨性醇提取法提取甘草酸得率为10.35%。游新勇等[8]以乙醇水溶液为提取剂,通过正交试验优化提取工艺,在最佳工艺条件下提取甘草酸的得率为27.2%。张嫱等[9]以含氨量为0.6%的65%乙醇溶液为提取剂,在最佳工艺条件下提取甘草酸的得率为12.59%。万嘉洋等[10]通过乙醇提取法提取甘草酸得率为12.61%。
本实验采用高效液相色谱法建立甘草酸的含量测定方法,以NaHCO3-乙醇水溶液为提取剂,利用单因素实验和正交实验优化甘草酸的提取工艺,为甘草中甘草酸的大规模工业研究提供一定的参考。
1 实验材料与方法
1.1 材料与仪器
甘草药材(市售)、无水乙醇(分析纯)、冰乙酸(分析纯)、醋酸铵(分析纯)、甲醇、碳酸氢钠(分析纯)、浓硫酸(分析纯)、蒸馏水、甘草酸单铵盐对照品(99%)。
超声清洗器(KQ-500E型 ),智能不锈钢恒温水槽(SYC),磁力搅拌电热套(GLT-LA型),磁力搅拌机(HZ85-2型),精密酸度计(FE20),电子分析天平(FA224),循环水式多用真空泵(SHB-Ⅲ),电热鼓风干燥箱(101-3AB型),高效液相色谱仪(ULtiMate 3000),紫外分光光度计(UV-1780)。
1.2 热回流提取工艺流程
甘草→粉碎→过60目目筛→60℃干燥4小时 →称重→热回流提取→静置过夜→抽滤→滤液蒸发浓缩至20mL左右→冷却→酸沉(pH≈2.0)→静置过夜→过滤 →滤渣烘干得到粗产品→称重
1.3 单因素实验
根据预实验得到的数据,从提取温度、乙醇浓度、NaHCO3添加量以及提取时间4个方面分析各个因素对甘草酸提取率的影响。
基础条件:甘草粉5g,提取温度60℃,乙醇浓度60%,NaHCO3添加量0.3%,液料比15∶1,提取时间1.5h。
1)提取温度对甘草酸提取率的影响
准确称取5g甘草粉于圆底烧瓶中,加入浓度为60%的乙醇和0.3%(g/mL)的NaHCO3混合水溶液,按液料比15∶1混合均匀,热回流时间为1.5h;提取温度依次为40℃、50℃、60℃、70℃、80℃。根据工艺流程提取得到甘草酸粗产品,并对其进行高效液相色谱分析测定粗产品中甘草酸含量。
2)乙醇浓度对甘草酸提取率的影响
准确称取5g甘草粉于圆底烧瓶中,加入0.3%(g/mL)的NaHCO3,按液料比15∶1混合均匀,提取温度为60℃,热回流时间为1.5h;乙醇浓度依次为0%、20%、40%、60%、80%。根据工艺流程提取得到甘草酸粗产品,并对其进行高效液相色谱分析测定粗产品中甘草酸含量。
3)NaHCO3添加量对甘草酸提取率的影响
准确称取5g甘草粉于圆底烧瓶中,加入浓度为60%的乙醇,按液料比15∶1混合均匀,提取温度为60℃,热回流时间为1.5h;NaHCO3添加量依次为0%、0.1%、0.2%、0.3%、0.4%。根据工艺流程提取得到甘草酸粗产品,并对其进行高效液相色谱分析测定粗产品中甘草酸含量。
4)提取时间对甘草酸提取率的影响
准确称取5g甘草粉于圆底烧瓶中,加入浓度为60%的乙醇和0.3%(g/mL)的NaHCO3混合水溶液,按液料比15∶1混合均匀,提取温度为60℃;提取时间依次为1h、1.5h、2h、2.5h、3h。根据工艺流程提取得到甘草酸粗产品,并对其进行高效液相色谱分析测定粗产品中甘草酸含量。
1.4 甘草中甘草酸提取条件优化正交试验
此正交试验以甘草酸提取率为实验指标,在单因素实验的基础上,选择提取温度、乙醇浓度、NaHCO3添加量、提取时间的三个较优水平进行4因素3水平的正交试验。
1.5 高效液相色谱法测定
1.5.1 高效液相色谱分析色谱条件
色谱柱:C18柱 检测器:紫外检测器
流动相:(甲醇∶0.2mol/L醋酸铵∶冰醋酸)=65∶35∶1
柱温:30℃ 流速:1mL/min
1.5.2 甘草酸单铵盐对照品的制备
用电子分析天平精确称取甘草酸单铵盐3mg,用流动相溶解并定容于25mL容量瓶中,得到浓度为0.12mg/mL的甘草酸单铵盐对照品溶液。
1.5.3 甘草酸单铵盐最大吸收波长的确定
取一定量甘草酸单铵盐对照品,用紫外分光光度计对其进行全波长扫描,结果在252nm处有最大吸收峰,因此高效液相色谱的检测波长确定为252nm。
1.5.4 标准曲线的绘制
精确吸取甘草酸对照品溶液1mL、2mL、3mL、4mL、5mL、6mL分别置于10mL 的容量瓶中,摇匀,用流动相定容,在252nm处测峰面积。以甘草酸对照品质量为横坐标,峰面积为纵坐标,制作标准曲线。
1.6 甘草酸提取率计算公式

其中:M1为甘草酸粗产品中甘草酸的质量;M2为甘草中甘草酸的总质量。
1.7 甘草酸粗产品中甘草酸含量的测定
精确称取甘草酸粗品0.02g,用流动相溶解定容于25mL容量瓶中,用0.45μm微孔滤膜过滤样液,各样液进样20μL。按照上述1.5.1项下的色谱条件进行甘草酸含量的测定。
1.8 甘草中甘草酸总含量的测定
精确称取3份甘草粉末各5g,在微波功率为250W,微波时间7min,液料比15∶1的条件下,微波提取5次,用高速离心机在5 000r/min条件下离心5min。取上清液用0.45μm的微孔滤膜过滤,各进样10μL,按1.5.1项下的色谱条件进行甘草酸含量的测定。
2 结果与讨论
2.1 标准曲线的绘制
以甘草酸单铵盐对照品的质量对峰面积进行回归分析,得到线性回归方程为:y=7326.3x+0.0728,R2=1,如图1所示。

图1 甘草酸单铵盐标准曲线Fig.1 Standard curve of monoammonium glycyrrhizinate
2.2 甘草中甘草酸总含量的测定
根据上述1.8项下实验步骤,测得10μL上清液中甘草酸峰面积,再根据标准曲线方程,计算出3份甘草中甘草酸总含量分别为为4.21%、4.02%、4.06%,平均含量为4.10%。
2.3 单因素实验
2.3.1 提取温度对甘草酸提取率的影响
由图2可知,随着提取温度的不断升高,甘草酸的提取率先增大后减小。当温度低于60℃时,甘草酸提取率随温度的升高而增大。当温度达到60℃时甘草酸提取率最大。当温度高于60℃以后,甘草酸提取率随温度的升高而减小。因此,本实验选择甘草酸的最佳提取温度为60℃。

图2 提取温度对甘草酸提取率的影响Fig.2 Effect of extraction temperature on the extraction rate of glycyrrhizic acid
2.3.2 乙醇浓度对甘草酸提取率的影响
由图3可知,在乙醇浓度小于60%时,甘草酸提取率随着乙醇浓度的增加而增加;当乙醇浓度大于60%时,甘草酸提取率随着乙醇浓度增大而减小。因为甘草酸分子量较大且其分子结构极不对称,因此其极性很大,所以甘草酸易溶于极性大的提取剂,而水的极性虽然很大,但是有研究表明甘草酸在水中溶解度比较小[11],当乙醇浓度大于60%后,随着其浓度的增加,提取液的极性不断降低,从而导致甘草酸提取率下降。所以本实验选择60%乙醇作为提取剂。

图3 乙醇浓度对甘草酸提取率的影响Fig.3 Effect of ethanol concentration on the extraction rate of glycyrrhizic acid
2.3.3 NaHCO3添加量对甘草酸提取率的影响
由图4可知,在NaHCO3添加量小于0.3%时,甘草酸提取率随着NaHCO3添加量的增加而逐渐增大。当NaHCO3添加量大于0.3%时,随着NaHCO3添加量的增加甘草酸提取率反而降低。所以本实验选择的最佳NaHCO3添加量为0.3%。

图4 NaHCO3添加量对甘草酸提取率的影响Fig.4 Effect of NaHCO3 addition on the extraction rate of glycyrrhizic acid
2.3.4 提取时间对甘草酸提取率的影响
由图5可知,提取时间小于2h时,随着提取时间的增加,甘草酸提取率逐渐升高。当提取时间超过2h以后,甘草酸提取率反而下降。因此当提取时间为2h时,甘草中甘草酸的提取率最大。所以本实验选择的最佳提取时间为2h。

图5 提取时间对甘草酸提取率的影响Fig.5 Effect of extraction time on the extraction rate of glycyrrhizic acid
2.4 甘草酸的提取工艺条件优化
在单因素试验的基础上,以甘草酸提取率为考察指标,选择提取温度、乙醇浓度、提取时间、NaHCO3添加量4个因素进行L9(34)正交试验设计如表1所示,试验结果如表2所示,方差分析如表3所示。
表1 因素水平Table 1 Factor level

A/℃ B/% C/hNaHCO3D/%150401.50.2260602.00.3370802.50.4
表2 正交试验结果
Table 2 Orthogonal test results
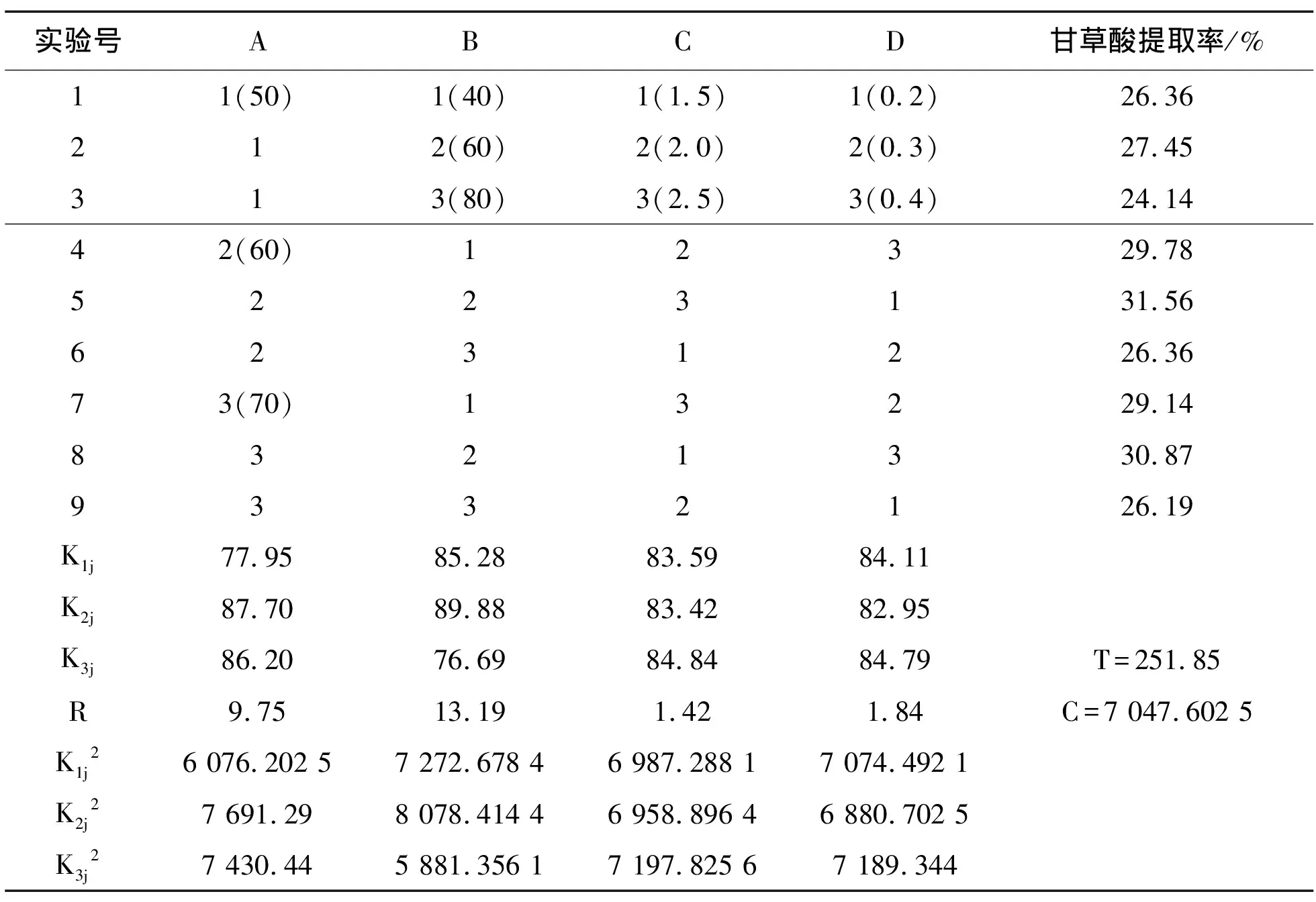
ABCD/%11(50)1(40)1(1.5)1(0.2)26.36212(60)2(2.0)2(0.3)27.45313(80)3(2.5)3(0.4)24.1442(60)12329.785223131.566231226.3673(70)13229.148321330.879332126.19K1j77.9585.2883.5984.11K2j87.7089.8883.4282.95K3j86.2076.6984.8484.79T=251.85R9.7513.191.421.84C=7 047.602 5K1j26 076.202 57 272.678 46 987.288 17 074.492 1K2j27 691.298 078.414 46 958.896 46 880.702 5K3j27 430.445 881.356 17 197.825 67 189.344
表3 方差分析表
Table 3 Analysis of variance

FFαA18.37529.187 537.58F0.05(2,4)=6.94∗∗B29.880214.9461.10F0.01(2,4)=18.00∗∗CΔ0.40120.200 5NaHCO3D0.57720.288 5eΔ0.97840.244 549.2338
注:**代表具有极显著性。
由表2和表3中的数据可以看出,影响甘草酸提取率的因素从大到小依次是:B>A>D>C。A表示因素有极显著影响,B因素有极显著影响,C因素无显著影响,D因素无显著影响。因此正交试验最佳提取条件为A2B2C3D1。
综合单因素与正交实验的结果,可知甘草中甘草酸最佳提取工艺条件:乙醇浓度为60%,提取温度为60℃,NaHCO3添加量为0.4%,液料比为15∶1,提取时间为2.5h。
2.5 甘草酸的最佳提取工艺条件验证试验
用分析天平称取5g已粉碎的过60目目筛的甘草粉末共3份,按照最佳工艺条件进行提取,得甘草酸样品,用高效液相色谱法测定样品中甘草酸含量。结果测得甘草酸提取率分别为32.89%、33.35%、33.58%,平均提取率为32.27%。此验证试验表明了在最佳提取工艺条件下,甘草酸的提取率较高,且该工艺条件提取甘草酸的稳定性良好。
3 结论
本实验采用热回流法对甘草中的甘草酸进行提取。通过实验结果可知,热回流法从甘草中提取甘草酸的最佳工艺条件:乙醇浓度为60%,提取温度为60℃,NaHCO3添加量为0.4%,液料比为15∶1,提取时间为2.5h。在最佳工艺条件下提取的粗产品中甘草酸含量比较接近,平均提取率为33.27%,重复性良好。用NaHCO3-乙醇作为提取剂,廉价易得,且NaHCO3相较于稀氨水来说更加绿色环保,适合于大规模工业化生产。
