重症急性胰腺炎胃肠功能障碍的诊治和发生机制研究进展
2019-05-07温聪聪王颖吴德卿徐晓蓉
温聪聪 王颖 吴德卿 徐晓蓉
上海市第十人民医院消化内科,上海 200072
【提要】 重症急性胰腺炎(SAP)为临床常见危重症之一,常伴有胃肠道功能障碍,包括动力障碍、屏障功能障碍、消化吸收不良和分泌功能障碍,目前认为它是引发全身炎症反应综合征、多器官功能障碍综合征等的重要启动因素。纠正胃肠道功能障碍是治疗SAP的重要环节,对SAP的病程和预后有着重要影响。
重症急性胰腺炎(SAP)为临床常见危重症之一,病死率高达36%~50%[1]。胃肠功能障碍是SAP常见并发症之一,其主要表现为腹胀明显、肛门排气排便减少或停止、腹腔内压增高、肠鸣音减弱或消失等。此时胃肠道内细菌过度繁殖,进而导致细菌及内毒素易位、 肠道微生态紊乱及免疫功能受损,进一步加速全身炎症反应综合征(SIRS),最终引起多器官功能障碍综合征(MODS)。
一、SAP胃肠功能障碍的发生机制
1.胃肠动力障碍机制:SAP的发生、发展过程由多种炎症递质、细胞因子参与,大量文献报道SAP患者并发胃肠动力障碍与IL-1、IL-6、TNF-α密切相关。Zhong等[2]发现,与对照组相比SAP大鼠肠黏膜TNF-α、IL-6和IL-10表达明显增加。TNF-α引起大量中性粒细胞聚集、激活,并通过级联反应释放氧自由基、蛋白酶和炎症递质,进一步激活肠固有免疫细胞,从而导致肠黏膜、肠肌丛神经损伤,最终引起肠平滑肌功能紊乱。TNF-α还可引起一氧化氮合酶(nitric oxide synthase, NOS)活性增强,产生能使平滑肌舒张的NO,NO水平增高可导致肠运动功能减弱。此外,大量研究证实,SAP时NF-κB被激活,发生核易位诱导mRNA合成,引起TNF-α、IL-6等炎症因子表达升高,TNF-α又可以激活NF-κB ,提示NF-κB介导了SAP时胃肠功能障碍的发展。
胃肠道通过旁分泌及内分泌的方式分泌多种激素调节胃肠动力,胃肠激素的改变与SAP胃肠动力紊乱密切相关。在SAP的病理生理过程中,胃动素、血管活性肠肽(vasoactive intestinal peptide,VIP)、胆囊收缩素(cholecystokinin, CCK)、NO、P物质、内皮素(endothelin, ET)等参与了胃肠动力功能紊乱的发生与发展。研究发现,与健康对照组相比,SAP患者血清中CCK水平下降,VIP水平升高,SAP患者结肠转运时间与CCK水平的下降密切相关。刘芳等[3]发现,正常对照组血清胃动素水平明显高于SAP组,经治疗后SAP患者胃动素水平可显著回升,伴随肠蠕动增加, 临床症状改善。研究表明SAP时VIP 能通过影响胃肠道平滑肌电活动而导致胃肠动力障碍。VIP阳性神经元是来自肠神经系统的重要抑制性神经元,可分泌VIP使胃肠道平滑肌舒张,研究发现SAP伴胃肠动力障碍的大鼠,胃窦肌间VIP阳性神经元发生了重塑,与SAP伴胃肠动力障碍的神经机制有关[4]。
NO是胃肠道非胆碱能非肾上腺能神经释放的抑制性递质之一,由NOS催化而成。NO通过舒张平滑肌来调节胃肠动力在胃排空的肠壁机械感受器和化学感受器的反馈调控中发挥重要作用。Wiest等[5]证实高浓度NO可抑制ATP形成,促进氧自由基产生,增大肠上皮间隙,损害肌动蛋白骨架,导致胃肠收缩障碍及细菌易位。P物质作为胃肠运动调节的主要兴奋性神经递质,通过双重的收缩效应,促进肠蠕动。研究发现在急性坏死性胰腺炎(ANP)大鼠中,胃肠道纵行肌和环形肌对于P物质的双重收缩反应性下降,导致胃肠蠕动功能减弱。ET在血管内皮及胃肠黏膜上皮细胞均能合成,已证实人体内有ET-1、ET-2及ET-3三类。ET-1是目前所知的作用最强、持续时间最长的缩血管活性物质,通过启动电压依赖性Ca2+通道促使胞外Ca2 +内流,引起细胞内Ca2+超载,促使氧自由基释放,从而加重SAP患者胃肠动力障碍。
2.胃肠屏障功能损害机制:SAP早期即可发生肠屏障功能障碍,肠屏障主要包括机械屏障、免疫屏障、化学及生物屏障。研究发现ANP大鼠制模后6 h回肠Peyer集合淋巴结中存在大量凋亡淋巴细胞,提示肠道免疫屏障受损。Zhang等[6]发现小肠细菌过度生长通常在AP发病后72 h出现;SAP患者长期禁食或胃肠减压,肠黏膜的化学屏障也会遭到破坏。导致SAP肠屏障功能障碍的机制可以归为局部因素及全身因素两方面。全身因素包括胃肠激素、炎症因子、免疫功能、营养状况等;局部因素主要包括胃肠动力障碍、肠道微循环障碍和缺血再灌注损伤、肠上皮细胞凋亡等。
肠黏膜的绒毛、微血管结构具有高代谢特征,对灌注不足特别敏感,尤其是肠绒毛。SAP早期患者常处于低血容量状态,导致肠黏膜缺血缺氧,当液体复苏再灌注时激活中性粒细胞,直接或间接激发、放大炎症反应,进一步加重肠屏障功能障碍,常导致MODS。肠道缺血再灌注损伤后可释放内毒素和高迁移率族蛋白1(high-mobility group protein 1,HMGB1),Wang等[7]发现HMBG1及其下游信号通路在小鼠肠缺血再灌注损伤中起重要作用,与对照组比较,小鼠小肠缺血再灌注模型组经尾静脉注入抗HMGB1后小肠组织损伤减轻。缺氧诱导因子(hypoxia-inducible factor,HIF)-1是缺血缺氧病理生理反应的关键因素,SAP时HIF-1表达明显增加,可以改善肠道通透性增加、细菌易位等状况。研究表明,HIF-1通过CD73和A2BAR刺激细胞外腺苷的产生,对抗炎症反应,对肠缺血再灌注损伤具有保护作用[8]。稳定HIF可能是治疗肠系膜缺血再灌注损伤的一种新方法。
有研究观察了大鼠ANP制模后6、12、24 h回肠黏膜组织的上皮细胞凋亡指数,发现12、24 h ANP组较对照组细胞凋亡指数显著增加,且24 h最为显著,提示回肠上皮细胞凋亡参与了ANP的肠道黏膜屏障功能障碍的病理生理过程。细胞凋亡与有丝分裂间相互协调才能维持正常胃肠黏膜上皮细胞的更新,细胞凋亡增加,细胞再生不平衡,可能导致绒毛萎缩。早期给予ANP动物肠内营养(enteral nutrition, EN)治疗,发现肠绒毛相对完整,血清中内毒素水平下降,提示EN可以维持肠屏障功能完整性、降低细菌易位发生率[9]。肠上皮主要能量来源是谷氨酰胺,并非葡萄糖。谷氨酰胺缺乏可以减少活性紧密连接蛋白occludin的表达,从而影响紧密连接的完整性,引起肠上皮通透性的增加。Han等[10]研究发现ANP+EN+谷氨酰胺组的肠上皮细胞凋亡指数显著低于ANP+EN组或ANP+谷氨酰胺组,谷氨酰胺与EN联合应用可抑制ANP大鼠肠上皮细胞凋亡,维持肠黏膜屏障的完整性。
二、SAP胃肠功能障碍的临床表现及诊治
SAP患者发生胃肠功能障碍时,可在原发病的基础上出现腹痛、腹胀、腹泻或便秘、肛门排气排便停止或减少、消化道出血等,同时常伴有消化、吸收功能障碍,可出现EN不耐受等情形,严重者发生腹腔间隔室综合征(abdominal compartment syndrome, ACS)。目前胃电图、胃肠传输试验、肠道气体定量分析、核素检查、胃肠测压、胶囊内镜、乳果糖呼气试验等这些反映胃肠动力和吸收功能的检测方法还未能广泛应用于SAP的诊疗过程中[11],临床上多根据症状、肠鸣音听诊以及超声、CT检查等评估胃肠功能障碍,尚缺乏一套完整的评分系统。 Reintam等[12]首次提出胃肠功能衰竭(gastrointestinal failure, GIF)的评分系统,项目包括食物不耐受综合征和腹腔高压,对ICU危重患者的病死率预测具有价值。具体内容为:0分,胃肠功能正常;1分,肠内营养提供<50%预计需要量或腹部术后3 d未进食;2分,食物不耐受综合征或腹腔高压;3分,食物不耐受综合征和腹腔高压;4分,ACS。Sun等[13]在此基础上针对SAP患者设计了一套改良的GIF评分系统(表1),最低值为0分,最高值8分,分值越高,胃肠功能障碍越严重。与Reintam的GIF评分相比,改良的评分对预测医院病死率[曲线下面积(AUC)0.915比0.850]、MODS(AUC 0.829比0.766)和胰腺感染(AUC 0.796比0.776)更有价值。此外,Tee等[14]研究发现,序贯器官衰竭评分(sequential organ failure assessment, SOFA) 可预测SAP的病死率,入院第7天进行SOFA评分有助于预测SAP后期病死率;将改良的GIF评分与SOFA或APACHEⅡ评分相结合,可以更准确地判断SAP的预后。
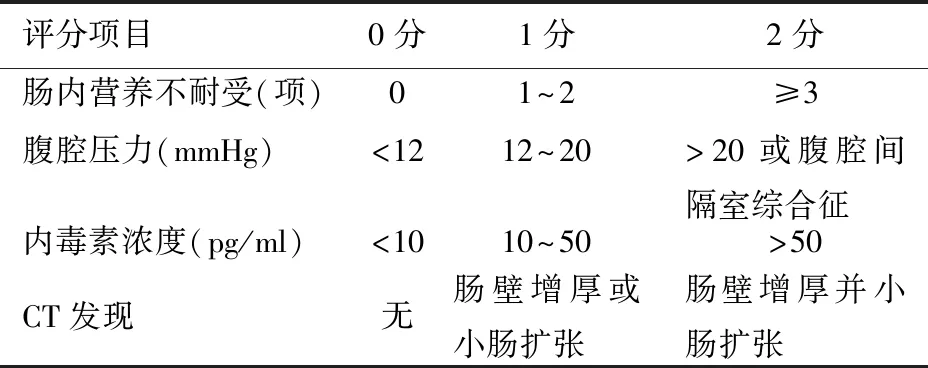
表1 改良的胃肠功能衰竭评分
注:因反复或大量的呕吐、腹泻、胃肠道梗阻、腹痛及腹胀等而无法进行肠内营养,3 d内出现其中任何一项症状即判定为肠道营养不耐受;患者平卧,采用闭合回路测定膀胱内压力间接测定腹腔压力;1 mmHg=0.133 kPa
尽早恢复胃肠道功能是改善SAP预后的关键,目前的治疗方法主要包括胃肠道促动力剂、中药疗法(清胰汤、芒硝外敷等)、补充益生菌、针灸(针刺足三里)、适时EN、胃肠减压、穿刺引流腹水等。研究发现高容量血液滤过(high-volume hemofiltration, HVHF)、连续肾脏替代疗法(continuous renal replacement therapy,CCRT) 治疗SAP后,血清及尿淀粉酶、WBC、CRP及脏器功能均有明显改善,同时可迅速减轻腹部症状,改善预后,降低SAP患者的病死率[15]。Reintam等[16]发现,相比于肠外营养(parenteral nutrition, PN)和延迟EN,早期EN可以减少SAP患者感染相关的并发症。Wu等[17]的一项随机对照试验发现SAP患者最常见的死亡原因(占27%)是脓毒症引起的MODS,PN组为43%而EN组仅为11%(P<0.05)。EN除满足对热量和蛋白质的要求外,更重要的是对SAP患者的免疫调节作用。Wang等[9]将SAP患者分别纳入PN组、EN组和微生态免疫营养组,结果发现与PN组相比,EN组和微生态免疫营养组的血浆TNF-α和IL-6水平显著降低(P<0.05),抗炎因子IL-10水平则显著增高(P<0.05),微生态免疫营养组差异更为显著(P<0.05)。康利民等[18]有类似发现,肠内微生态免疫营养组治疗SAP 14 d后,外周血IgA、IgG、IgM水平明显高于EN组,APACHEⅡ评分、CT评分及感染发生率、手术率、病死率两组差异均有统计学意义。提示可通过分析患者肠道微生态选择合适的益生元和(或)益生菌组合进行肠内免疫微生态治疗,以帮助胃肠功能的恢复。
三、SAP胃肠功能障碍的未来研究方向
GIF是SAP常见的并发症,常发生在其他脏器衰竭之前,是MODS的其中一种表现,也是SAP 治疗的重点和难点。但目前对胃肠功能的评估尚缺乏一套完整的评分系统,未来临床研究方向应指向通过大样本数据总结出更敏感、更特异的胃肠功能障碍评估标准,寻找早期诊断胃肠功能障碍的检测指标。中药对于治疗SAP胃肠功能障碍有一定价值,但其相关药理机制的基础实验有待进一步深入和完善。如何将上文讲述的基础研究发现转化为临床应用,尽早恢复胃肠运动、保护肠道屏障功能、阻止SAP病程向危重演变,也是努力的方向。
利益冲突所有作者声明不存在利益冲突
