细胞内不同形态Gd基MRI造影剂的T1/T2弛豫性能及造影效果
2019-05-07孙兴丽张艳辉赵敏敏张海禄邓宗武
孙兴丽 张艳辉 赵敏敏 谭 波 张海禄 邓宗武*,
(1中国科学技术大学苏州纳米技术与纳米仿生学院,合肥 230026)
(2中国科学院苏州纳米技术与纳米仿生研究所,苏州 215123)
0 引 言
磁共振影像(magnetic resonance imaging,MRI)是在均匀磁场中不同生物组织中的水质子有序排列形成的磁矩受到特定的微波激发后,其纵向(T1)弛豫速率和横向(T2)弛豫速率存在差异,导致回波的信号强度不同,在影像中形成对比度差异,实现对生物体的细胞、组织和器官的结构和功能成像[1]。当不同组织的影像对比度接近时,通过引入造影剂来改变特定组织中水质子的弛豫速率,增强特定组织的对比度,可实现对该特定组织的成像[2-5]。
MRI信号强度由水质子的T1和T2弛豫速率共同决定,造影剂通过改变水质子的弛豫速率T1和T2来获得造影的效果。任何造影剂的引入既加速水质子的T1弛豫速率,也加速其T2弛豫速率,但是加速T1弛豫速率导致MR信号增强,而加速T2弛豫速率会导致MR信号减弱,最终的信号强度或造影效果取决于2个弛豫速率的变化对MRI信号强度影响的相对幅度[1,6]。目前,Gd基配合物由于T1加速效应显著,是临床上使用最广泛的T1型造影剂[2-3,7-8];超顺磁氧化铁纳米粒子由于T2加速效应显著,作为T2型造影剂得到广泛的研究,并且有过有限的临床应用[4-5]。
MRI造影的物理机制赋予了其高度复杂性且难以预测的特点。造影剂对T1和T2弛豫速率的加速效应的相对强度一方面与造影剂的结构相关,如超小氧化铁纳米粒子可以呈现显著的T1增强效应[9-10],而Gd基配合物纳米粒子也可以呈现显著的T2增强效应[11-12]。另一方面,造影剂进入细胞或组织中,还与其在细胞中的聚集和运动状态高度相关,更增加了其复杂程度。近年来,虽然有些这方面的研究报道[13-16],但对其认识还有待进一步深入。临床上,MRI造影一方面主要应用于内源性的病变组织的诊断,另一方面在外源性移植细胞的示踪中也具有很大的应用前景。这些不同领域的应用要求进一步深入了解造影剂与细胞及组织的作用机制,以获得有价值的影像信息。
本文作者在前期研究中发现,特定结构的Gd基配合物通过脉冲电转染标记细胞,在将游离态造影剂引入细胞质的同时,也诱导部分造影剂组装成纳米粒子进入细胞质,2种不同状态的造影剂分子对细胞水质子的弛豫速率影响机制存在显著的不同[17-19]。在此基础上,我们利用异烟肼(INH)的良好生物膜穿透性[20-21],将其与Gd-DO3A偶联,合成小分子造影剂Gd-DO3A-INH。利用脉冲电转染技术标记间充质干细胞,有效提高进入细胞的Gd-DO3A-INH浓度,并诱导部分Gd-DO3A-INH在细胞质中自组装成纳米粒子。通过体外MRI清楚揭示2种不同状态的Gd-DO3A-INH对细胞水质子弛豫速率的影响机制及其胞内浓度的涨落对MRI造影效果的影响机制。
1 实验部分
1.1 实验仪器与试剂
11.7 T磁共振微成像系统(Bruker,德国);脉冲电转仪 (壹达,中国);2535/2707高效液相色谱仪(Waters,美国);X series 2电感耦合等离子体发射质谱仪(ICP-MS)(Thermo,美国);Forma CO2细胞培养箱(Thermo,美国)。
1,4,7,10-四氮杂环十二烷盐酸盐购自安耐吉化学公司(中国);细胞增殖及细胞毒性检测试剂盒(MTT)购自 Beyotime。血清、培养基 DMEM/F12、胰蛋白酶、双抗购自Gibco公司(美国);异烟肼,对羟基苯甲醛以及其他化学品购自国药化学试剂公司。
1.2 Gd-DO3A-INH的合成
Gd-DO3A-INH的合成步骤如图1所示。1,4,7-三(叔丁氧羰甲基)-10-(乙酸)-1,4,7,10-四氮杂环十二烷[DO3A(OtBu)3]的合成由 1,4,7,10-四氮杂环十二烷盐酸盐经多步反应得到[22-23]。在[DO3A(OtBu)3]上偶联对羟基苯甲醛和异烟肼(INH)后脱去叔丁基的保护,通过高效液相色谱仪分离得到纯度为97%的配体DO3A-INH。DO3A-INH与GdCl3配位,反应完成后,利用HPLC分离得到Gd-DO3A-INH,纯度为90%。利用核磁共振波谱仪获得DO3A-INH的氢谱图(Supporting Information,Fig.S1);利用飞行时间质谱(TOF-MS)仪获得 DO3A-INH(Fig.S2)和 Gd-DO3AINH的质谱图(Fig.S3)。
DO3A-INH的结构通过质谱和核磁共振氢谱表征。DO3A-INH(C31H43N7O9)的相对分子量为657.31,质谱中质荷比(m/z)658.4 为[M+H]+,329.6 为[M+2H]2+,220.1为[M+3H]3+。氢谱中化学位移6.8和7.7处是苯环的特征峰,化学位移8.1和8.7处是异烟肼上吡啶环的特征峰。Gd-DO3A-INH(Gd(C31H40N7O9))相对分子量为811.94,质谱中质荷比811.8为 [M]+,407.1 为[M+2H]2+,271.7 为[M+3H]3+。
1.3 Gd-DO3A-INH水溶液的弛豫率
配置一系列不同浓度(0~2.0 mmol·L-1)的 Gd-DO3A-INH水溶液,将配置好的溶液分别转入到1.1 mm内径的毛细管中。在11.7 T的NMR谱仪上,测量不同浓度Gd-DO3A-INH水溶液的T1和T2值,并通过电感耦合等离子体发射质谱仪(ICP-MS)测量Gd的浓度。
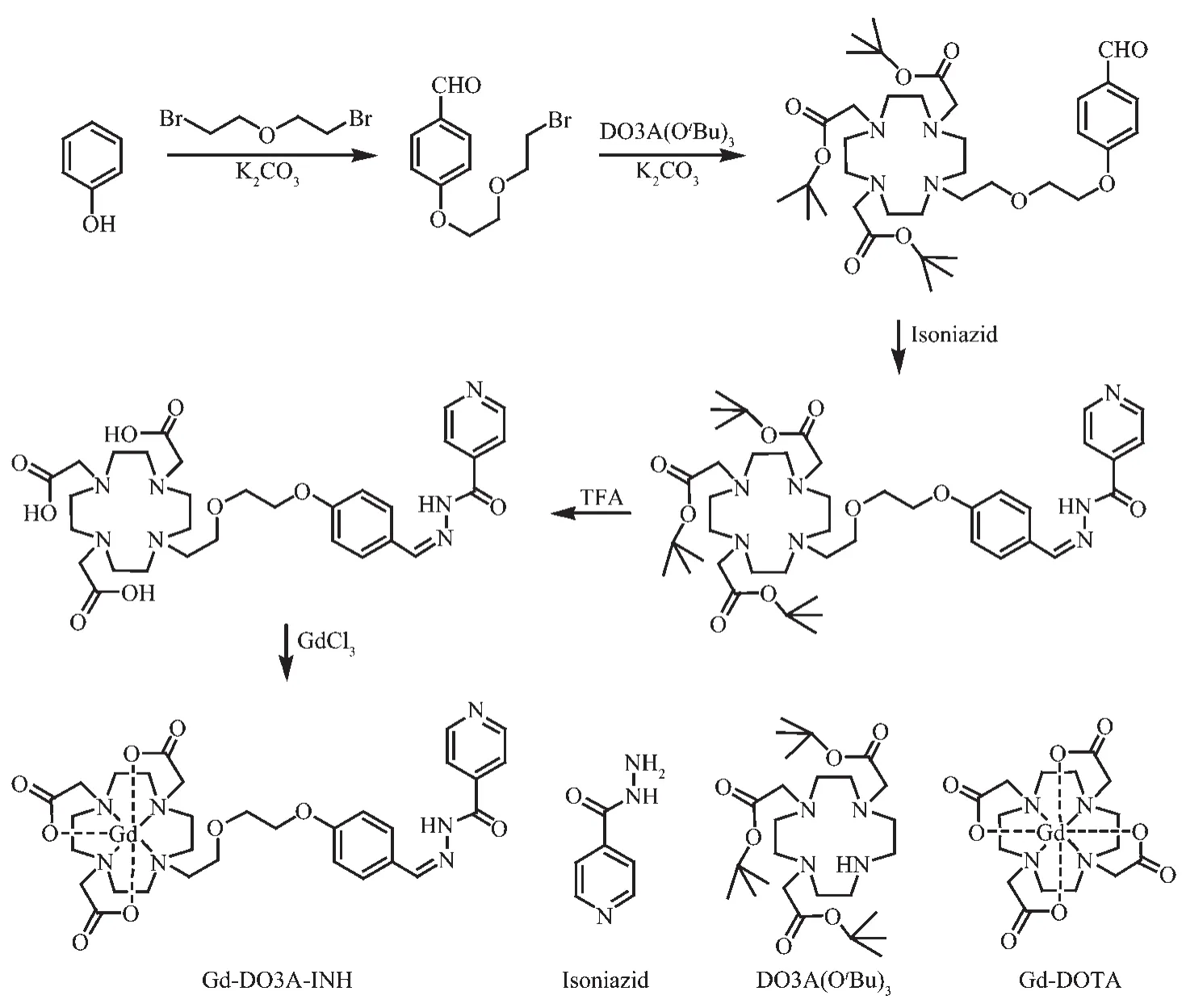
图1 Gd-DO3A-INH的合成步骤和Gd-DOTA的结构Fig.1 Synthesis procedure of Gd-DO3A-INH and the structure of Gd-DOTA
1.4 人骨髓间充质干细胞(hMSCs)培养和脉冲电转染标记
将 hMSCs接种在 100 mm×20 mm(每皿约 1×106个细胞)培养皿中,在37℃、5%(体积分数,下同)CO2培养箱中培养。使用电转液配置一系列浓度的Gd-DO3A-INH 溶液 (2、4、6 mmol·L-1)。 将消化离心好的hMSCs分别重悬至200 μL的Gd-DO3A-INH电转染液中,随后转移到96孔板中进行脉冲电转染标记。将标记好的hMSCs转移到15 mL无菌离心管中,PBS洗涤3次,转入100 mm×20 mm培养皿中进行培养、传代,用于安全性实验或TEM实验。
1.5 Gd-DO3A-INH电转染标记hMSCs的安全性
Gd-DO3A-INH电转染标记hMSCs的安全性通过MTT试剂盒检测标记细胞的存活率进行评价,基于活细胞线粒体中的琥珀酸脱氢酶能够使外源性的MTT还原为蓝紫色甲瓒结晶并沉积在细胞中,而死细胞没有这个功能。用一系列不同浓度的Gd-DO3A-INH(2、4、6 mmol·L-1)通过电转染方法标记hMSCs,按每孔1×104个细胞的密度接种于96孔板。未经任何处理的hMSCs以同样的密度接种于同一个96孔板中作为对照组。等量的培养基加入同一96孔板中,作为空白组。将铺有细胞的96孔板置于37℃,5%CO2细胞培养箱培养,待细胞贴壁密度长至80%后,每孔加入100 μL浓度为1 mg·mL-1的MTT溶液,在37℃,5%CO2细胞培养箱中培养3~4 h,缓慢吸出MTT溶液,每孔加150 μL DMSO溶液,放于摇床低速震荡10 min。在酶标仪490 nm处测定蓝紫色甲瓒结晶的吸光度,以评估电转染标记和Gd-DO3A-INH对hMSCs的毒性。
1.6 TEM观察Gd-DO3A-INH电转染标记的hMSCs
采用透射电子显微镜(TEM)观察Gd-DO3A-INH电转染标记hMSCs 24 h后在细胞内的分布状态。用2.5%(V/V)戊二醛将标记好的hMSCs在4℃固定6 h以上,用3%(w/w)的琼脂进行包埋,再用一系列体积分数为 30%,50%,70%,80%,90%,100%(3次)的丙酮溶液脱水。脱水结束后,用1∶1(V/V)的包埋剂/100%丙酮浸泡细胞团块1 h,然后用纯的环氧树脂包埋剂浸透2 h以上。随后放入模具中加热至70℃聚合包埋2 d。包埋好的细胞团块冷却后用超薄切片机(Leica UC6,美国)切成70 nm厚的细胞切片并负载到铜网支架上,用于TEM观察。
1.7 Gd-DO3A-INH电转染标记hMSCs的细胞MRI
将 Gd-DOTA(商用 Dotarem,图 1)和 Gd-DO3AINH分别电转染标记hMSCs并转入100 mm×20 mm培养皿 (每皿约1×106个细胞)中进行培养、传代。当细胞密度增殖到80%时,使用胰蛋白酶消化hMSCs,1 200 r·min-1离心 5 min,用 PBS 洗涤 2 次。离心所得的细胞沉淀一半用于增殖,另一半用于体外MRI。对于体外细胞MRI,将收获的细胞转移到内径为1.1 mm的毛细管中,在11.7 T NMR谱仪(Bruker-Biospin,德国)上采集hMSCs沉淀的T1和T2加权图像并测量T1和T2弛豫时间。将采集好MRI信息的hMSCs沉淀进行计数,计数后将hMSCs沉淀进行消解至溶液清澈透明,用超纯水定容至5 mL,然后用ICP-MS测定Gd含量。
2 结果与讨论
2.1 Gd-DO3A-INH水溶液的弛豫率
Gd-DO3A-INH的弛豫率以Gd-DOTA(r1=3.74 mmol-1·L·s-1;r2=4.85 mmol-1·L·s-1,11.7 T)作为对照。利用11.7 T NMR谱仪测量Gd-DO3A-INH溶液的纵向弛豫时间T1和横向弛豫时间T2值,两者的倒数1/T1和1/T2分别定义为纵向弛豫速率和横向弛豫速率,经线性拟合得到Gd-DO3A-INH在水溶液中的纵向弛豫率r1和横向弛豫率r2分别为6.72和7.77 mmol-1·L·s-1(图 2)。由于 Gd-DO3A-INH 在 Gd-DO3A的基础上偶联了苯环和异烟肼,增大了造影剂的分子量,在一定程度上提高了其纵向弛豫率r1和横向弛豫率r2。
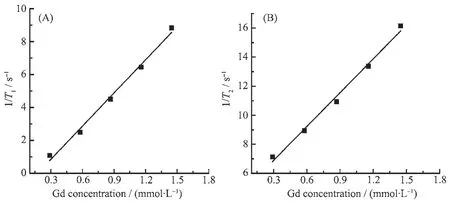
图2 Gd-DO3A-INH溶液的1/T1(A)和1/T2(B)随Gd浓度的变化Fig.2 (A)1/T1and(B)1/T2of Gd-DO3A-INH solutions as a function of Gd concentration
2.2 Gd-DO3A-INH电转染标记hMSCs的安全性
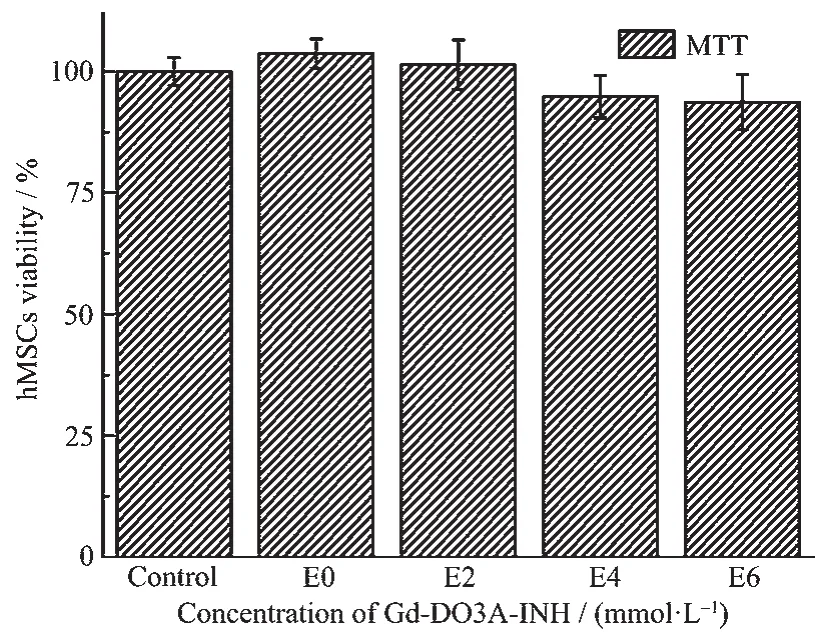
图3 Gd-DO3A-INH脉冲电转染标记hMSCs的MTT实验结果Fig.3 MTT assay of hMSCs labeled with Gd-DO3A-INH via electroporation
MTT实验结果表明(图3),将未标记的对照组hMSCs的存活率设为100%,经T-TEST方差分析,在本文实验条件下,脉冲电转染过程对hMSCs的存活率与对照组无明显差异(E0 vs Control),电转染过程本身对hMSCs的存活率没有负面影响;在0~6 mmol·L-1实验浓度范围内,Gd-DO3A-INH电转染标记hMSCs,与对照组相比,标记的hMSCs存活率随Gd-DO3A-INH 浓度的增加略有降低(E2,E4,E6),但均在90%以上。因此在本文实验条件下,Gd-DO3AINH电转染标记hMSCs具有较高的安全性。
2.3 Gd-DO3A-INH标记hMSCs的细胞结合状态
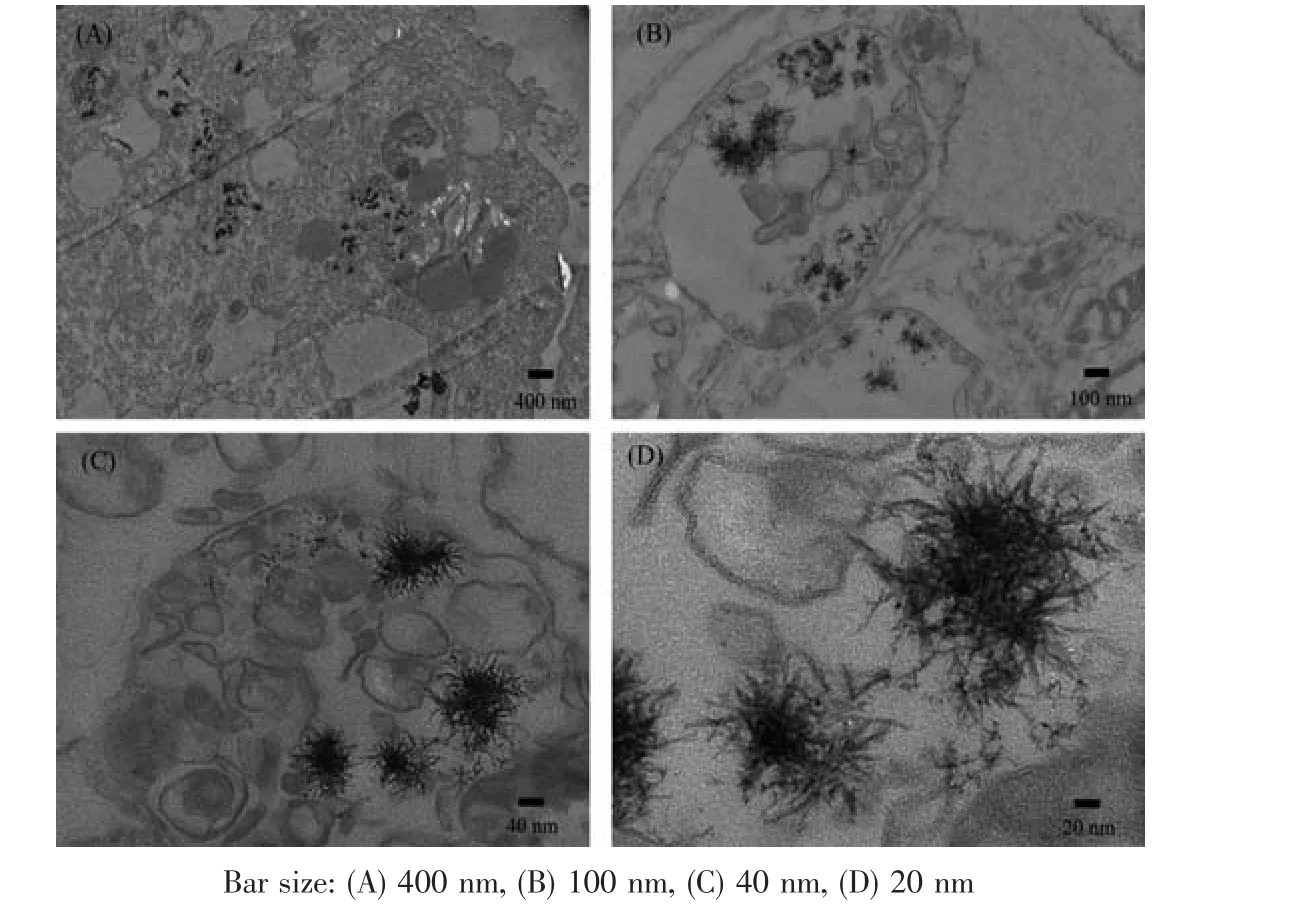
图4 浓度为6.0 mmol·L-1的Gd-DO3A-INH电转染标记hMSCs的TEM图像Fig.4 TEM images of hMSCs labeled with Gd-DO3A-INH via electroporation at 6.0 mmol·L-1
通过TEM观察Gd-DO3A-INH在hMSCs中的聚集状态及分布(图4)。在TEM中清楚地观察到在细胞质中形成的Gd-DO3A-INH纳米团簇,纳米团簇的尺寸为数百纳米到数微米,由许多纳米针组成,长度为20~50 nm,直径约为5 nm。细胞内纳米团簇的形成过程在我们的前期工作中报道过:探针首先聚集到细胞膜表面,脉冲电转染诱导其在细胞膜进一步形成纳米团簇,随后进入到细胞质中[16-17]。与此同时,在电转染标记过程中,一定量的游离Gd-DO3A-INH也被引入细胞质,特别是异烟肼还具有较强的生物膜穿透能力,更有利于游离态的Gd-DO3A-INH进出细胞,是本文选择Gd-DO3A-INH作为研究对象的主因,这点将在MRI结果中进一步讨论。因此,电转染将2种不同结合形式的Gd-DO3AINH引入hMSCs的细胞质中,它们对细胞水质子的T1和T2弛豫过程呈现不同的影响,并最终反映到MRI信号强度即对比度中。与此同时,使用Gd-DOTA和电转染标记细胞时,没有观察到纳米团簇的生成。
2.4 Gd-DO3A-INH标记hMSCs的体外MRI
使用6 mmol·L-1的 Gd-DOTA和不同浓度的Gd-DO3A-INH(2.0、4.0、6.0 mmol·L-1)电 转 染 标 记hMSCs,在标记后传代培养的不同时间点采集标记细胞的T1和T2加权信号强度并测量其T1和T2弛豫速率。图5A和B分别是Gd-DO3A-INH标记的hMSCs的T1和T2加权像;图6A和B分别给出Gd-DOTA和不同浓度的Gd-DO3A-INH相应的T1和T2加权信号强度随细胞传代培养时间的变化;图6C和D分别给出Gd-DOTA和不同浓度的Gd-DO3AINH相应的T1和T2弛豫速率随细胞传代培养时间的变化。
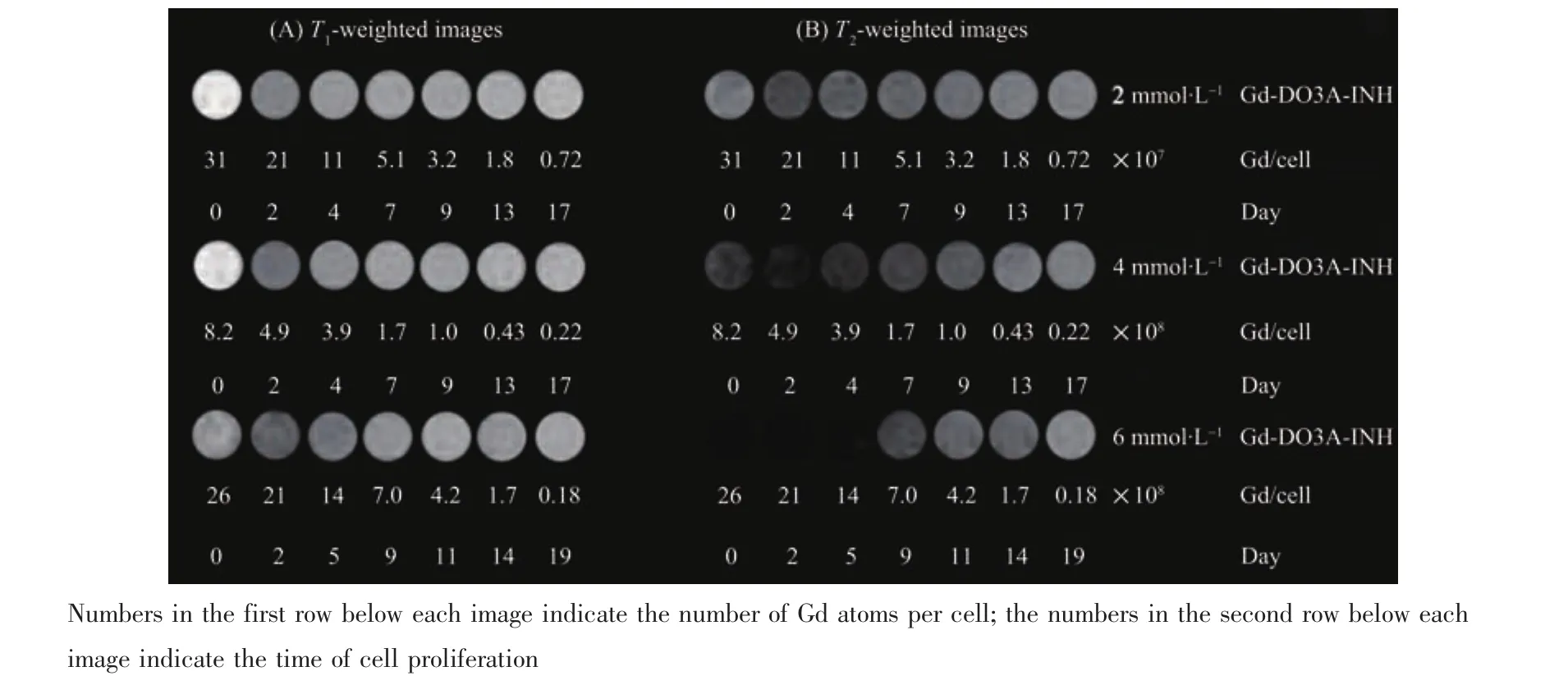
图5 Gd-DO3A-INH标记hMSCs的11.7T体外(A)T1和(B)T2加权MR像Fig.5 In vitro(A)T1-and(B)T2-weighted MR images of hMSCs labeled with Gd-DO3A-INH via electroporation at 11.7 T
在T1加权像中 (图5A),Gd-DO3A-INH标记的hMSCs,第0天(细胞标记当天)的MRI细胞影像中呈现出明显的信号增强效应,在2天内呈现一个显著的降低,在随后的传代培养中,信号逐渐恢复到未标记细胞的信号强度水平(定量结果见图6A);在图 5B的 T2加权成像中,Gd-DO3A-INH标记的hMSCs,T2加权成像呈现明显的暗信号减弱效应,而且标记浓度越高,信号减弱效应越显著,持续的时间也更长(定量结果见图6B)。从图5B中可以看到,细胞内Gd浓度随转染液中Gd-DO3A-INH浓度增加而增加;在随后的细胞传代过程中,细胞分裂及胞吐等过程导致细胞内Gd含量逐渐降低。特别值得注意的是,无论是T1加权信号还是T2加权信号,从第0天到第2天都呈现了一个显著的信号突降的过程,这个过程充分反映了2种不同结合状态Gd-DO3A-INH对细胞水质子的T1和T2弛豫过程的不同影响机制,及其在随后的细胞传代培养过程中进出细胞效率的不同。图6C中Gd-DOTA的T1弛豫速率在第0天显著加速,在随后的3天加速效应快速地衰减,由于Gd-DOTA电转染标记细胞时没有纳米团簇生成,因此它主要反映了游离态Gd-DOTA的细胞稀释效应,包括细胞增殖和胞吐2个过程的贡献。同样Gd-DO3A-INH的T1弛豫速率在第0天也显著加速,在随后的第2天和第4天这一加速效应快速衰减,基于其与Gd-DOTA结果的相似性,我们认为它主要反映的也是游离态Gd-DO3A-INH的细胞稀释效应。由于脉冲电转染标记过程和异烟肼的性质都有利于游离态Gd-DO3AINH进入细胞,因此标记的hMSCs在第0天含有大量的游离态Gd-DO3A-INH,呈现出显著的T1加速效应。在随后的细胞传代培养过程中,同样由于异烟肼的穿膜性质,游离态Gd-DO3A-INH会很快通过细胞的胞吐功能被排出细胞外,并在细胞的后续处理过程中被清除,因此传代培养的细胞水质子的T1弛豫速率快速恢复。图6D中Gd-DO3A-INH的T2弛豫速率也显著加速,一方面其加速的幅度远大于Gd-DOTA电转染标记的细胞的T2弛豫速率,另一方面,该加速效应衰减的速度要比后者慢很多,也比其本身的T1加速效应衰减的速度慢很多,因此我们认为T2加速效应主要反映的是Gd-DO3A-INH纳米簇引入的局部磁场不均匀对水质子T2弛豫过程的加速效应;而在随后的细胞增殖过程中,它的衰减速度要比T1加速效应慢得多,主要反映了Gd-DO3A-INH纳米簇在细胞中滞留时间长的性质。
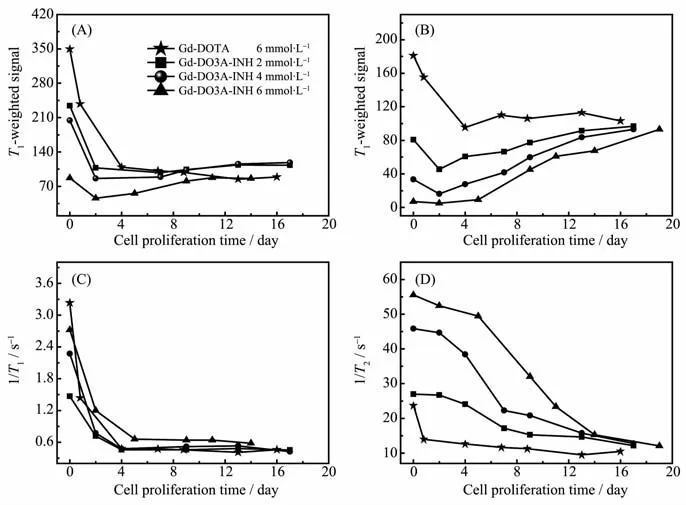
图6 Gd-DOTA和不同浓度Gd-DO3A-INH电转染标记hMSCs的(A)T1加权信号,(B)T2加权信号,(C)T1弛豫速率,(D)T2弛豫速率随传代培养时间的变化Fig.6 (A)T1-and(B)T2-weighted MRI signal,(C)T1-and(D)T2-relaxation rates of hMSCs labeled with Gd-DOTA and Gd-DO3A-INH via electroporation at different concentration as a function of cell proliferation time
Gd-DO3A-INH通过电转染进入细胞后,一部分自组装成数百纳米到数微米的簇状结构分布在细胞质中,一部分以游离态分布在细胞质中。游离态Gd-DO3A-INH有利于加速细胞水质子的T1弛豫速率,Gd-DO3A-INH纳米团簇有利于加速细胞水质子的T2弛豫速率。在第0天,胞内游离态Gd-DO3A-INH含量高,T1加速效应在MR信号强度中起主导作用,有利于信号增强。在传代培养2天后,大部分游离态Gd-DO3A-INH通过细胞的胞吐功能被排出细胞外,细胞内滞留的Gd-DO3A-INH纳米粒子与水分子的接触受到一定的限制,降低了其T1效应,导致T1加速效应在MR信号强度中的贡献快速衰减;同时处于聚集状态的造影剂使得细胞中的磁不均匀性显著增加,增强了其T2效应,T2加速效应的贡献突显,有利于信号减弱。因此从第0天到第2天,出现T1和T2加权信号显著衰减(图6A和B)。在随后的细胞传代过程中,T2加速效应在MR信号强度中起主导作用,且细胞中Gd-DO3A-INH纳米团簇浓度伴随细胞传代增殖过程逐渐降低,因此T1和T2加权信号逐渐恢复到无标记细胞水平(图6A和B)。
3 结 论
利用异烟肼(INH)的良好生物膜穿透性,合成了小分子MRI造影剂Gd-DO3A-INH,利用脉冲电转染技术标记间充质干细胞,可以有效提高游离态Gd-DO3A-INH进出细胞的效率,并诱导部分Gd-DO3A-INH在细胞质中自组装成纳米粒子。通过细胞传代实验和体外MRI清楚揭示了2种不同状态的Gd-DO3A-INH对细胞水质子T1和T2弛豫速率的不同影响机制:游离态Gd-DO3A-INH的T1加速效应显著,Gd-DO3A-INH纳米团簇的T2加速效应显著;在细胞传代过程中细胞内2种不同状态Gd-DO3A-INH的浓度涨落引起的MRI造影效果的变化:游离态Gd-DO3A-INH在细胞标记及随后的传代培养过程中进出细胞效率高,T1加速效应衰减快,Gd-DO3A-INH纳米团簇在细胞中滞留时间长,T2造影效果持续时间久。这些作用机制的揭示可以引导设计针对不同应用领域的MRI造影剂。
Supporting information is available at http://www.wjhxxb.cn
