连艾煎的体外抗氧化活性研究
2019-05-0623
23
1.广东药科大学药学院/广东省局部精准药物递药制剂工程技术研究中心,广东 广州 510006; 2.暨南大学生命科学技术学院,广东 广州 510632;3.广州暨南生物医药研究开发基地有限公司,广东 广州 510632
连艾煎方出《松峰说疫》卷二,其配方为黄连与艾叶,具有调中下气,清肠开噤之功效,主治瘟疫噤口下痢者[1]。黄连为毛茛科植物黄连CoptischinensisFranch.、三角叶黄连CoptisdeltoideaC. Y. Cheng et Hsiao或云连CoptisteetaWall.的干燥根茎。以上三种分别习称“味连”、“雅连”、“云连”。秋季采挖,除去须根和泥沙,干燥,撞去残留须根。味苦,寒。归心、脾、胃、肝、胆、大肠经[2]。艾叶为菊科植物艾ArtemisiaargyiLevLet Vant.的干燥叶。夏季花未开时采摘,除去杂质,晒干。艾叶气清香,味苦,艾叶味辛、苦,温;有小毒。归肝、脾、肾经[2]。黄连与艾叶皆为常用中药,针对黄连或艾叶单方已有大量现代研究[3-9]。近年来,有关中药复方的抗氧化研究备受广泛关注,然而连艾煎作为一种传统中药复方,但在维普、CNKI或Pubmed等中内外各文献库皆没检索出对连艾煎有任何现代研究,也没有对其抗氧化能力或药理作用的研究,本实验开展连艾煎的体外抗氧化活性研究,为连艾煎的进一步开发利用提供参考。
1 仪器与材料
1.1 仪器 电子天平(赛多利斯科学仪器有限公司);紫外分光光度计(岛津公司);荧光显微镜(尼康公司);电热炉(广州粤城电器厂);循环真空泵(河南省予华仪器有限公司);旋转蒸发器(海道夫公司),移液枪(艾本德公司)。
1.2 材料 黄连(产地:四川,批号:180801)、艾叶(产地:汕头,批号:20180901),均购于大参林广州心谊路店,经广东药科大学王治平副研究员鉴定确定为毛茛科、黄连属黄连CoptischinensisFranch.及菊科植物艾ArtemisiaargyiLevLet Vant.;1,1-二苯基-2-三硝基苯肼(DPPH)(规格1 g,纯度96%,批号:W26F7E10072,源叶生物公司);2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABT,批号E1506006,规格1 g,纯度98%,美国Aladdin公司);维生素C(规格100 g,纯度99.7%,批号20130315,%国药集团化学试剂有限公司);过硫酸钾(规格500 g,纯度99.5%,批号P112191,美国Aladdin公司);NAC(规格25 g,纯度99%,批号A105420,美国Aladdin公司);95%乙醇购自广州化学试剂厂;ROS检测试剂盒购自上海碧云天生物技术有限公司。
2方法
2.1 连艾煎的制备 连艾煎由黄连6 g,熟艾3 g组成。按处方取药材,温水浸泡30 min,加水100 mL,煎煮提取3次,每次60 min,过滤,合并滤液,浓缩至每1 mL药液含生药66 mg,即得。
2.2 溶液 配制61.8 μg/mL DPPH工作液:称取6.18 mg DPPH粉末,用无水乙醇溶解并定容至100 mL。ABTS+自由基储备液:称取9.67 mg ABTS 和64.26mg过硫酸钾于10 mL 的棕色瓶中,加蒸馏水定容至刻度线,避光静置过夜。

其中,A0为空白吸光度,A1为样品自身对照吸光度,A2为样品吸光度。
2.4 连艾煎对ABTS自由基的清除能力 根据文献方法进行ABTS自由基清除能力测定[14-15]。ABTS在适当的氧化剂作用下氧化成绿色的ABTS·+,在抗氧化物存在时ABTS·+的产生会被抑制,在734 nm或405 nm测定ABTS的吸光度即可测定并计算出样品的总抗氧化能力。实验时,用80%乙醇将ABTS+储备液稀释成所需工作液,使其在室温下于734 nm 处测得的吸光度在0.700 ± 0.020。取3.00 mL 新配制的浓度为ABTS+工作液置于10 mL具塞比色管中,使用移液枪分别加入6.06、12.12、18.18、24.24、30.30及36.36 μL的样品溶液,蒸馏水补充至4.00 mL,混匀后室温下避光反应30 min,在734 nm处测定其吸光度A2。另外再取3.00 mL 95%乙醇置于10 mL具塞比色管中,然后分别加入与样品管加入量相同体积的样品溶液,蒸馏水补充至4.00 mL,混匀后室温下避光反应30 min,在734 nm 处测定其吸光度A1,重复实验3次。清除率计算公式:
其中,A0为空白吸光度,A1为样品自身对照吸光度,A2为样品吸光度。
2.5 连艾煎对细胞内的活性氧簇(ROS)水平的影响 ROS水平检测实验根据参考文献[16],使用ROS检测试剂盒进行。DCFH-DA探针法是一种利用荧光探针DCFH-DA进行ROS检测的方法,DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH,而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内,细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。取处于对数期的RAW264.7细胞(2×107个)接种于6孔板,分为空白组、ROS阳性对照组(Rosup,ROS检测试剂盒提供,50 mg/L)、LPS组(100 μg/L)、LPS+ROS抑制剂(NAC,1.0 g/L)组、LPS+连艾煎组(1.5 g/L)、连艾煎自身对照组(1.5 g/L)。除ROS阳性对照组外,分别以相应药物刺激细胞24 h,ROS阳性对照组刺激2 h。在超净工作台中避光下,DCFH-DA探针(ROS检测试剂盒提供)用无血清培养基稀释,使DCFH-DA终浓度为4.9 mg/L,每孔加入1 mL的DCFH-DA探针,在细胞培养箱中避光孵育细胞1 h,使用无血清培养基在超净工作台中避光清洗3次,以充分去除未结合的游离的DCFH-DA探针;在荧光倒置显微镜下观察细胞内的荧光强度的变化,激发波长488 nm,检测波长525 nm,并对其进行拍照(200×)记录(激发时间10 s,曝光时间1 s)。同时,使用ImageJ图像处理软件对ROS荧光强度进行灰度分析,随机选取十个视野,获取平均光密度,根据光密度对各组ROS进行相对定量。
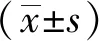
3 结果
3.1 连艾煎清除DPPH自由基试验 如表1所示,在一定的浓度范围内,连艾煎对DPPH自由基具有一定的清除能力,随着浓度的增加,对DPPH自由基的清除率也逐步增加。连艾煎清除DPPH自由基的IC50为(2391.21±41.85)mg/L,阳性药物维生素C清除DPPH自由基的IC50为(0.73±0.02)mg/L,两者之间的差异非常显著(P< 0.01)。

表1 连艾煎的DPPH自由基清除活性
3.2 连艾煎清除ABTS自由基试验 在一定的浓度范围内,连艾煎对ABTS自由基具有一定的清除能力,随着浓度的增加,对ABTS自由基的清除率也逐步增加。连艾煎清除ABTS自由基的IC50为(240.96±4.66)mg/L,阳性药物维生素C清除ABTS自由基的IC50为(1.14±0.04)mg/L,两者之间的差异非常显著(P<0.01),结果见表2。

表2 连艾煎的ABTS自由基清除活性
3.3 连艾煎对RAW264.7细胞ROS水平的影响试验 如图1所示,空白组的细胞没有检测出ROS荧光,LPS组和ROS阳性组都检测出明显的ROS亮斑,而ROS抑制剂NAC则抑制了LPS引起的ROS升高。从图1.e可以看出,连艾煎没有抑制LPS诱导的RAW264.7细胞的ROS产生,反而增加了其生成,在LPS+连艾煎(1.5 g/L)的ROS荧光比之前4组都要高。从图1.f可以看出,单用连艾煎刺激RAW264.7细胞也产生了类似的结果。使用ImageJ软件对ROS荧光进行灰度分析(图2),可知Rosup组和LPS组的ROS荧光都比空白组高,且差异非常显著(P< 0.01),LPS+连艾煎组ROS荧光比LPS组高,且差异具有高度统计学意义(P< 0.01),而连艾煎自身对照组ROS荧光则比空白组和LPS组都要高,且差异显著(P< 0.05),说明连艾煎自身可以引起细胞ROS升高。
4 讨论
4.1 连艾煎方 出《松峰说疫》卷二,其处方包括黄连及艾叶,具有调中下气,清肠开噤之功效,主治噤口痢,下痢赤白,腹中疼痛,里急后重,得食则吐者[1,17]。推测其解肠胃热毒功能可能与其抗氧化能力有关,故对其抗氧化能力作初步测试[18]。连艾煎体外抗氧化实验研究表明,连艾煎对DPPH及ABTS自由基具有一定的清除作用,虽然清除活性不如维生素C,但在一定范围内其抗氧化作用与浓度也能呈现良好的量效关系。为了进一步探究连艾煎的抗氧化能力,我们使用了RAW264.7细胞模型检测连艾煎对细胞ROS的影响。在细胞ROS实验中,可以明显看出ROS阳性对照(Rosup)、LPS都对细胞ROS荧光有显著升高作用(P< 0.01),同时,ROS抑制剂NAC显著抑制了LPS引起的ROS升高(P< 0.01),说明细胞ROS模型成功建立。LPS+连艾煎组显示出比LPS组更强的荧光(P< 0.01),说明连艾煎并不会抑制LPS引起的ROS升高,而相比空白组,连艾煎自身对照组显著地增强了细胞ROS荧光(P< 0.01),说明连艾煎自身会对细胞ROS产生有促进作用。与普通的抗氧化剂不同的是连艾煎在理化实验中显示出较强抗氧化活性,而在细胞实验中则可以升高ROS水平,这个现象是值得深入研究的。


研究表明ROS与很多病理过程具有密切联系,尤其是肿瘤[19-20]。Gorrini等发现胰岛素升高细胞内ROS水平,后者进一步促进肿瘤细胞增殖[21]。Helfinger等研究显示,高浓度的ROS可导致DNA损伤和突变,引起细胞恶性转化[22]。有研究发现,ROS介导的PI3K/Akt信号转导的过度激活利于肿瘤细胞存活以及促进化疗耐药[23-24]。因此,传统观点认为体内ROS升高可促进肿瘤形成、侵袭和转移,并基于此寻找具有强抗氧化活性的天然产物作为开发抗肿瘤药物的新方向[25]。
然而,ROS在癌症中的作用仍存在争议,最新的观点认为机体低水平的ROS能够增加癌症风险,升高ROS反而利于癌症治疗。哥德堡大学的一项研究指出抗氧化剂NAC和维生素E分别使肺癌小鼠的最大存活率降低了60%和50%[26-29]。此外,Lee等发现放射治疗使机体产生ROS能引起DNA损伤,从而破坏癌细胞[30]。Zhen和Hu等研究显示,在胶质母细胞瘤中,ROS水平升高会导致乳腺癌细胞对电离辐射的抗性降低,从而增强癌细胞对放射治疗的敏感性[31-32]。普通抗氧化剂有效地减少ROS的生成,从而使癌细胞的生长不受干扰,詹姆斯沃森(James Dewey Watson)甚至认为,抗氧化剂不但无助于预防癌症,还可能引发癌症[33-34]。
综上所述,关于ROS在癌症中的作用的研究日益增多,但学术界对ROS是致癌还是抗癌目前尚未有统一的观点,ROS作为肿瘤促进剂或抑制剂的作用都有大量证据支持,这种悖论被解释为适应性稳态,细胞内存在一种平衡,可能引起细胞损伤的活性物质也能激活保护细胞的生物途径,这种平衡取决于活性物质的浓度[35-36]。
氧化应激促进癌症发展和杀伤癌细胞的作用为两种相反的癌症治疗策略提供了不同的理论基础。一种方法是使用抗氧化剂提高ROS清除能力,从而消除ROS信号并抑制肿瘤生长,另一种相反的方法是用具有促氧化剂杀伤癌细胞,促氧化剂可增加ROS生成或消除癌细胞抗氧化系统[37]。连艾煎的抗氧化活性实验显示出连艾煎具有较强的抗氧化活性,同时可以升高细胞ROS水平。通过对连艾煎抗氧化活性的研究,在一定程度上预示连艾煎可能因为升高ROS带来健康风险,也可能成为一种避免细胞ROS减少而导致癌症风险增加,甚至可以通过引起ROS升高而增加癌细胞对放射治疗敏感度的抗氧化剂。连艾煎对肿瘤到底起到何种作用值得进一步研究。
