菊叶三七致肝小静脉闭塞病35例临床分析
2019-05-05赵利珍卞京京李燕敏陆召军高修银
赵利珍,卞京京,李燕敏,陆召军,高修银
作者单位:1徐州医科大学研究生学院,江苏 徐州 221002;2徐州医科大学公共卫生学院,江苏 徐州 221004;3徐州医科大学全科医学教研室,江苏 徐州 221004
肝小静脉闭塞病(hepatic veno-occlusive disease,HVOD)又称肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS),是由各种原因造成肝血窦、肝小静脉和小叶间静脉内皮细胞水肿、坏死、脱落从而形成微血栓,引起肝内淤血、肝损伤和门静脉高压的肝血管性疾病[1]。临床表现为腹胀、肝脏肿大、腹水、黄疸等。HVOD的病因较多,国内外明显不同,国外多为造血干细胞移植预处理后,国内多见于服用菊叶三七(土三七)发病。该病临床表现无特异性、早期容易误诊、无特效治疗方法、预后较差,故应引起临床医师的关注。
1 资料与方法
1.1 一般资料35例来源于徐州医科大学附属医院2011年6月至2017年6月住院的菊叶三七(土三七)导致肝小静脉闭塞病病人。临床资料均征得病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。男25例,女10例,年龄(61±9)岁,年龄范围为34~73岁,年龄>50岁的占86%。纳入标准:(1)确诊:病理提示中央静脉及小叶下静脉内膜显著肿胀,肝窦扩张瘀血明显,伴肝细胞不同程度肿胀、坏死,红细胞渗入狄氏间隙,呈典型的出血坏死性改变,可有中央静脉周围纤维化;(2)临床诊断:发病前有明确菊叶三七服药史;典型三联征(痛性肝大、黄疸、腹水);典型影像学改变:肝实质密度减低,延时期肝实质内呈“地图样”强化,肝脏密度不均匀减低,肝静脉显示不清或不显影。排除标准:(1)病理结果排除HVOD;(2)合并有病毒性、自身免疫性、代谢性、遗传性及布加综合征等其他肝病。
1.2 方法回顾性分析35例HVOD病人的病史、年龄、性别、病因、临床表现、实验室和影像学检查、治疗及预后。
1.3 疗效评估治愈:肝功能恢复正常,腹水完全消退。好转:症状减轻,肝功能有改善,腹水减少。未愈:症状无减轻,肝功能指标无好转或者恶化,腹水无减少。死亡。
1.4 统计学方法应用SPSS 19.0软件进行统计学处理,正态分布的计量数据用±s表示,行t检验;非正态分布的计量数据用[M(P25,P75)]表示,用非参数秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 病人服药的原因、方法与发病时间服药原因有:外伤11例,腰椎间盘突出、关节炎等6例,脑梗死5例,糖尿病3例,下肢静脉血栓形成1例,再生障碍性贫血1例,8例服药原因不详。服药方法有:水煎15例,泡酒7例,吞服4例,9例服药方法不详。发病时间:服药1周左右发病2例,10余天3例,20余天5例,1月余7例,2月余5例,3月余2例,4月余1例,1年3例,2年1例,另6例具体时间不祥。发病时间多在服药后1个月左右(59%)。
2.2 临床症状与体征临床表现有腹水(32/35)、腹胀(30/35)、纳差(25/35)、乏力(25/35)、肝肿大(23/35)、皮肤巩膜黄染(17/35)、尿少(15/35)、肝区疼痛(12/35)、下肢水肿(12/35)、脾大(10/35)、胸闷、气促(6/35),其中3例出现肝性脑病,查体发现2例腹壁静脉曲张,少数病人伴有发热、恶心、呕吐、腹泻等症状。
2.3 实验室检查入院时查血常规、凝血功能、肝功能、肾功能、肿瘤血清学指标等结果如下。白细胞(WBC)(7.4±3.2)×109/L,范围为(1.8~15.7)×109/L;血小板(PLT)中位数115×109/L,范围为(29~400)×109/L;凝血酶原时间(PT)中位数17.2 s,范围为12.4~29.4 s;丙氨酶氨基转移酶(ALT)中位数60.0 U/L,范围为12~1 297 U/L;天冬氨酶氨基转移酶(AST)中位数78 U/L,范围为19~1 800 U/L;谷氨酰转肽酶(GGT)中位数105 U/L,范围为23~753 U/L;碱性磷酸酶(ALP)中位数132 U/L,范围为54~867 U/L;血清清蛋白(ALB)(33.0±4.7)g/L,范围为22.3~43.1 g/L;总胆红素(TBil)中位数43.8 μmol/L,范围为6.7~243.8 μmol/L;血肌酐(Scr)中位数76.0 μmol/L,范围为50~250 μmol/L;血尿素氮(BUN)中位数6.86 mmol/L,范围为3.13~21.14 mmol/L。
其中19例检测血清糖类抗原CA125中位数294.40 U/mL,范围为103.00~4 483.20 U/mL;15例检测血清铁蛋白(365.79±251.47)ng/mL,范围为12.37~1 020.00 ng/mL;17例静脉血C反应蛋白中位数13.8 mg/L,范围为4.9~92.1 mg/L。
2.4 影像学检查35例中,24例本院彩超提示:肝脏肿大18例,肝脏回声不均,呈“豹纹状”或“斑片状”低回声15例,肝静脉变细或显示不清14例,下腔静脉肝后段受压变窄11例,脐静脉、副肝静脉重新开放3例,胆囊壁水肿、毛糙增厚21例,脾大11例,腹水19例。18例行CT检查,平扫见肝大、腹水16例,肝实质密度不均匀减低15例;增强扫描见肝实质强化延迟,强化不均,呈弥散性“地图状”或“斑片状”增强区和低灌注区12例(图1),腹腔积液12例,肝静脉纤细或显示不清10例,下腔静脉肝后段管腔狭窄5例。13例行MRI检查,12例肝实质强化不均(图2),11例腹水征,10例肝静脉纤细或显示不清,9例下腔静脉肝后段狭窄。2例行肝静脉、下腔静脉造影(DSA),均提示管腔通畅。此外见胸腔积液12例(双侧胸腔积液6例,右侧胸腔积液6例),心包积液3例。

图1 服用菊叶三七病人CT增强扫描肝实质强化不均,呈“斑片状”强化
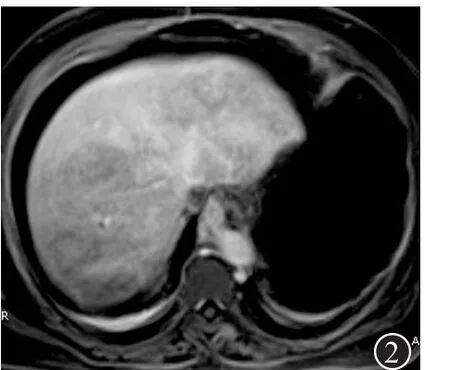
图2 服用菊叶三七病人磁共振扫描肝脏呈弥漫“地图状”强化
2.5 治疗和预后35例住院天数为3~41 d,中位住院天数17 d。35例入院后均停止服用菊叶三七,10例经抗凝治疗,1例行颈静脉肝内门体分流术(TIPS),1例用糖皮质激素治疗,所有病人给予利尿、护肝、退黄、活血化瘀、改善微循环、补充清蛋白、控制感染等综合治疗后,出院时情况为2例治愈、23例好转、6例自动出院、4例至上级医院。
2.6 随访病人的实验室指标、腹水穿刺及肝功能分级出院后1周至3年进行电话随访,失访3例,未愈/死亡13例,治愈/好转19例。对在访病人的实验室检查结果进行分析发现,未愈/死亡组病人PT延长,WBC、Scr、BUN水平较治愈/好转组升高(P<0.05),见表1。

表1 随访1~3年的服用菊叶三七病人实验室检查结果分组比较
23例行腹腔穿刺(另9例未行腹穿因为腹部超声提示少量腹水或中等量腹水,经利尿等对症处理,腹水减少、腹胀减轻,也有因病人拒绝腹穿),腹水检查提示漏出液为主(74%,17/23),2例为渗出液,4例介于渗出液和漏出液之间。
肝功能Child-Pugh分级显示:治愈/好转组中,Child-Pugh A级5%(1/19),Child-Pugh B级53%(10/19),Child-Pugh C级42%(8/19);未愈/死亡组中,Child-Pugh A级0(0/13),Child-Pugh B级23%(3/13),Child-Pugh C级77%(10/13)。
3 讨论
菊叶三七又名土三七、景天三七、三七草,为菊科植物的根或全草,有止血、止痛的功效,常用于治疗外伤和骨关节疼痛,容易与产自云南的五加科三七(又名参三七)相混淆。过量服用菊叶三七可导致严重的HVOD,HVOD正日益引起临床关注,Wang等[2]进行数据检索,发现至2015年期间国内报道菊叶三七致HVOD的有767例,菊叶三七致HVOD的概率为66%。
HVOD的发病机制尚不明确,目前多数研究认为,HVOD与菊叶三七所含吡咯烷生物碱(pyrrolizidine alkaloids,PAs)密切相关[3-5],不饱和PAs会被肝脏细胞色素P450代谢为脱氢吡咯烷生物碱,后者主要影响蛋白质合成和细胞分裂,而谷胱甘肽(GSH)能够与其反应,起到解毒作用,肝小叶第Ⅲ区的肝窦内皮细胞恰恰缺乏GSH,故该部位最先受损,进一步发展至纤维化,小静脉管腔狭窄,血流阻力增加,最终引起窦后性门静脉高压症。
本研究显示男性和中老年人是服用菊叶三七致HVOD的主要高危人群,这可能与中老年人群受教育文化程度有关,对中草药认识不够,容易轻信民间土方,男性喜欢茶饮有关。外伤是服用菊叶三七的常见原因,因此临床上遇到外伤后出现不明原因的急性肝损伤、腹水,均应详细询问近期有无服用中草药史。
本研究死亡组病人的白细胞计数明显高于治愈/好转组,可能与死亡组病人继发腹膜炎、肺部炎症等有关。凝血功能异常在HVOD的发生发展中起重要作用,动物实验揭示[6],菊叶三七对大鼠血液系统的影响是减少血小板数量、抑制血小板聚集、导致凝血时间延长,本研究中死亡组病人较治愈/好转组病人的PT明显延长。本研究中死亡组病人Scr、BUN水平均较治愈/好转组升高,提示合并肾损伤的病人预后欠佳。有研究发现CA125和铁蛋白升高是HVOD的危险因素[7-8],在本研究中同样发现,CA125和血清铁蛋白水平均为正常参考上限2倍以上,可能为该病早期诊断和干预提供一定价值的参考。另外本研究还发现,腹水性质多数为门脉高压性腹水,也为诊断该病提供依据;肝功能分级中,治愈/好转组以Child-Pugh B级为主(53%),未愈/死亡组以Child-Pugh C级居多(77%),肝功能分级为Child-Pugh C级者预后差。
目前国际公认的HVOD诊断标准是Seatile标准和Baltimore标准[9]。由于国内HVOD病因主要以服用PAs植物引起者居多,因此,中华医学会消化病学分会肝胆疾病协作组参照以上标准,制定了南京标准[10](适用范围PAs-HVOD),即有明确服用含PAs植物史,且符合以下3项或经过病理确诊,同时需排除其他已知病因造成的肝损伤,此3项标准为:(1)腹胀和(或)肝区疼痛、肝大和腹水;(2)血清总胆红素升高或其他肝功能异常;(3)典型的增强CT或MRI表现。对于实验室及影像学检查不典型的疑诊病人,建议行肝活检,有大量腹水者,可采用经颈静脉肝活组织检查术(TJLB),从而降低操作相关风险,并可行肝静脉压力梯度(HVPG)测定来评估门静脉压力。共识意见指出HVOD需注意与布-加综合征(BCS)、失代偿期肝硬化、急性重型肝炎等疾病的鉴别诊断[10]。
HVOD目前尚无特效疗法,主要以内科保守治疗为主。王轶等[11]在一项单中心回顾性研究中总结了85例HVOD病人不同治疗方案的中长期随访,结果提示急性期/亚急性期病人应尽早给予抗凝治疗。本研究10例抗凝治疗的病人中,8例好转出院,2例至上级医院治疗,出院后随访,6例好转,3例死亡,1例失访,提示早期抗凝、改善循环治疗确有一定疗效。糖皮质激素在本病治疗中有抗炎、抗纤维化的作用,但存在使感染加重的风险[12],本研究1例使用激素治疗效果不佳。去纤苷(DF)是唯一被证明有效的预防和治疗骨髓造血干细胞移植相关HVOD的药物[13],但由于DF目前在我国尚未上市,故对HVOD的疗效尚不清楚。对于内科治疗效果不佳者,在充分评估获益及风险后,可考虑行TIPS控制顽固性腹水和门静脉高压[14]。对于合并肝衰竭内科治疗无效的病人,可考虑行肝移植术[10],但限于组织器官来源短缺,迄今国内尚无HVOD病人行肝移植的研究文献报道[15]。
由于HVOD病程相对较短,诊治困难,尚无特效治疗,预后较差。因此,临床医生、药剂师应提高对该病的认识,做好用药宣教,推动药物性肝损伤的防治工作,减少菊叶三七导致HVOD的发生[16]。
