肺癌根治术式对老年肺癌病人围术期T淋巴细胞亚群及肿瘤微转移的影响
2019-05-05李冬冬楚社录
李冬冬,楚社录
作者单位:三门峡市中心医院胸外科,河南 三门峡 472000
肺癌是临床常见恶性肿瘤之一,发病率及死亡率均高居所有恶性肿瘤首位,严重威胁人类生命健康[1]。目前,手术治疗仍为早期肺癌的首选治疗手段。传统开胸手术虽术野清晰、操作简便,但术中需行肋骨切断、撑开等操作,造成较大创伤,应激反应剧烈,对病人免疫功能有直接抑制作用,且易增加肿瘤微转移,不利于病人术后康复及预后[2]。近年来,随着胸腔镜手术(video-assisted thoracscopic surgery,VATS)的不断发展,胸腔镜肺癌根治术已成为治疗早期肺癌的手术方式之一。相比于传统开胸手术,胸腔镜手术具有切口小、创伤小、美观度高、术后并发症少、术后恢复快等多种优势[3]。胸腔镜肺癌根治术治疗肺癌的疗效已为众多研究肯定,应用也逐渐广泛,但关于其是否能够减轻肿瘤微转移至今尚无定论。本研究回顾性分析比较胸腔镜肺癌根治术与传统开胸手术的疗效,并探讨其对围术期肿瘤微转移及T淋巴细胞亚群的影响。现报告如下。
1 资料与方法
1.1 一般资料病例来源于2015年6月至2017年6月三门峡市中心医院胸外科收治的限期行肺癌根治术病人。纳入标准:(1)术前诊断为非小细胞肺癌,且全身骨扫描及脑MRI、胸部CT等影像学检查,确定不存在远处转移病灶;(2)术后病理证实为非小细胞肺癌;(3)肿瘤直径小于6 cm,且多为周围型;(4)术前未接受放化疗治疗;(5)无手术禁忌证;(6)年龄≥60岁。排除标准:(1)术前血常规、尿常规、大便常规、凝血机制及免疫功能均存在明显异常者;(2)胸腔镜术中转开胸者;(3)合并其它类型恶性肿瘤或既往存在其他恶性肿瘤史者;(4)临床资料不齐全者。共纳入168例,根据采取手术方式不同分为胸腔镜组(n=75)和开胸组(n=93)。胸腔镜组:男51例,女24例;年龄(71.42±5.87)岁;病变部位,左上叶、左下叶、右上叶、右中叶、右下叶分别15例、19例、17例、5例、19例;病理类型,腺癌、鳞癌、腺鳞癌、其他分别63例、2例、6例、4例;TNM分期,Ⅰa期、Ⅰb期、Ⅱa期、Ⅱb期分别50例、12例、8例、5例;肿瘤直径(3.39±0.95)cm。开胸组:男66例,女27例;年龄(72.21±6.13)岁;病变部位,左上叶、左下叶、右上叶、右中叶、右下叶分别19例、24例、21例、6例、23例;病理类型,腺癌、鳞癌、腺鳞癌、其他分别78例、2例、7例、6例;TNM分期,Ⅰa期、Ⅰb期、Ⅱa期、Ⅱb期分别64例、16例、7例、6例;肿瘤直径(3.68±1.13)cm。两组一般资料比较差异无统计学意义(P>0.05),均衡可比。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1胸腔镜组 行胸腔镜下肺癌根治术。采取全身麻醉,病人取健侧卧位,行单肺通气。于腋中线第7与第8肋之间做一长约1.0~1.5 cm切口,作为观察孔,将30°胸腔镜由此置入,观察胸腔状况,探查病灶部位、大小及与周围组织粘连情况等;选择在腋前线第4与第5肋之间做一长约4.0~5.0 cm切口,作为主操作孔,在腋后线第7与第9肋之间做一长约1.5~2.0 cm切口,作为辅操作孔;术前已取得明确诊断者,直接行肺癌根治术,疑诊者则行肿块外周切除或穿刺活检,术中快速冰冻病理明确为恶性肿瘤,即行解剖性肺叶切除,予以肺动脉、肺静脉、支气管等游离,再以直线切割缝合器一一切断,并以直线切割缝合器处理肺裂,切除组织由主操作孔取出,并置入标本袋。
1.2.2开胸组 行传统开胸肺癌根治术。麻醉方法、病人体位同胸腔镜组。手术切口为标准后外侧切口,横断背阔肌、前锯肌,于第5与第6肋之间入胸腔,做25~30 cm切口,逐层切开皮肤、肌肉、胸膜后入胸,切除病变肺叶,清扫淋巴结。
两组均行常规淋巴结清扫,左侧清扫5~12组,右侧清扫第2~4、7、9~12组。清扫完毕后,以生理盐水彻底冲洗胸腔;明确止血彻底及肺部无漏气后,放置胸腔闭式引流,逐层缝合切口,手术完毕。术后予以抗感染、镇痛、祛痰、雾化等对症治疗,并指导病人早期康复训练。
1.3 观察指标(1)比较两组手术时间、术中出血量、术后引流管放置时间、术后引流量、淋巴结清扫数目、术后住院时间及术后并发症(包括肺部漏气、肺部感染、心律失常、低氧血症等)发生情况。
(2)比较两组术后1 d、3 d、7 d疼痛视觉模拟评分(visual analogue scale,VAS);VAS评分范围为0~10分,评分越高表示疼痛程度越严重。
(3)比较两组术前及术后3 d外周血C反应蛋白(CRP)及白细胞介素-6(IL-6)水平,CRP、IL-6检测方法均为酶联免疫吸附法。
(4)比较两组术前及术后3 d外周血T淋巴细胞亚群(包括水平及NK细胞水平,检测采用流式细胞仪进行。
(5)比较两组术前及术后3 d外周血基质金属蛋白酶-7mRNA(matrix metalloproteinases-7mRNA,MMPs)、可溶性主要组织相容性复合体Ⅰ类相关分子A(soluble MHC class I-related chain A,sMICA)、血管内皮生长因子(VEGF)表达水平,其中MMPs-7mRNA表达水平采用RT-PCR法检测,sMICA、VEGF表达水平采用酶联免疫吸附法检测。
1.4 统计学方法应用SPSS 20.0软件处理研究数据,计量资料采用±s描述,比较采用t检验;计数资料采用例(%)描述,比较行χ2检验;重复测量数据比较,采用重复测量数据方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组手术情况比较两组手术时间、淋巴结清扫数目比较差异无统计学意义(P>0.05);胸腔镜组较开胸组术中出血量、术后引流管放置时间、术后引流量及术后住院时间均明显减少(P<0.05),术后并发症发生率明显降低(P<0.05)。见表1。
2.2 两组术后疼痛VAS评分比较经整体分析(两因素重复测量方差分析)显示,疼痛VAS评分的组间、时间及交互作用的整体均差异有统计学意义(P<0.05)。组内比较:两组术后疼痛VAS评分随着时间进展,均呈降低趋势(P<0.05);组间比较:胸腔镜组术后1 d、术后3 d、术后7 d的疼痛VAS评分均明显低于开胸组(P<0.05)。见表2。
2.3 两组手术前后CRP、IL-6水平比较术前,两组CRP、IL-6水平比较差异无统计学意义(P>0.05)。术后3 d,两组CRP、IL-6水平较术前明显升高(P<0.05),且胸腔镜组显著低于开胸组(P<0.05)。见表3。
2.4 两组手术前后T淋巴细胞亚群及NK细胞水平比较术前,两组及NK细胞水平比较差异无统计学意义(P>0.05)。术后3 d,胸腔镜组及NK细胞水平与术前比较差异无统计学意义(P>0.05),开胸组CD+4/CD+8及NK细胞水平较术前均明显降低(P<0.05),且治疗后两组比较差异有统计学意义(P<0.05)。见表4。
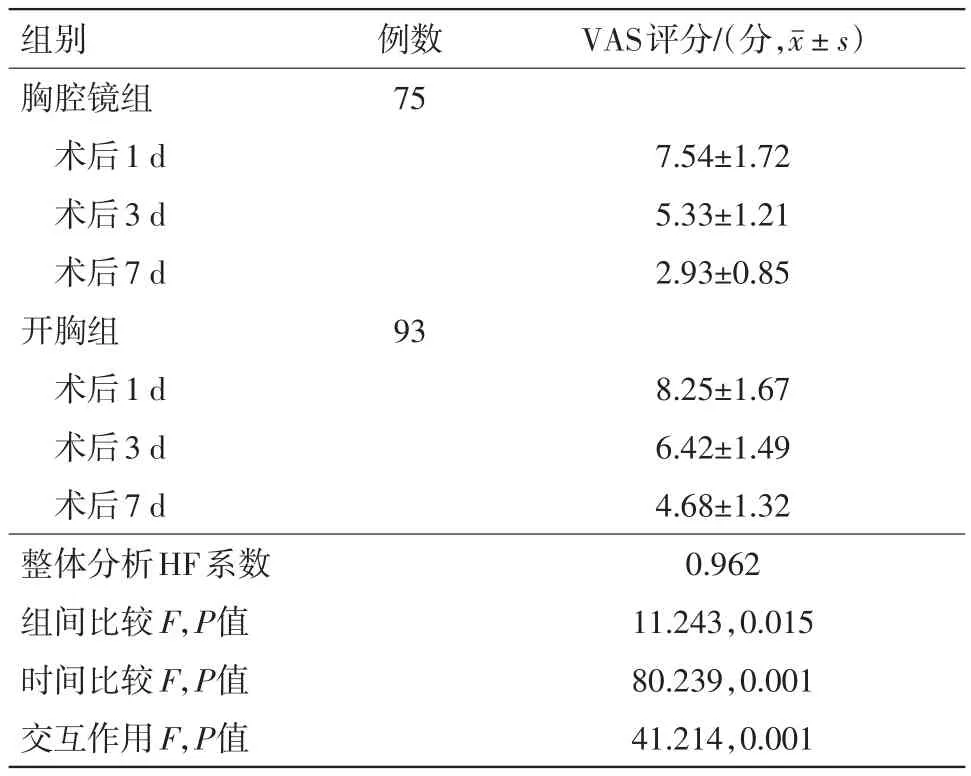
表2 非小细胞肺癌168例行不同术式肺癌根治术术后疼痛VAS评分比较
表3 非小细胞肺癌168例行不同术式肺癌根治术手术前后CRP、IL-6水平分组比较/± s
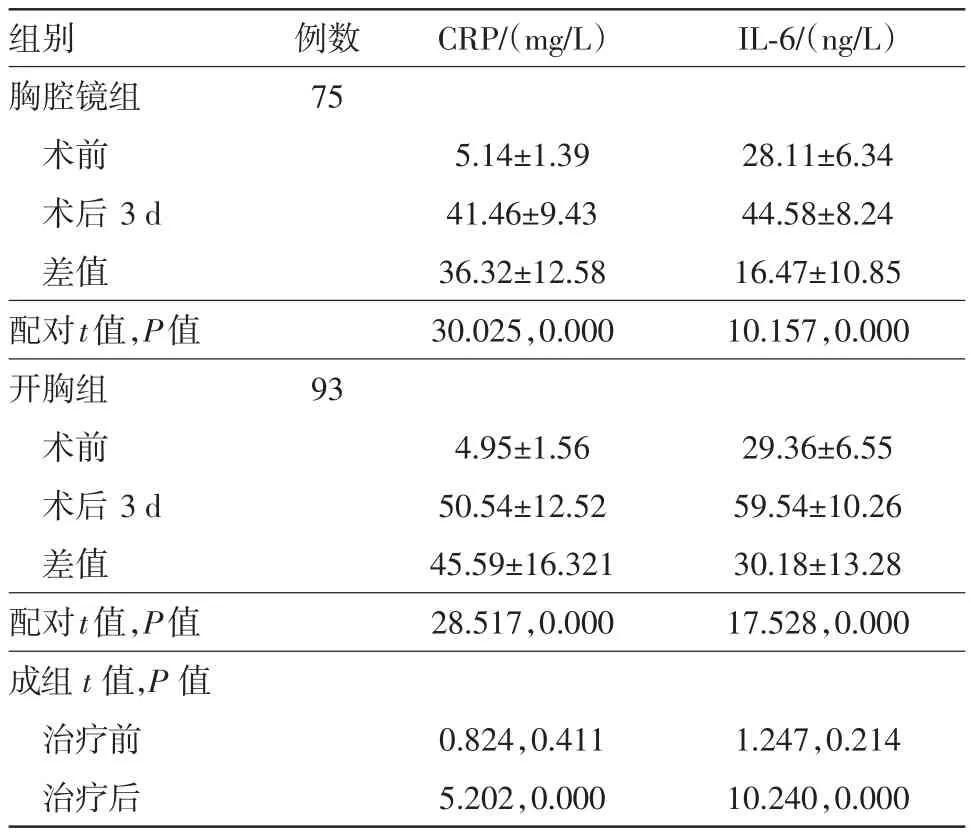
表3 非小细胞肺癌168例行不同术式肺癌根治术手术前后CRP、IL-6水平分组比较/± s
组别胸腔镜组术前术后3 d差值配对t值,P值开胸组术前术后3 d差值配对t值,P值成组t值,P值治疗前治疗后例数75 93 CRP/(mg/L)5.14±1.39 41.46±9.43 36.32±12.58 30.025,0.000 4.95±1.56 50.54±12.52 45.59±16.321 28.517,0.000 0.824,0.411 5.202,0.000 IL-6/(ng/L)28.11±6.34 44.58±8.24 16.47±10.85 10.157,0.000 29.36±6.55 59.54±10.26 30.18±13.28 17.528,0.000 1.247,0.214 10.240,0.000
2.5 两组术前术后外周血MMP-7mRNA、sMICA、VEGF表达水平比较术前,两组外周血MMP-7mRNA、sMICA、VEGF表达水平比较差异无统计学意义(P>0.05)。术后3 d,两组MMP-7mRNA、sMICA、VEGF表达水平较术前明显降低(P<0.05),且胸腔镜组显著低于开胸组(P<0.05)。见表5。
表1 非小细胞肺癌168例行不同术式肺癌根治术手术情况比较/±s
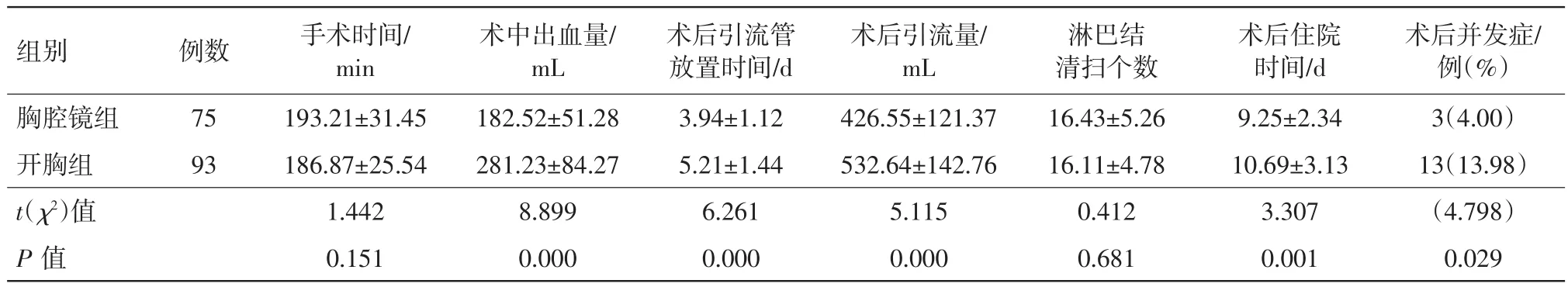
表1 非小细胞肺癌168例行不同术式肺癌根治术手术情况比较/±s
组别胸腔镜组开胸组t(χ2)值P值例数75 93手术时间/min 193.21±31.45 186.87±25.54 1.442 0.151术中出血量/mL 182.52±51.28 281.23±84.27 8.899 0.000术后引流管放置时间/d 3.94±1.12 5.21±1.44 6.261 0.000术后引流量/mL 426.55±121.37 532.64±142.76 5.115 0.000淋巴结清扫个数16.43±5.26 16.11±4.78 0.412 0.681术后住院时间/d 9.25±2.34 10.69±3.13 3.307 0.001术后并发症/例(%)3(4.00)13(13.98)(4.798)0.029
表4 非小细胞肺癌168例行肺癌根治术手术前后T淋巴细胞亚群及NK细胞水平分组比较/±s
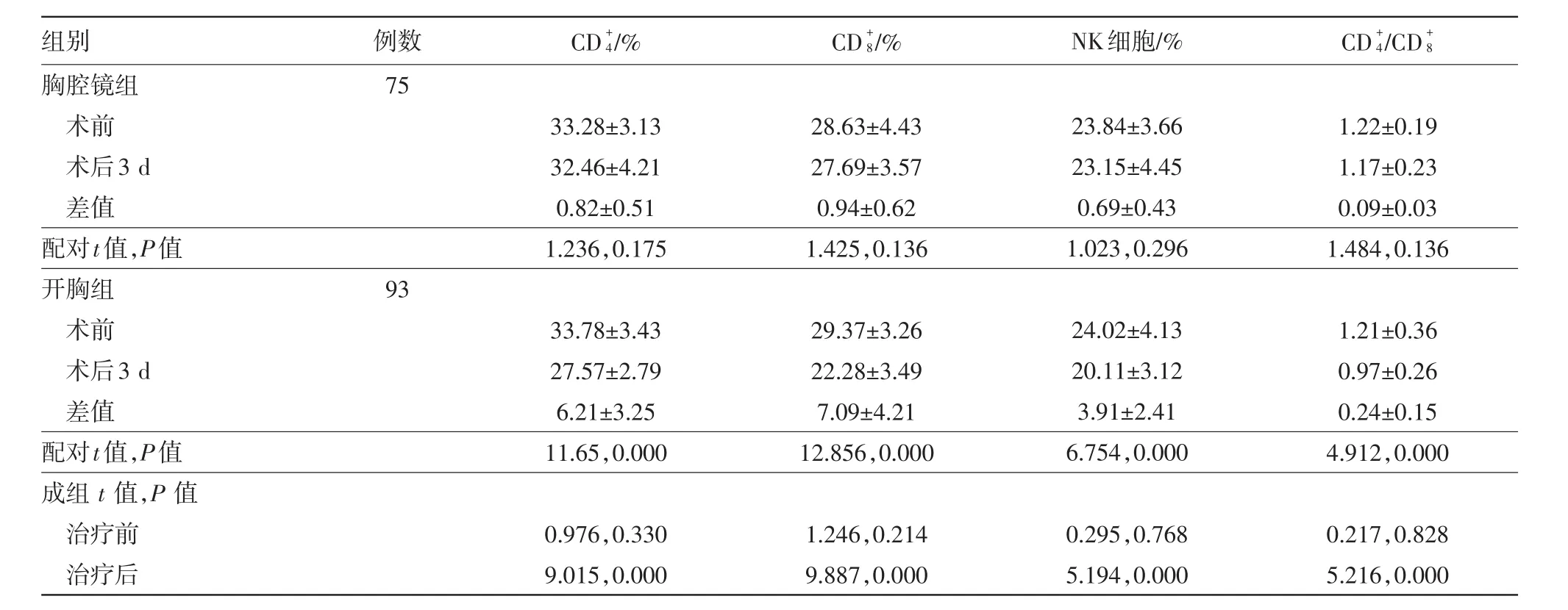
表4 非小细胞肺癌168例行肺癌根治术手术前后T淋巴细胞亚群及NK细胞水平分组比较/±s
组别胸腔镜组术前术后3 d差值配对t值,P值开胸组术前术后3 d差值配对t值,P值例数75 93 CD+4/%33.28±3.13 32.46±4.21 0.82±0.51 1.236,0.175 33.78±3.43 27.57±2.79 6.21±3.25 11.65,0.000 CD+8/%28.63±4.43 27.69±3.57 0.94±0.62 1.425,0.136 29.37±3.26 22.28±3.49 7.09±4.21 12.856,0.000 NK细胞/%23.84±3.66 23.15±4.45 0.69±0.43 1.023,0.296 24.02±4.13 20.11±3.12 3.91±2.41 6.754,0.000 CD+4/CD+8 1.22±0.19 1.17±0.23 0.09±0.03 1.484,0.136 1.21±0.36 0.97±0.26 0.24±0.15 4.912,0.000成组 t值,P值治疗前治疗后0.976,0.330 9.015,0.000 1.246,0.214 9.887,0.000 0.295,0.768 5.194,0.000 0.217,0.828 5.216,0.000
表5 非小细胞肺癌168例行肺癌根治术术前术后外周血MMP-7mRNA、sMICA、VEGF表达水平分组比较/±s

表5 非小细胞肺癌168例行肺癌根治术术前术后外周血MMP-7mRNA、sMICA、VEGF表达水平分组比较/±s
组别胸腔镜组术前术后3 d差值配对t值,P值开胸组术前术后3 d差值配对t值,P值成组t值,P值治疗前治疗后例数75 93 MMP-7mRNA 29.25±7.25 20.41±4.56 8.84±6.32 9.542,0.000 30.21±6.98 24.55±5.36 5.66±3.25 6.171,0.000 0.871,0.330 5.315,0.000 sMICA/(pg/mL)382.45±92.43 291.54±67.87 90.91±61.55 7.215,0.000 379.18±87.56 322.58±74.43 56.60±53.21 12.856,0.000 0.235,0.000 2.794,0.006 VEGF/(ng/mL)2.12±0.52 1.64±0.43 0.48±0.37 6.054,0.000 2.07±0.46 1.89±0.51 0.18±0.12 2.512,0.015 0.661,0.510 5.357,0.000
3 讨论
自1992年Roviaro等[4]最先报道VATS治疗肺癌以来,历经20多年发展,胸腔镜肺癌根治术已成为临床治疗早期肺癌的有效术式之一。循证医学证据显示,胸腔镜下肺癌根治术具有与传统开胸根治术类似的根治效果[5]。传统开胸切除采取标准后外侧入路方式,这种入路可使胸腔各结构得以暴露,但需行背阔肌、前锯肌切断,同时要求撑开肋骨,这都会造成较大手术创伤。与开胸肺癌切除相比较,胸腔镜肺癌切除具有术中出血少、术后恢复快、术后并发症少、住院时间短等多种优势,更为微创[6]。本研究结果显示,术中出血量、术后引流管放置时间、术后引流量及术后住院时间均明显减少,术后并发症发生率及术后疼痛VAS评分明显降低,与众多研究[7-8]一致,充分体现了胸腔镜肺癌根治术的微创性。淋巴结切除是评估肺癌分期的重要指标,与病人预后密切相关[9]。而目前关于胸腔镜肺癌根治术的淋巴结清扫效果临床仍存在较大争议,是影响其推广的重要因素。本研究结果显示,胸腔镜组与开胸组淋巴结清扫数目比较差异无统计学意义,与任军龙等[10]研究一致,表明胸腔镜肺癌根治术具有与开胸肺癌根治术相似的淋巴结清扫效果,原因可能在于VATS视野清晰,有利于进行纵隔淋巴结清扫。
无论何种手术方式,均难免对机体造成应激反应。众多证据显示,手术应激可引起机体免疫损伤,进而增加术后感染及术后肿瘤微转移风险[11]。研究表明,手术对免疫功能抑制程度与手术创伤程度、术中出血水平、术后疼痛程度等多种因素有关[12]。对于围手术期肿瘤病人而言,机体免疫功能关系着术后恢复快慢及术后肿瘤扩散情况,当机体免疫功能低下时,机体免疫监视能力降低,易于引起肿瘤微转移[13]。因此,尽可能减轻手术创伤及应激,对保护机体免疫功能,减少肿瘤微转移有重要意义。CRP、IL-6等炎症介质在手术创伤后可出现明显增高,与手术创伤的严重程度密切相关[14]。研究表明,通常情况下,CRP将在术后2~3 d达到峰值[15]。故本研究检测了术后3 d时CRP、IL-6水平,结果显示,术后3 d,胸腔镜组较开胸组外周血CRP、IL-6水平均明显降低,这进一步证实胸腔镜肺癌根治术能够减轻手术创伤及应激反应。细胞免疫在肿瘤免疫应答中发挥着重要作用,而T淋巴细胞亚群及NK细胞水平是反映机体细胞免疫功能的重要指标[16]。本研究结果显示,术后3 d,胸腔镜组及NK细胞水平与术前比较差异无统计学意义,且明显高于开胸组,表明胸腔镜肺癌根治术对机体细胞免疫功能有保护作用。胸腔镜下肺癌切除使用超声刀、直线切割缝合器等,较传统开胸肺癌切除,能够提高术中止血效果,减少术中出血,降低对机体细胞免疫与体液免疫功能的影响,且操作创伤小,保留了胸廓的完整性,减少了对神经、肌肉造成的损伤,从而减轻手术应激,利于术后免疫功能恢复。术后肿瘤微转移与肺癌病人预后密切相关,其受机体免疫功能、细胞外基质重塑等多种因素影响[17]。MMP-7在多种肿瘤组织中呈过度表达,能够破坏机体对肿瘤浸润、转移作用产生抑制屏障。sMICA是在肿瘤细胞死亡时,细胞表面MICA蛋白脱落至外周血中而形成,其能够抑制细胞及NK细胞杀伤活性,促进肿瘤逃逸。VEGF在血管及淋巴管生长上发挥着重要作用,其能够增强血管通透性,促进肿瘤基质形成,增强肿瘤转移活性。研究表明,MMP-7mRNA、sMICA、VEGF在肺癌病人肿瘤转移微环境形成中扮演着重要角色,与肺癌发生发展密切相关[18]。另有研究显示,肺癌病人VEGF表达水平与外周血水平呈负相关,提示肿瘤微转移可能是影响机体免疫功能的因素之一[19]。本研究结果显示,术后3 d,胸腔镜组MMP-7mRNA、sMICA、VEGF表达水平均明显低于开胸组,提示胸腔镜肺癌根治术能够降低肺癌病人围术期肿瘤微转移因子水平,改善肿瘤转移微环境。
综上所述,胸腔镜肺癌根治术较传统开胸肺癌根治术,具有创伤小、术后应激反应轻、术后并发症少、术后恢复快等优势,能够保护围术期细胞免疫功能,降低血清肿瘤微转移因子水平。本研究亦存在不足,即缺少两种手术方式下远期复发、转移、生存情况的对比,未来有待通过进一步随访观察。
