Lucy-tag促进海七鳃鳗嗅觉受体细胞膜表达
2019-05-05李伟明任建峰张庆华
高 翔,张 哲,李伟明,任建峰,祖 尧,张庆华
(上海海洋大学1. 水产种质资源发掘与利用教育部重点实验室、2. 海洋生物科学国际联合研究中心、3. 国家水生动物病原库,上海 201306;4. 密歇根州立大学渔业与野生生物系,美国密歇根 东兰辛 48824)
G蛋白偶联受体(G protein-coupled receptor, GPCR)是一类重要的细胞表面7次跨膜受体超家族,能够转导激素、神经递质、趋化因子以及光线等物理、化学的细胞外信号[1]。全世界目前有将近1/3的GPCR小分子药物作为其拮抗剂和激活剂,因此,GPCR是优异的肿瘤药物作用靶点[2]。基于7个跨膜结构域不同层次的同源性,GPCR成员可分4类:视紫红质类(Rhodopsin)(A类)、分泌素和黏素(Mucin)类(B类)、代谢型谷氨酸(Metabolic glutamate)类(C类),以及卷曲型/苦味嗅觉受体TAS2(bitter taste receptor 2)类[3]。视紫红质受体家族是 GPCR 超家族中最大的家族[4]。在脊椎动物中,GPCR配体类型非常广泛,包括多肽、胺、嘌呤等。该家族可被进一步分为 α、β、γ 和 δ 亚类[5],视紫红质δ 类中的嗅觉受体包括388个受体。根据编码嗅觉受体基因的结构不同[6],在进化关系上嗅觉受体被分为5个彼此独立的家族:主嗅觉受体(main olfactory receptors,MORs)[7]、犁鼻器Ⅰ型受体(vomeronasal type-1 receptors,V1Rs) 、犁鼻器Ⅱ型受体(vomeronasal type-2 receptors,V2Rs)[8]、痕量胺相关受体(trace amine-associated receptors,TAARs)[9]以及甲酰基肽受体(formyl peptide receptors, FPRs)[10]。
嗅觉受体(olfactory receptor,OR)基因首先由Buck等[7]在褐家鼠(Rattusnorvegicus) 中分离得到。由于海七鳃鳗具有已知的脊椎动物最小的嗅觉受体家族,包括27个ORs、28个TAARs和4个V1Rs[11],因此,成为研究嗅觉受体与配体关系及作用机制的良好模型。本研究通过对海七鳃鳗的嗅觉受体的N端加以Rho-tag及Lucy-tag修饰,检测其在HEK293T细胞膜表面表达,并验证了Lucy-tag不影响海七鳃鳗嗅觉受体的固有活性,也不影响GPCR的IP3信号转导,为进一步探究嗅觉受体蛋白的功能奠定了一定的理论基础。本研究结果为GPCR的膜表达提供了有利的方法,并为充分利用海七鳃鳗具有已知最小的嗅觉受体家族这个优势,系统分析嗅觉受体识别配体的规律提供基础,为哺乳类受体的功能研究提供可借鉴的依据。
1 材料与方法
1.1 材料
1.1.1细胞株 HEK293T细胞系,由海军军医大学医学免疫学国家重点实验室曹雪涛教授惠赠。
1.1.2试剂 分子克隆T载体pMD19-T载体(6013),购自TaKaRa公司;哺乳动物细胞系表达载体pCMV-Tag-2b (211172),购自Agilent Technologies公司;小鼠受体转运蛋白重组表达载体pCI-mRTP1s、小鼠嗅觉型G蛋白α亚基重组表达载体pCI-Gαolf,由美国杜克大学H. Matsunami教授馈赠;萤火虫荧光素酶报告基因载体CRE-Luciferase vector pGL4.29(E847A),购自Promega公司;加强型绿色荧光蛋白重组表达载体pEGFP-N1(6085-1),购自Clontech公司。20种海七鳃鳗的嗅觉受体基因中,主嗅觉受体有1681.OR230、275288.OR230、13499.OR262、7812.OR322、922.OR354、3267.OR361、3267.OR408、107483.OR345-1、107483.OR345-2、107483.OR345-3、GL476599.fa_247108_248121-R、GL478569.fa_174252_175250、GL480420.fa_10877_11839;犁鼻器Ⅰ型受体有2061.V1R320;痕量胺相关受体有2594.TAAR340、7446.TAAR346a、7446.TAAR346b、14718.TAAR353、22166.TAAR354、 GL486090.fa_3064_4137。20个嗅觉受体由本实验室克隆,只在N端修饰Rho-tag时,不能膜表达的嗅觉受体有7个,分别为13499.OR262、GL476599.fa_247108_248121-R、1681.OR230、7446.TAAR346b、3267.OR408、GL478569.fa_174252_175250、2594.TAAR340;低表达(表达率<10%)的嗅觉受体有4个, 分别是275288.OR230、3267.OR361、7812.OR322、GL486090.fa_3064_4137;中等表达(10%<表达率<20%)的嗅觉受体有8个,分别是107483.OR345-3、107483.OR345-2、2061.VIR320、107483.OR345-1、GL480420.fa_10877_11839、922.OR354、14718.TAAR353、22166.TAAR354;高表达(表达率>20%)的嗅觉受体有1个,是7446.TAAR346a(选此受体为受体膜表达的阳性对照)。人源白介素8受体基因HCXCR1,从野生型HeLa细胞基因组中克隆得到;人IL-8/CXCL8蛋白,购自北京义翘神州科技有限公司,货号:10098-HNAE-20(aa 28-99);感受态细菌DH5α,购自天根生化科技(北京)有限公司,货号:CB101;DMEM高糖培养基,购自HyClone公司;X-treme GENE HP DNA Transfection reagent,购自罗氏公司;抗Rho-tag标签单抗(clone 4D2),购自Millipore公司;钙流检测试剂盒Fluo-4 NW Calcium Assay Kit,购自Life Technology公司;荧光素酶检测试剂盒Steady-Glo®Luciferase Assay System,购自Promega公司。
1.1.3仪器 CO2培养箱(Eppendorf公司);荧光显微镜Observer.Z1(卡尔蔡司公司);酶标仪SYNERGY2(BioTeK公司);钙流工作站FlexStation3(Molecular Devices公司)。
1.2 细胞培养HEK293T细胞培养于DMEM高糖培养基中,内含10%灭活胎牛血清,置于37 ℃、含5% CO2培养箱中培养。
1.3 构建重组质粒Lucy-Rho-pCMV-OR海七鳃鳗由本实验室引自美国五大湖支流,由实验动物伦理委员会密歇根州立大学动物保护管理委员会批准使用。提取海七鳃鳗的肝脏组织DNA,将其DNA作为模板,再通过海七鳃鳗的数据库中基因信息设计引物,将Rho-tag以及Lucy-tag分别连接到pCMV-OR质粒上,从而构建Lucy-Rho-pCMV-OR重组质粒。通过免疫细胞化学法(immunocytochemistry, ICC)检测Lucy-tag对海七鳃鳗嗅觉受体膜表达的促进作用,实验分5组:第1组,将重组质粒Lucy-Rho-pCMV-OR、pEGFP-N1及mRTP1s进行共转染;第2组,将重组质粒Rho-pCMV-OR、pEGFP-N1及mRTP1s进行共转染;第3组,只转染pEGFP-N1质粒,用于指示转染效率,来确定嗅觉受体的表达量是否与转染效率相关;第4组,只转染pCMV空载质粒作为第3组阴性对照(即EGFP的阴性对照);第5组,将pCMV空载和pEGFP-N1质粒共转染,作为第1组和第2组的阴性对照(即ICC检测受体表达的阴性对照)。其浓度均为1 mg·L-1。mRTP1s、pEGFP-N1和ORs构成了转染基因复合物,所使用的转染试剂与转染基因复合物的体积质量比是1 ∶1(μL ∶μg)。之前的研究表明,Rho-pCMV-7446.TAAR346a在没有Lucy-tag时,也能够很好地表达在HEK293T细胞膜上,且表达水平较高,由此我们将Rho-pCMV-7446.TAAR346a作为固有表达受体的阳性对照组。
1.4 ICC检测Lucy-tag对海七鳃鳗嗅觉受体膜表达的促进作用将转染试剂与转染复合物按照实验量加入到无血清的培养液中,混匀,分别加入相应的384孔中,在28 ℃孵育15 min后,取对数生长期HEK293T细胞,按照细胞密度的要求,将细胞接种至384孔板(5.5×103个/孔),在含5%的CO2培养箱中37 ℃培养,转染后12 h,更换含0.5%血清的培养基。24 h后,通过观察荧光显微镜下细胞转染情况,计算转染效率。继续培养至48 h,进行嗅觉受体膜表达检测分析。转染48 h后,弃掉原培养液,用PBS(pH=7.4)洗涤细胞3次,每次2 min,用4%的多聚甲醛室温下固定15 min,弃固定液,PBS洗涤细胞3次,每次2 min,加入封闭缓冲液(5% BSA的PBS液)封闭1 h,加入含有一抗的1% BSA的PBS封闭液,400 r·min-1离心3 min,置于70 r·min-1摇床上4 ℃孵育过夜,弃掉含有一抗的废液,PBS洗涤3次,每次2 min,避光加入含有二抗和DAPI的1% BSA的PBS封闭液,置于摇床上室温130 r·min-1孵育1 h,最后,PBS洗3次,每次2 min,使用荧光显微镜(激发光488 nm)在低倍镜(×10)下,计算转染效率和膜表达效率,每个实验重复3次,求其平均值及标准差。
1.5 双萤光素酶报告基因法检测Lucy-tag对嗅觉受体固有活性的影响将G蛋白(Gαolf)、受体转运蛋白(mRTP1s)、报告基因(pGL4.29),以及所需要的质粒Lucy-Rho-pCMV-7446.TAAR346a、Rho-pCMV-7446.TAAR346a、转染试剂X-treme GENE HP DNA Transfection reagent按照实验量分别加入相应的无血清培养液,Rho-pCMV-7446.TAAR346a为阳性对照,Rho-pCMV和Lucy-Rho-pCMV为阴性对照。按照Log103数量级进行浓度梯度稀释,取对数生长期HEK293T细胞,按照细胞密度的要求,将细胞接种至384孔板(7.5×103个/孔),在含5% CO2的培养箱中37 ℃ 培养,转染后48 h,向每个孔内加入10 μL的Luciferase荧光染料,用ELISA读板,3次技术重复,以及3次生物学重复后,统计数据[12-13]。
1.6 钙流法检测Lucy-tag对IP3信号通路的影响已有文献报道[14],人源白介素8的受体基因与HCXCR1之间有明确的钙流激活关系。因此,购买商品化的人源白介素8蛋白,从HeLa细胞克隆其受体基因HCXCR1作为钙流检测的阳性对照,分别构建重组质粒Rho-pCMV-HCXCR1和Lucy-Rho-pCMV-HCXCR1,即一组只带Rho-tag,另一组带Rho-tag和Lucy-tag双标签,将其转染到HEK239T细胞上进行表达,对于表达成功的Rho-pCMV-HCXCR1和Lucy-Rho-pCMV-HCXCR1用于钙流检测。

2 结果
2.1 Lucy-tag对海七鳃鳗嗅觉受体膜表达的促进作用通过ICC检测Lucy-tag对海七鳃鳗嗅觉受体膜表达的促进作用,计算绿色荧光细胞与总细胞数目的比值。结果发现,无论目的基因上是否带有Lucy-tag,其转染效率均为30%~40%,初步说明Lucy-tag对其转染效率不产生影响(Fig 1)。然而,通过计算红色荧光细胞与总细胞数目的比值,发现当目的基因N端Rho-tag前修饰Lucy-tag时,20个嗅觉受体基因中,共有13个嗅觉受体的膜表达效率有不同程度的提高,其提高程度从高至低依次为:GL486090.fa_3064_4137、2594.TAAR340、22166.TAAR354、7812.OR322、3267.OR408、GL478569.fa_174252_175250、14718.TAAR353、GL480420.fa_10877_11839、922.OR354、3267.OR361、7446.TAAR346a、275288.OR230、7446.TAAR346b。这13个嗅觉受体包括4个只有Rho-tag修饰时不表达的受体,4个只有Rho-tag修饰时低表达率受体,4个只有Rho-tag修饰时中表达率受体,1个只有Rho-tag修饰时高表达率受体。3个嗅觉受体13499.OR262、GL476599.fa_247108_248121-R、1681.OR230膜表达效率不受Lucy-tag的影响。4个嗅觉受体2061.V1R320、107483.OR345-3、107483.OR345-1、107483.OR345-2的膜表达效率有所下降(Fig 2、Tab 1),说明了Lucy-tag对海七鳃鳗大部分嗅觉受体具有明显的促进作用。

Fig 1 The transfection effect of sea lamprey (Petromyzon marinus) olfactory receptor on HEK293T cell membrane surface
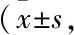
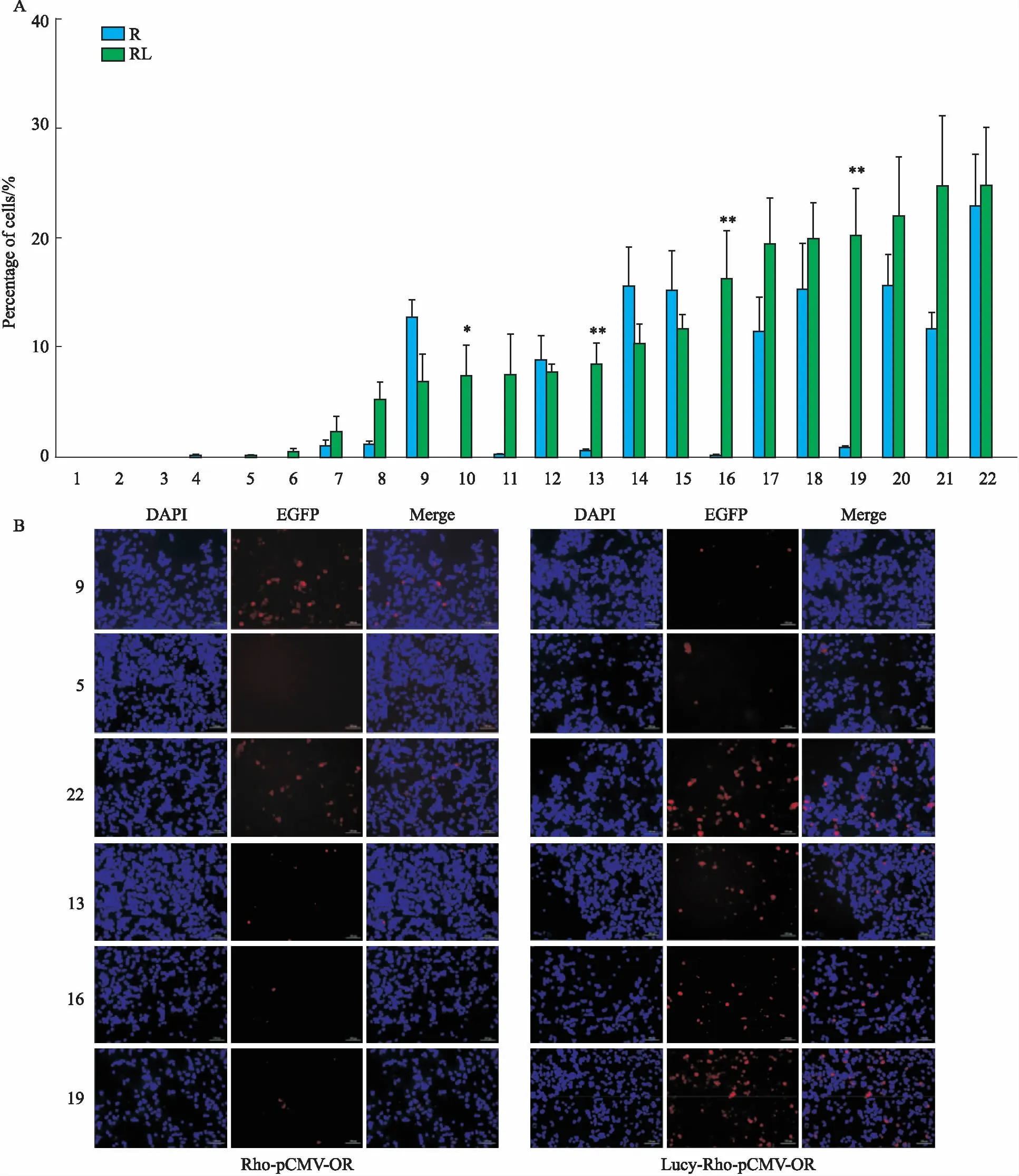
Fig 2 The expression effect of sea lamprey(Petromyzon marinus) olfactory receptor on HEK293T cell membrane surface
2.2 Lucy-tag对嗅觉受体固有活性无影响为进一步了解Lucy-tag在促进海七鳃鳗嗅觉受体膜表达的同时,是否影响了受体的固有活性,我们将重组质粒Lucy-Rho-pCMV-7446.TAAR346a以及Rho-pCMV-7446.TAAR346a进行转染,其中Rho-pCMV和Lucy-Rho-pCMV为阴性对照,48 h后统计结果显示,Lucy-tag对嗅觉受体的固有活性无明显影响(Fig 3)。

Tab 1 Trafficking of olfactory receptors in absence and presence of Lucy-tag
-:No detectable OR surface expression; +:OR surface expression detected in the majority of fields of view (>20% of all fields of view); *:OR surface expression detected in the majority of fields of view (<15% of all fields of view).
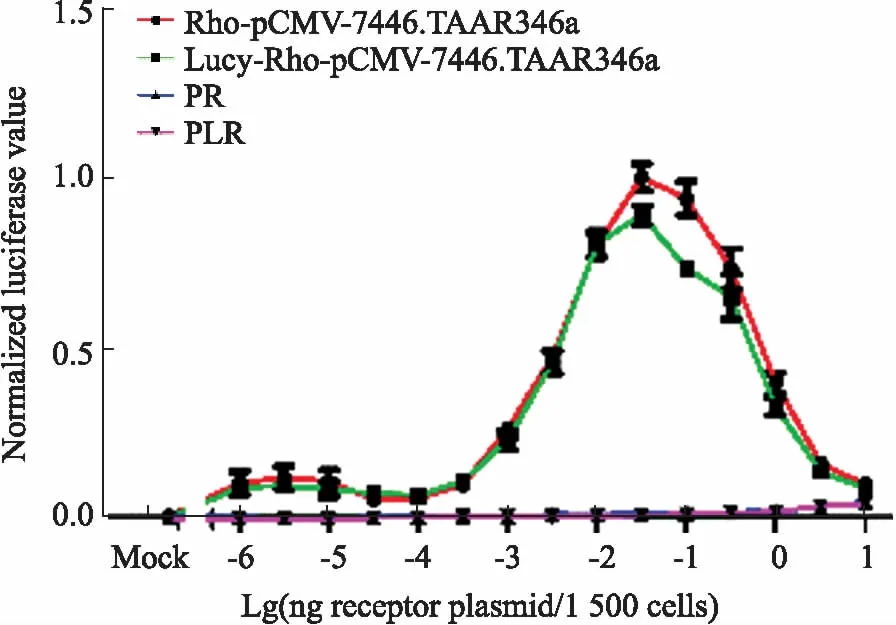
Fig 3 Effect of Lucy-tag on intrinsic activity of
X axis represents the transfection concentration gradient of the olfactory receptor ofPetromyzonmarinus, Y axis represents the fluorescence signal value of the olfactory receptor ofPetromyzonmarinus. Blue curve: Rho-pCMV, Violet curve: Lucy-Rho-pCMV.
2.3 Lucy-tag对IP3信号通路无影响用钙流工作站(FlexStation3)检测过表达Lucy-Rho-pCMV-HCXCR1和Rho-pCMV-HCXCR1的HEK293T细胞,在HCXCL8蛋白刺激下细胞内钙离子浓度变化,未转染的HEK293T细胞以Hank's平衡盐溶液刺激为阴性对照。Fig 4结果显示,在30~35 s时(加样后第13~18 s),Lucy-Rho-pCMV-HCXCR1实验组(HCXCR1-PLR,蓝色曲线)较Rho-pCMV-HCXCR1实验组(HCXCR1-PR,红色曲线)出现更高的峰值,阴性对照组无反应。说明在相等的细胞数量下,HCXCR1在相同剂量的同源配体白介素8重组蛋白的刺激下,是由于受体的表达量升高,引起HEK293T细胞对配体的反应增强。因而说明Lucy-tag促进了人白介素-8的受体CXCR1的膜表达,进一步表明Lucy-tag在促进受体表达的效率上具有重要作用,也进一步说明Lucy-tag在促进受体的膜表达的同时,并不影响IP3的信号通路。

Fig 4 Effect of Lucy-tag on IP3 signaling pathway n=3)
X axis represents detection time, Y axis represents the fluorescence signal value of calcium ions in cells, and the black arrow represents the sample being stimulated on 17th second. Blue curve: HCXCL8 stimulated Lucy-Rho-pCMV-HCXCR1; Red curve: HCXCL8 stimulated Rho-pCMV-HCXCR1; Green curve: Assay buffer stimulated wild type HEK293T cell.
3 讨论
本研究利用一段富含亮氨酸的跨膜蛋白Lucy-tag,将海七鳃鳗的嗅觉受体进行修饰,构建了重组质粒Lucy-Rho-pCMV-OR,在20个嗅觉受体中,不同程度地促进了13个海七鳃鳗嗅觉受体在HEK293T细胞膜表面的表达,这为嗅觉受体蛋白的正确定位,探究其基因表达机制提供了前提和基础。为筛选和鉴定嗅觉受体基因提供了技术手段,为进一步开发新的药物奠定了理论基础。
哺乳动物嗅觉受体的异源细胞表达系统较为成熟,而海七鳃鳗嗅觉受体的异源细胞表达系统的研究并不充分。基于本课题组前期的研究结果,即使海七鳃鳗嗅觉受体的N端修饰有Rho-tag,61个嗅觉受体中仍然有7个不表达,4个低表达,说明Rho-tag并非对所有的嗅觉受体的膜表达都有效。我们利用Lucy-tag大大提高了这些不能被Rho-tag很好修饰表达的嗅觉受体膜表达效率。但是仍然有一些嗅觉受体不能很好地表达,引起嗅觉受体膜表达的因素很多,包括嗅觉受体转运蛋白、细胞系、抗体特异性、密码子偏好性、GC含量、氨基酸突变、标签电荷性质等。由于缺少海七鳃鳗的嗅觉受体转运蛋白的同源基因和相应的细胞系,实验中使用的依然是小鼠的受体转运蛋白和人胚肾HEK293T细胞系,因此会对七鳃鳗嗅觉受体的表达有一定的影响,具体原因有待进一步研究。受体的固有活性与某些疾病的发生密切相关,并且受体的固有活性会随其在细胞中表达量的增加而增加[2]。我们将带有Lucy-tag的海七鳃鳗嗅觉受体STIG_7446.TAAR346a进行其固有活性探究,结果发现,Lucy-tag对海七鳃鳗嗅觉受体STIG_7446.TAAR346a并不产生明显影响。另外,通过钙流实验发现,Lucy-tag也不影响HCXCR1和HCXCL8相互作用的IP3信号通路,这为研究GPCR固有活性提供了新思路。因此,我们认为,Lucy-tag不影响嗅觉受体的功能,其有良好的标记应用潜力。
(致谢:本实验嗅觉受体的筛选工作完成于美国密歇根州立大学渔业与野生生物系,分析鉴定处理工作的完成得到本实验室同学的帮助,感谢上海海洋大学季策、周泽斌等同学的工作。)
