灯盏乙素对心肌缺血/再灌注损伤的保护作用及机制
2019-05-05季宇彬马晓玉陈荣昌杨龙坡孙桂波孙晓波
季宇彬,马晓玉,陈荣昌,杨龙坡,孙桂波,孙晓波
(1. 哈尔滨商业大学药物工程技术研究中心,黑龙江 哈尔滨 150076;2.中国医学科学院,北京协和医学院药用植物研究所药理毒理中心,北京 100094)
近年来,缺血性心肌病的发病率不断上升,严重威胁着人类的健康。随着溶栓疗法、心外科技术的不断进步[1],急性心肌梗死患者的死亡率已逐渐降低,然而,再灌注造成的损伤仍然给患者带来严重的伤害。因此,心肌缺血/再灌注损伤(MIRI)仍然受到广泛的关注。灯盏乙素(scutellarin,Scu)是从菊科植物灯盏细辛中提取的黄酮类化合物,目前主要用于冠心病、心绞痛、中风、缺血性脑卒中等疾病的治疗[2]。现代药理研究表明,Scu具有扩张血管、改善微循环、抗缺血损伤等作用[3],但其对心脏保护的具体作用机制尚不明确。本实验通过建立大鼠离体心脏心肌缺血/再灌注损伤模型,研究Scu对心肌缺血/再灌注损伤的保护作用及机制,为其临床应用提供理论依据。
1 材料与方法
1.1 实验动物SPF级SD大鼠70只,♂,体质量280~350 g,由北京维通利华实验动物技术有限公司提供,合格证号:SCXK(京)2012-0001。
1.2 药物与试剂Scu标准品,购于上海融禾医药科技发展有限公司。乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、谷草转氨酶(aspartate aminotransferase,AST)、考马斯亮蓝蛋白检测试剂盒,均购自南京建成生物医学工程研究所;白介素1β(interleukin 1β,IL-1β)、IL-18、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)、IL-6 ELISA试剂盒,均购于北京海泰通达科技有限公司;一抗β-actin、NF-κB、NLRP3、IL-1β,均购自Abcam公司;辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、ECL化学发光显色试剂盒、BCA试剂盒、细胞质细胞核蛋白提取试剂盒,均购自康为世纪生物科技有限公司。
1.3 仪器ML870八通道生理记录仪、PL3508B2-220Langendorff离体心脏灌流系统(埃德仪器国际贸易上海有限公司-PowerLab);Minipuls 3型蠕动泵(吉尔森);Infinite M1000酶标仪(瑞士Tecan公司);电泳仪、电泳槽、凝胶成像仪(美国Bio-Rad公司)。
1.4 方法
1.4.1离体心脏Langendorff灌流模型的制备 SD大鼠经20%乌拉坦(腹腔注射)麻醉后,舌下静脉注射肝素钠(25 mg·kg-1)行肝素化。迅速开胸,并取出心脏(保留足够长的主动脉),立即将动脉针套入主动脉并用缝合线扎紧,悬挂于Langendorff灌流装置上,以恒温(37.5 ℃),充二元氧(95% O2+5% CO2混合气体),配制K-H,成分如下(g·L-1): NaCl 6.891 2、NaHCO32.09、KCl 0.350 15、KH2PO40.160 6、MgSO4·7H2O 0.290 8、CaCl20.283、葡萄糖1.998,pH 7.4。K-H液以恒流速12 mL·min-1持续逆流灌流15 min。待心脏活动稳定后,通过八通道生理记录仪记录心肌收缩功能,包括左室内压(left ventricular systolic pressure,LVSP)、室内压最大上升速率(+dp/dtmax)、室内压最大下降速率(-dp/dtmax)、心率(heart rate,HR)。离体心脏以K-H液灌流15 min平衡后,即可进行造模。本实验采用全心缺血/再灌注损伤模型造模,即全心停灌30 min,再灌45 min,造成心肌缺血/再灌注损伤。
1.4.2Scu对心肌缺血/再灌注损伤的影响 SD大鼠70只,随机分成5组(n=14):空白组(Control)、模型组(I/R)、Scu高(HD)、中(MD)、低(LD)剂量组。Scu用生理盐水配制为0.3、3、30 mg·kg-1,按10 mL·kg-1腹腔注射给药,给药组每日给药1次,连续给药7 d,空白组和模型组同时给予等量生理盐水。末次给药60 min后,分离心脏,置于Langendorff离体灌流装置上,空白组和模型组用K-H液灌流,Scu低、中、高剂量组用含Scu(0.3、3、30 mg·L-1)的K-H液灌流。在左心耳根部剪一小口,将球囊插入左心室(接ML870数据采集系统),实时记录心肌收缩功能:LVSP、±dp/dtmax、HR。各组心脏平衡15 min后,模型组、Scu低、中、高剂量组行缺血/再灌注操作,造成心肌缺血/再灌注损伤。空白组心脏平衡后,持续灌流45 min。
1.4.3心肌组织HE染色 每组取6颗心脏,剪左心室,用4%多聚甲醛固定,常规石蜡包埋,制作切片,脱蜡后行HE染色,光镜下观察心肌细胞呈红色,细胞核呈蓝色,每张切片在100倍光学显微镜下观察,并随机选取5个视野拍照。
1.4.4心肌组织生化指标检测 每组取8颗心脏,选左心室同一部位组织,按1 ∶9质量体积比加入生理盐水进行匀浆,4 ℃、3 000 r·min-1离心10 min,取上清液用于生化指标检测。按照试剂盒说明书,分别测定心肌组织LDH、CK、AST水平,ELISA法测定心肌组织炎性因子TNF-α、ICAM-1、IL-1β、IL-18、IL-6水平。沉淀部分保存于-80 ℃,用于Western blot检测。
1.4.5Western blot检测心肌组织蛋白表达 心肌组织匀浆后,3 000 r·min-1离心10 min,取沉淀,加入组织裂解液重悬,于4 ℃裂解1 h ,12 000 r·min-1离心15 min,收集上清液即为总蛋白,细胞核蛋白提取按核蛋白抽提试剂盒操作说明进行。BCA法测定蛋白浓度,每组取20 μg的总蛋白,12% SDS-PAGE分离蛋白,用电转移法将蛋白质转移至PVDF膜,5%脱脂奶粉室温封闭3 h,分别加入NLRP3、NF-κB、IL-1β、β-actin、Lamin B一抗,4 ℃过夜;TBST溶液洗涤3次×5 min,加入辣根素过氧化酶标记的二抗,室温孵育4 h,TBST溶液洗膜3次×5 min,ECL化学发光法显影。

2 结果
2.1 Scu对离体大鼠心肌收缩功能的影响如Fig 1所示,与空白组比较,再灌注45 min时,模型组LVSP、+dp/dtmax、-dp/dtmax、HR明显下降(P<0.05)。与模型组比较,Scu中、高剂量组LVSP、+dp/dtmax、HR明显升高,Scu低、中、高剂量组-dp/dtmax明显升高(P<0.05)。表明Scu可以明显改善缺血/再灌注心肌的收缩功能。
2.2 Scu对离体大鼠心肌组织AST、CK、LDH活性的影响如Tab 1所示,与空白组比较,模型组心肌组织中AST、CK、LDH活性明显升高(P<0.05),表明心肌组织发生损伤。与模型组比较,Scu剂量依赖性降低心肌组织LDH、CK、AST活性,其中Scu中、高剂量组差异有显著性(P<0.05)。表明Scu可以明显改善离体大鼠心肌缺血/再灌注损伤。
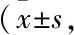
Tab 1 Effects of Scu on LDH, CK and AST release in myocardial tissue after I/R injury n=8)
*P<0.05vscontrol;#P<0.05vsI/R model
2.3 Scu对离体大鼠心肌组织病理结构的影响如Fig 2所示,显微镜下观察心肌组织,空白组心肌纤维排列整齐,横纹清楚,胞核清晰可见,细胞形态正常,心肌结构基本无异常。模型组心肌排列疏松、紊乱,有多处断裂,间质增宽伴随水肿现象,心肌细胞核浓缩,可见多处变性坏死灶,程度较重,心肌纤维间可见大量炎细胞浸润。与模型组相比,Scu中、高剂量组病变均有不同程度减轻。
2.4 Scu对离体大鼠心肌组织ICAM-1、IL-1β、IL-6、IL-18、TNF-α水平的影响如Tab 2所示,与空白组比较,模型组大鼠心肌组织ICAM-1、IL-1β、IL-6、IL-18、TNF-α水平明显升高(P<0.05)。与模型组相比,Scu可以剂量依赖性降低心肌组织各炎症因子水平。其中Scu低、中、高剂量组ICAM-1、TNF-α降低差异具有显著性(P<0.05),Scu中、高剂量组IL-18、IL-6、IL-1β降低差异具有显著性(P<0.05)。表明Scu对大鼠心肌缺血/再灌注损伤的保护作用可能与抑制炎性因子的生成有关。
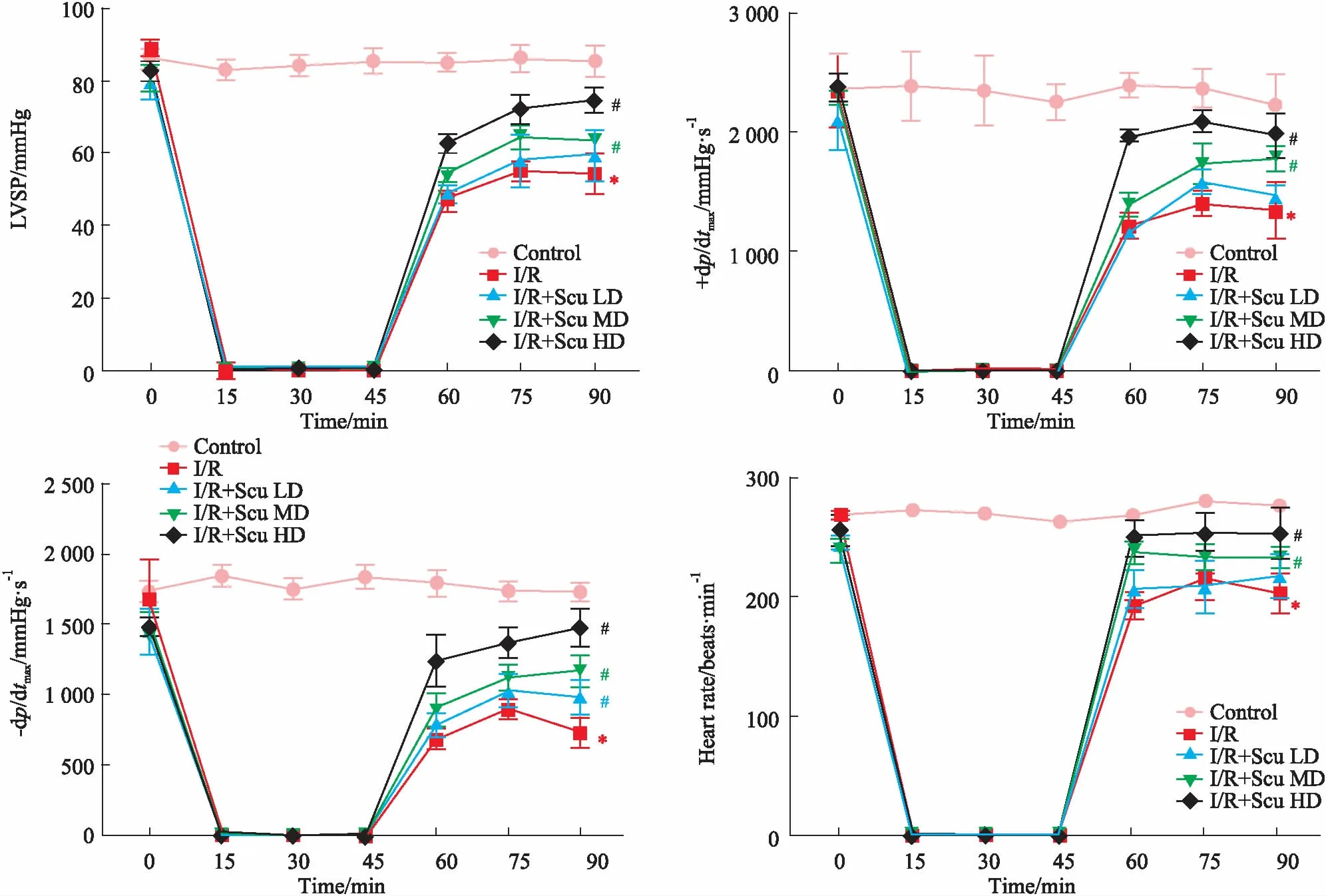
Fig 1 Effects of Suc on LVSP, +/-dp/dtmax and HR (1 mmHg=0.133 kPa) n=15)
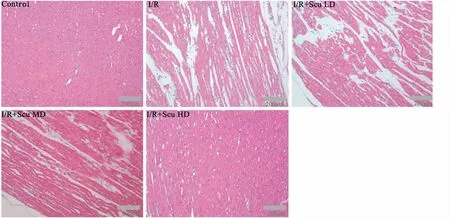
Fig 2 Effect of Scu on isolatedmyocardial ischemia/reperfusioninjury in rats(HE,×200)

Tab 2 Effects of Scu on IL-1β, IL-18, IL-6, TNF-α and ICAM-1 release in myocardial tissue after I/R injury (ng·L-1, n=8)
*P<0.05vscontrol;#P<0.05vsI/R model
2.5 Scu对心肌组织IL-1β、NLRP3蛋白表达的影响炎症小体可以调节炎症因子的生成与释放,NLRP3是炎症小体的重要组成蛋白,因此,本研究通过Western blot检测心肌组织中NLRP3及下游IL-1β的水平。如Fig 3所示,与空白组比较,模型组IL-1β和NLRP3的蛋白含量明显升高(P<0.05);与模型组比较,Scu各组明显降低IL-1β表达水平(P<0.05),Scu中、高剂量明显降低心肌组织NLRP3蛋白表达(P<0.05)。表明Scu可能通过抑制NLRP3表达,进而抑制炎症小体活化及炎性因子的生成。
2.6 Scu对心肌组织NF-κB核转位的影响NF-κB是体内非常重要的炎性信号通路,Western blot结果显示(Fig 4),模型组细胞核内NF-κB水平明显升高(P<0.05),而Scu可以剂量依赖性降低NF-κB的核转位,Scu中、高剂量组差异具有显著性(P<0.05)。以上研究结果提示,Scu抗炎作用可能是通过抑制NF-κB信号通路来实现的。
Fig 3 Effect of Scu on protein expression of
1:Control;2:I/R;3:I/R+Scu LD;4:I/R+Scu MD;5:I/R+Scu HD.*P<0.05vscontrol;#P<0.05vsI/R model.
3 讨论
近年来,缺血性心肌病的发病率不断上升,严重威胁着人类的健康,其中缺血心肌恢复供血引起的MIRI越来越受到人们的关注。随着药物溶栓、冠脉搭桥术、瓣膜置换术、心脏移植等治疗技术手段的提高和广泛应用,探索防治MIRI的药物已成为重要研究方向[4-5]。

Fig 4 Effect of Scu on protein expression of NF-кB in myocardial tissues n=8)
1:Control;2:I/R;3:I/R+Scu LD;4:I/R+Scu MD;5:I/R+Scu HD.*P<0.05vscontrol;#P<0.05vsI/R model.
LVSP、±dp/dtmax、HR是反映心功能的重要指标。LVSP是左心室收缩时产生的强大内在压力,其值反映左室的功能状态。±dp/dtmax是左室内压最大下降速率和左室内压最大上升速率,其值反映心肌舒张功能。本研究显示,Scu可明显提高LVSP、±dp/dtmax、HR,改善左心室收缩与舒张功能。LDH、CK、AST是心肌损伤的标志物,当心肌组织发生病变时,LDH、CK、AST的含量明显升高。研究显示,Scu可明显下调缺血/再灌注心肌组织中LDH、CK、AST的含量。结合心肌组织病理观察,表明Scu可以减轻缺血/再灌注心肌组织的损伤,改善心肌收缩功能。
炎症反应在MIRI过程中起到非常重要的作用。心肌缺血初期及再灌注过程中,均会激发心肌细胞内源性的炎症反应,诱导大量促炎因子的生成及释放。炎性因子不仅引起心肌电生理重构和心律失常,还直接改变心肌细胞的生理状态,诱发氧自由基的生成、细胞膜功能障碍和损伤,引起钙超载,使心肌细胞严重受损,大量细胞凋亡、坏死、纤维化,进而导致心力衰竭而危及生命,抑制心肌炎症反应对治疗MIRI具有非常重要的意义[6]。多种炎性因子参与了MIRI,其中IL-1β是调节炎症反应的关键因子,其参与了免疫细胞的募集,为其他促炎因子后续生成提供必要条件。基于IL-1β在炎症反应中的重要作用,调控其生成可以明显减轻MIRI。结果显示,缺血/再灌注心肌组织炎症因子水平明显增加,而Scu能明显下调缺血/再灌注心肌组织炎性因子IL-1β、TNF-α、IL-6、IL-18、ICAM-1的水平。表明Scu对心肌缺血/再灌注损伤的保护作用可能与抑制炎性因子的生成有关。
NLRP3炎症小体的激活与MIRI的发生关系密切[7-8]。研究发现,炎症小体NLRP3能够通过激活炎性caspase-1蛋白激酶,诱导IL-1β的生成。缺血/再灌注心肌组织中,NLRP3及ASC蛋白表达水平明显增加。炎症小体的激活及IL-1β释放最终导致细胞炎症反应瀑布式发生,进而导致更多的内源性危险信号的生成及炎症信号的放大,引起中性粒细胞及单核细胞的黏附及自由基的生成,诱发细胞水肿、死亡,并损伤心肌成纤维细胞等[9]。炎症小体及其下游炎性信号分子的激活是诱发心肌缺血后炎症反应的重要途径。抑制NLRP3炎症小体的激活,对于减轻MIRI意义重大。本研究显示,Scu可以明显降低心肌组织NLRP3蛋白表达水平。
NF-κB信号通路广泛存在于真核细胞中,静息状态下,NF-κB以一种无活性的形式在胞质中,与抑制性蛋白IκB相结合;在刺激因素作用下,IκB磷酸化并降解,NF-κB由胞质转移到胞核,可促进下游炎症基因转录的发生[10-11],参与炎症反应、细胞增殖、分化、凋亡等[12]。有研究表明,抑制NF-κB可下调NLRP3炎性小体的激活,进而减少IL-1β的分泌[1]。由于NF-κB是转移到细胞核内发挥生理作用,因此,本研究通过Western blot检测了其在细胞核内的表达情况。研究结果显示,相比于模型组,Scu可明显降低NF-κB核转位。
综上,本研究证实Scu可明显减轻再灌注过程中心肌组织的炎症反应和损伤,提高心肌收缩功能,其作用机制可能与抑制NF-κB /NLRP3/IL-1β通路,进而抑制炎症因子的生成有关。
(致谢:本实验于中国医学科学院药用植物研究所药理毒理中心实验室完成,感谢所有参与实验的老师及同学!)
