PI3K/Akt通路在丙泊酚减轻大鼠脑缺血性损伤中的作用
2019-05-05涂献坤涂德文梁日生石松生
涂献坤,杨 滨,涂德文,梁日生,石松生
(福建医科大学附属协和医院神经外科,福建省神经外科研究所,福建 福州 350001)
炎症反应是介导缺血性脑损伤的病理生理机制之一,药物通过抗炎症反应,已被证实可减轻缺血性脑损伤,炎症反应已是治疗缺血性脑中风的重要靶点之一[1]。本课题组前期研究发现,丙泊酚可通过抑制脑缺血炎症反应,从而保护缺血性脑损伤[2]。PI3K/Akt信号通路是一种促神经细胞生存的信号通路,我们前期还发现,5-脂氧合酶抑制剂齐留通(zileuton)可通过激活PI3K/Akt信号通路,减轻缺血性脑损伤[3],但是丙泊酚是否通过激活PI3K/Akt信号通路减轻缺血性脑损伤,目前研究较少,本研究将通过动物实验阐明,并进一步探讨其潜在的分子机制。
1 材料与方法
1.1 材料
1.1.1试剂 Akt抑制剂LY294002、氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)染料,购自Sigma公司;髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒,购自南京建成生物公司;p-Akt、Akt抗体,购于Santa Cruz公司;肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白介素1β(interleukin 1β, IL-1β)ELISA检测试剂盒,购自武汉博士德公司。
1.1.2实验动物 ♂清洁级SD大鼠,体质量250~300 g,购自上海斯莱克实验动物公司,许可证号:SCXK(沪)2003-0003。
1.1.3仪器 立体定向注射仪(深圳瑞奥德公司);低温离心机、酶标仪(美国Thermo公司);紫外分光光度计(美国Amsham公司);恒压电泳仪及转膜仪、凝胶成像分析系统(美国Bio-Rad公司)。
1.2 动物分组、动物模型制备及脑室内注射随机将大鼠分为4组,即对照组、溶媒组、丙泊酚治疗组和LY294002干预组。脑缺血后,丙泊酚50 mg·kg-1腹腔注射给药,给药剂量参考课题组前期发表论文[2]。大鼠脑缺血模型的建立参考既往文献[3-4],线栓(直径0.32 mm)购自深圳瑞沃德公司,10%水合氯醛(1 mL)腹腔注射麻醉,钝性分离右侧颈总动脉、右侧颈外动脉、右侧颈内动脉,结扎颈外动脉。在颈外动脉近分叉处剪一“V’形切口,插入线栓,将栓线送至大脑中动脉起始处,进线约(18.0±2.0)mm,栓塞2 h后退出线栓,血流再灌注。动物手术全过程使用加热垫,保持肛温37 ℃。
用DMSO溶解LY294002,PBS稀释成10 μmol·L-1。建模前30 min,取10 μL,运用立体定向注射仪行脑室内注射。定向仪参数:以前囟前方0.8 mm,中线外侧1.5 mm为穿刺点,穿刺深度3.5 mm,给药剂量及方法参考课题组前期工作[5]。
1.3 评估大鼠神经功能障碍神经功能障碍评分方法参考既往文献[2]。无神经功能障碍者为0分;提起大鼠尾巴,对侧前肢屈曲者为1分;行走时在地上打转,静止时身体无偏向对侧者为2分;行走时地上打转,静止时身体也偏向对侧者为3分;严重意识障碍无法运动者为4分。
1.4 计算脑梗死体积脑缺血相应时间,取大脑,冷冻10 min后,沿冠状位将大脑切成每片厚度约2 mm的6片,于2% TTC溶液中避光孵育20 min,每面各10 min。无梗死组织呈鲜红色,梗死脑组织呈白色。利用软件测量各脑片梗死面积,并按公式计算脑梗死体积,V=t×(A1+A2+…An),V梗死体积,t脑片厚度,A梗死面积。以脑梗死比进行统计(梗死体积/对侧脑体积),计算方法参考既往文献[2]。
1.5 评估脑水肿程度通过计算脑含水量可以评估脑水肿程度。取大脑,用滤纸吸除脑表面的水珠,并用吹风机冷风吹干,称重获得湿重(wet weight,WW),放烤箱烤干后,再称重获得干重(dry weight,DW),依据如下公式计算脑含水量:脑含水量=(WW-DW)/WW×100%,脑含水量和脑水肿程度呈正比,计算方法参考既往文献[6]。
1.6 检测中性粒细胞在脑缺血中的浸润程度通过检测脑组织MPO可反映中性粒细胞在脑组织的浸润程度。脑缺血24 h,取大鼠脑组织,按试剂盒说明书步骤操作,计算MPO含量,参考既往文献[6]。
1.7 ELISA法检测血浆TNF-α和IL-1β的含量股静脉取血,4 ℃离心15 min获得上清,将标准蛋白样品和待测样品加入包被好一抗的96孔板,按试剂盒说明书步骤操作,绘制标准曲线,根据标准曲线计算各待测样品的TNF-α和IL-1β含量,参考既往文献[6]。
1.8 Western blot法检测大脑p-Akt和Akt的表达用试剂盒提取缺血脑组织的总蛋白,并测定蛋白浓度。经分离胶和浓缩胶电泳、转膜后,NC膜用一抗4 ℃孵育过夜,二抗室温孵育2 h,经显影、定影获得蛋白条带,用Quantity One软件分析蛋白条带,参考既往文献[6]。

2 结果
2.1 丙泊酚减轻神经功能障碍和脑梗死体积的作用被LY294002抑制脑缺血24 h,大鼠神经功能障碍评分增高(P<0.01),丙泊酚可减轻大鼠脑缺血诱导的神经功能损伤(P<0.01),丙泊酚的这种作用被脑室内注射LY294002所抑制(P<0.01),见Tab 1。脑缺血24 h,大鼠脑梗死比增大(P<0.01),丙泊酚可减轻大鼠脑缺血的脑梗死比(P<0.05),丙泊酚的这种作用被脑室内注射LY294002抑制(P<0.05),见Tab 1、Fig 1。
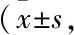
Tab 1 Propofol reduced neurological deficit scores and cerebral infarct size in rats of cerebral ischemia, which were inhibited by LY294002 n=6)
**P<0.01vssham;#P<0.05,##P<0.01vsMCAO;△P<0.05,△△P<0.01vspropofol
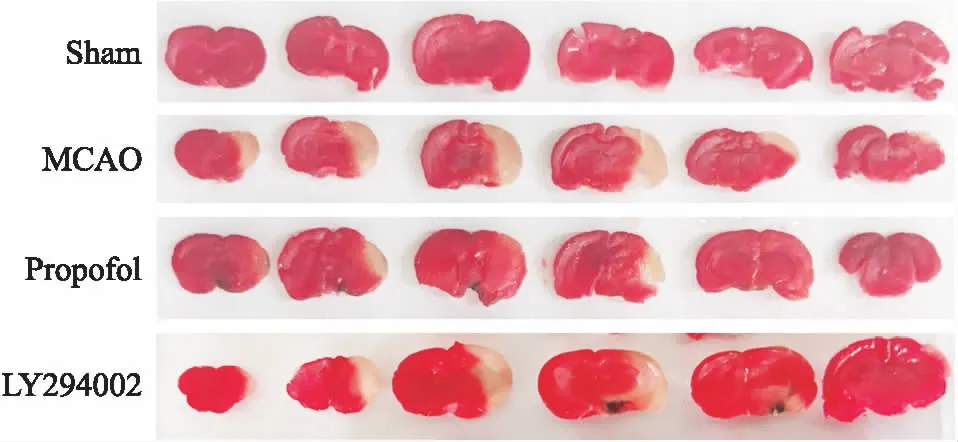
Fig 1 Representative TTC staining images from sham, MCAO, propofol-treated and LY294002-treated groups
2.2 丙泊酚减轻缺血性脑水肿的作用被LY294002抑制脑缺血24 h大鼠脑组织含水量明显升高(P<0.01),丙泊酚明显降低大鼠脑含水量(P<0.01),丙泊酚的这种作用被脑室内注射LY294002抑制(P<0.05),见Tab 2。
2.3 丙泊酚抑制MPO活性的作用被LY294002抑制脑缺血24 h,缺血侧脑组织MPO活性明显增高(P<0.01),表明缺血脑组织炎性细胞浸润增加,丙泊酚可降低缺血脑组织MPO的活性(P<0.01),即抑制炎症反应,丙泊酚的抗炎症作用被脑室内注射LY294002抑制(P<0.05),见Tab 2。
Tab 2 Propofol reduced cerebral water content and MPO activity in rats of cerebral ischemia, which were inhibited by LY294002 n=6)
**P<0.01vssham;##P<0.01vsMCAO;△P<0.05vspropofol
2.4 丙泊酚降低TNF-α和IL-1β水平的作用被LY294002抑制如Fig 2所示,脑缺血24 h,血浆TNF-α和IL-1β的表达明显增高(P<0.01),丙泊酚可明显降低TNF-α和IL-1β的水平(P<0.01),丙泊酚抑制TNF-α和IL-1β的作用被脑室内注射LY294002抑制(P<0.05)。

Fig 2 Propofol decreased expression of TNF-α and IL-1β after cerebral ischemia in rats, which were inhibited by LY294002 n=6)
**P<0.01vssham;##P<0.01vsMCAO;△P<0.05,△△P<0.01vspropofol
2.5 丙泊酚激活PI3K/Akt信号通路的作用被LY294002抑制如Fig 3所示,脑缺血24 h,缺血侧脑组织p-Akt的蛋白表达明显降低(P<0.01),丙泊酚上调脑缺血p-Akt的蛋白表达水平(P<0.01),丙泊酚调节Akt磷酸化表达的作用被LY294002抑制(P<0.01),而总Akt的蛋白表达水平各组之间差异无显著性。
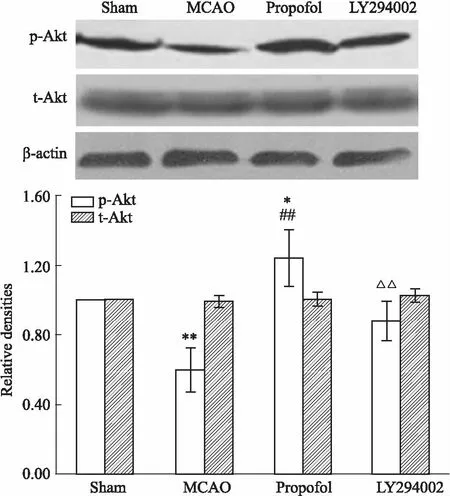
Fig 3 Propofol increased expression of p-Akt after cerebral ischemia in rats, which was inhibited by LY294002 n=6)
*P<0.05,**P<0.01vssham;##P<0.01vsMCAO;△△P<0.01vspropofol
3 讨论
我们前期研究发现,丙泊酚可以减轻大鼠脑缺血损伤,进一步的研究表明,丙泊酚可抑制大鼠缺血脑组织的中性粒细胞浸润,这表明丙泊酚可抑制脑缺血炎症反应,丙泊酚的神经保护作用与其抗炎症反应作用有关。此外,丙泊酚抑制NF-κB和TNF-α的表达,这可能是其抑制脑缺血炎症反应和神经保护作用的机制[2],但其深入的分子机制仍未被全部阐明。
本研究借助脑立体定向仪,将Akt抑制剂LY294002注入已建立脑缺血模型的大鼠侧脑室内,并通过Western blot实验证实,LY294002可以成功干预Akt通路活性[7]。实验结果显示,丙泊酚可减轻大鼠脑缺血后的神经功能障碍、脑梗死体积和脑水肿,这些结果表明丙泊酚对缺血性脑损伤具有脑保护作用。而脑室内注射LY294002可抑制丙泊酚对缺血性脑损伤的神经保护作用,证实PI3K/Akt信号通路在丙泊酚对脑缺血的神经保护作用中起重要的调节作用。
检测大鼠脑MPO可判定脑组织中性粒细胞的浸润程度,也反映了脑组织的局部炎症反应[8]。本研究发现,丙泊酚可抑制大鼠缺血脑组织炎性细胞的浸润,而这一作用被脑室内注射LY294002所抑制,说明丙泊酚通过激活PI3K/Akt信号通路减轻脑缺血诱导的局部炎症反应,PI3K/Akt信号通路在丙泊酚减轻脑缺血炎症反应过程中起着重要的调节作用。
我们进一步用Western blot方法检测了信号通路关键蛋白p-Akt和Akt的表达,结果显示,大鼠脑缺血24 h缺血脑组织p-Akt的表达下降,丙泊酚上调p-Akt的表达,丙泊酚对p-Akt的上调作用被脑室内注射LY294002抑制;但是各实验组之间总Akt的蛋白表达差异无统计学意义。以上实验数据表明,脑室内注射LY294002可抑制大鼠缺血性脑损伤PI3K/Akt信号通路的活化,PI3K/Akt信号通路在丙泊酚对脑缺血的抗炎症作用和神经保护作用过程中起着重要的调节作用。
TNF-α和IL-1β是促炎症细胞因子,可通过促进炎症反应,加重缺血性脑损伤的病理生理过程[9-10]。在大鼠蛛网膜下腔出血脑损伤中,丙泊酚被证实可抑制TNF-α和IL-1β的表达,从而抑制蛛网膜下腔出血性脑损伤,起神经保护作用[11]。在本实验中,大鼠脑缺血24 h血浆中TNF-α和IL-1β的水平升高,丙泊酚抑制TNF-α和IL-1β的表达,丙泊酚的这种作用被脑室内注射LY294002所抑制,表明丙泊酚通过PI3K/Akt信号通路发挥抗炎症作用。综上所述,PI3K/Akt信号通路在丙泊酚减轻缺血性脑损伤和脑缺血炎症反应过程中起重要的调节作用。
