改性壳聚糖吸附Ni2+过程动力学及热力学研究
2019-05-04张德谨谢永史洪伟卓馨李晓玲
张德谨,谢永,史洪伟,卓馨,李晓玲
(1.宿州学院 化学化工学院,安徽 宿州,234000;2.宿州学院 精细化工产品开发研究所,安徽 宿州,234000)
随着我国经济持续快速的发展,化工、电子等行业都产生了大量的重金属工业废水,这些重金属废水对环境的污染极为严重[1]。目前,对于重金属废水的处理方法层出不穷,主要包括离子交换、电化学处理、沉淀、膜分离等,在这些处理方法中,吸附法以其安全、简单、低能耗等特点已经成为最实用的处理方法[2]。壳聚糖作为天然高分子甲壳素脱乙酰化的产物,分子链含有大量的羟基和氨基,使其能够与大多数过渡金属离子形成稳定的螯合物,此外,壳聚糖还具有原料丰富、价格便宜、无二次污染以及可降解等优点,使其成为了一种广泛使用的重金属离子吸附剂[3-4]。但是,由于分子内与分子间氢键的作用,导致壳聚糖溶解性较差,极大限制了壳聚糖的应用,因此需要对壳聚糖进行改性[5]。
目前,对于壳聚糖改性的方法主要有交联改性、接枝改性、季铵盐改性、羧基化改性等等,通过对壳聚糖改性改善其溶解性、稳定性以及吸附性能[6-7]。文中利用微波加热均匀、加热效率高等特点,制备改性壳聚糖,然后以改性壳聚糖作为吸附剂,从吸附热力学、吸附等温线以及动力学角度探讨改性壳聚糖对镍离子的吸附机理,以期为改性壳聚糖处理重金属工业废水提供一定的参考价值。
1 实验材料与方法
1.1 实验试剂
壳聚糖(脱乙酰度大于90%),郑州义多利化工产品有限公司生产。乙酸、双氧水、过硫酸钙以及硫酸镍等试剂均为分析纯。
1.2 实验方法
1.2.1 微波辅助改性壳聚糖的制备
称量1.5g壳聚糖样品置于250mL烧瓶中,向烧瓶中加入40mL 2%乙酸溶液,壳聚糖完全溶解后,缓慢加入15mL 5%双氧水,将混合溶液放置在微波合成反应器中,设置反应温度为70℃、微波功率为200W的条件下反应10min。然后用5%的NaOH溶液调节pH至7,抽滤,收集滤液,将约3倍滤液体积的无水乙醇倒入滤液中,待沉淀完全后,在转速8000r/min下离心旋转0.5h,然后再用无水乙醇和去离子水洗涤3次。最后,把沉淀置于真空干燥箱中,于60℃条件下干燥12h,得到改性壳聚糖[5]。
1.2.2 镍离子含量测定
参照文献[3],利用镍离子与丁二酮肟在碱性溶液中可以形成酒红色络合物,采用丁二酮肟分光光度法测定废水中镍离子含量,在465nm处,测定不同溶液的吸光度,以Ni2+的质量浓度X(mg/L)为横坐标,吸光A为纵坐标,绘制标准曲线,得到线性回归方程为A=0.055 6C+0.005 9,线性相关度R2=0.998 14,表明线性关系良好。
1.2.3 吸附动力学
称取0.25g改性壳聚糖放于250mL锥形瓶中,依次加入1mg/mL Ni2+废水30mL,于40℃的振荡温度下吸附,每隔10min测定溶液中镍离子浓度,绘制吸附动力学曲线。
1.2.4 吸附等温线及吸附热力学
称取的0.25g改性壳聚糖置于250mL锥形瓶中,向其中加入1mg/mL含镍废水溶液30mL,分别在吸附温度为35、40、45℃下吸附60min后,测定不同样品中的吸光度,绘制吸附等温线,并对吸附过程热力学进行研究。
1.3 吸附率的计算
改性壳聚糖吸附镍离子效果用吸附量和吸附率表示,其计算公式为
(1)
(2)
其中:Qe表示达到吸附平衡时吸附量,mg/g;E表示吸附率;C0表示镍离子初始浓度,mg/mL;Ce表示吸附达到平衡后镍离子浓度,mg/mL;V表示样品溶液体积,mL。
2 实验结果与讨论
2.1 吸附动力学
通过对改性壳聚糖吸附镍离子过程的吸附动力学研究,可以较为准确的描述和量化改性壳聚糖在某一温度对被吸附介质的吸附速率以及达到吸附平衡的时间,并且能够对改性壳聚糖吸附镍离子的吸附机理进行研究[8]。目前,主要的动力学模型有准一级动力学模型、准二级动力学模型和Weber-Morris模型。
2.1.1 准一级动力学模型
准一级动力学模型适用于多种复杂的吸附系统,该模型是基于吸附过程受扩散步骤控制建立起来的,其数学表达式为[9]
(3)
积分后,可得到其线性表达式为
ln(Qe-Qt)=lnQe-k1t
(4)
其中:Qt表示在某一时刻t时改性壳聚糖对镍离子的吸附量,mg/g;k1为准一级动力学参数,min-1。准一级动力学模型的拟合结果见图1(a),动力学参数及方程见表1。由表1可知,线性相关系数R2=0.971 5,表明准一级动力学模型能够较好适用于改性壳聚糖吸附镍离子的吸附系统。
2.1.2 准二级动力学模型
准二级动力学模型假定吸附剂与被吸附介质之间涉及到电子的转移、共用,吸附过程有化学键形成,吸附速率由吸附剂表面未被占据的吸附位点数目控制,其数学表达式为[10]
(5)
积分后可得:
(6)
其中:k2为准二级动力学参数,g·min-1·mg-1。准二级动力学模型的拟合结果见图1(b),动力学参数及方程见表1。由表1可知,线性相关系数R2=0.981 6,表明准二级动力学模型与准一级动力学模型相比更适用于当前吸附系统。
2.1.3 Weber-Morris模型
改性壳聚糖吸附镍离子过程可分为三个步骤:
1)镍离子从边界层迁移到改性壳聚糖表面的传质过程(外扩散);
2)镍离子在改性壳聚糖微孔内部的扩散过程(内扩散);
3)改性壳聚糖吸附活性位吸附镍离子的过程。
一般认为步骤3)相对于其他两个步骤较快,因此,吸附速率控制步骤只可能是边界扩散或者内部扩散阶段。其中,内部扩散阶段数学表达式为[11-12]
(7)
其中:k3为Weber-Morris模型动力学参数,mg·g-1·min-1/2;I表示边界层扩散对吸附动力学的影响程度,I值越大,表明边界层的厚度越大,边界层扩散阶段对于整个吸附过程速率的影响就越大。
以t1/2为横坐标,Qt为纵坐标作图,若该直线通过原点表明改性壳聚糖吸附镍离子过程动力学仅受内部扩散阶段控制,若该直线不通过原点表明该吸附过程动力学由内部扩散和边界层扩散阶段共同控制[13]。拟合结果见图1(c),动力学参数及方程见表1。由图4可知,该直线不经过原点,表明改性壳聚糖吸附镍离子过程由内部扩散和边界层扩散阶段共同控制。由表1可知,线性相关系数R2=0.997 8,表明Weber-Morris模型与当前吸附系统拟合程度较高。
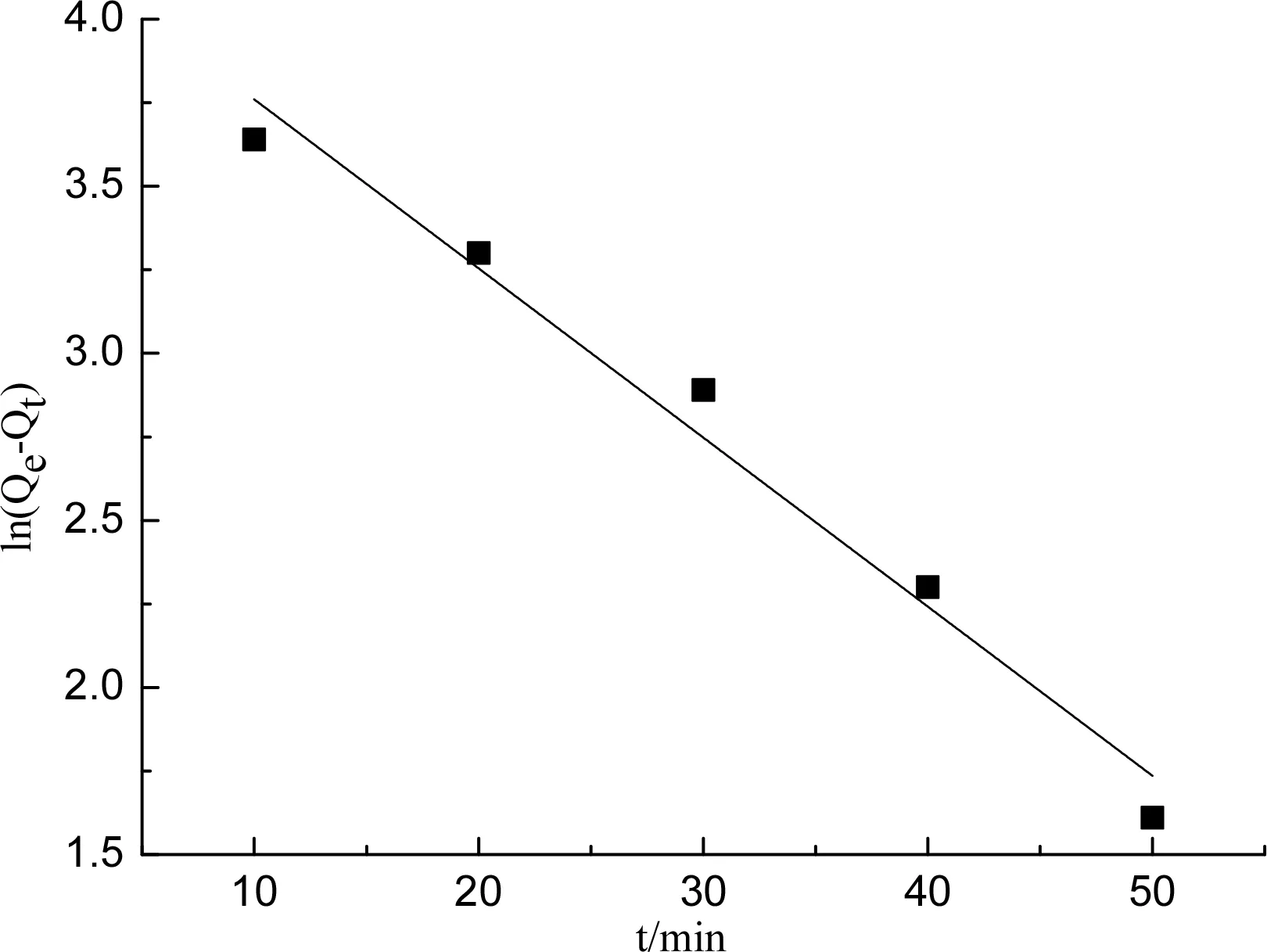
(a)准一级动力学模型拟合结果

(c)Weber-Morris模型拟合结果图1 动力学模型拟合结果Fig.1 Fitting results of the kinetics model
表1 改性壳聚糖吸附镍离子动力学方程及参数
Table 1 Kinetic parameters for Ni2+adsorption on modified chitosan
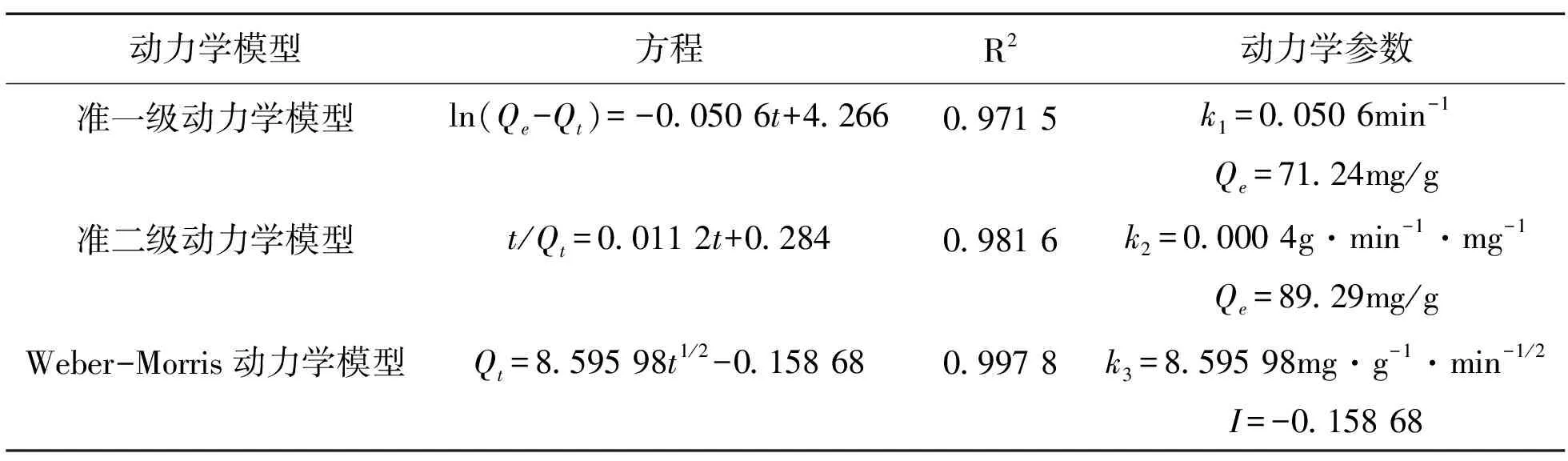
动力学模型方程R2动力学参数准一级动力学模型ln(Qe-Qt)=-0.050 6t+4.2660.971 5k1=0.050 6min-1Qe=71.24mg/g准二级动力学模型t/Qt=0.011 2t+0.2840.981 6k2=0.000 4g·min-1·mg-1Qe=89.29mg/gWeber-Morris动力学模型Qt=8.595 98t1/2-0.158 680.997 8k3=8.595 98mg·g-1·min-1/2I=-0.158 68
2.2 吸附等温线
2.2.1Langmuir吸附等温线
Langmuir吸附模型认为吸附剂表面活性中心分布均匀,各处吸附能力相同,并且每个活性中心只吸附一个分子的单分子层吸附,其数学表达式为[14]
(8)
其中:Qm是在当前条件下最大吸附容量,mg/g;KL为Langmuir吸附常数,L/mg。Langmuir为吸附模型可用无量纲参数RL分析,其表达式为
(9)
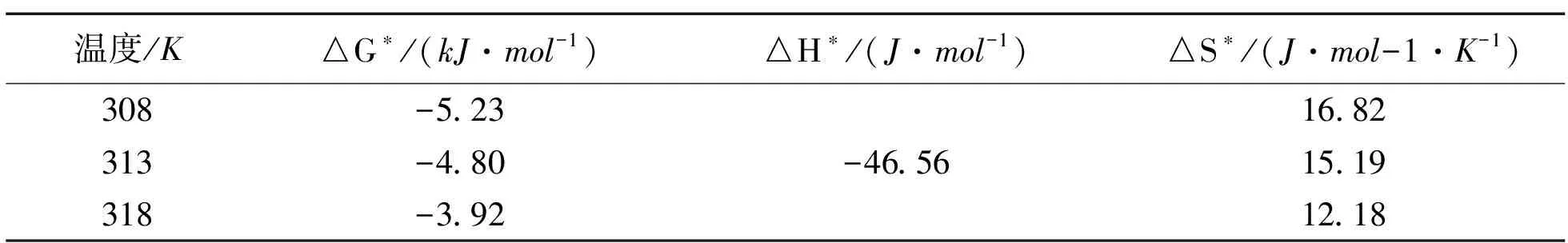
其中:C0(mg/mL)为吸附系统中镍离子初始浓度。若RL>1,表明为非优惠吸附;若0 图2 Langmuir吸附等温线拟合结果Fig.2 Fitting results of Langmuir adsorption isotherm 2.2.2Freundlich吸附等温线 Freundlich吸附模型适用于吸附质表面不均匀的多相吸附系统,其数学表达式为[15] (10) 线性变换后可得: (11) 其中:KF为Freundlich吸附常数;1/n为常数,表示吸附强度;Freundlich吸附等温线拟合结果见图3,Freundlich吸附模型参数见表2。由表2可知,1/n的值均较小,表明改性壳聚糖吸附镍离子过程较容易进行,此外,Freundlich吸附模型线性相关系数R2的平均值明显大于Langmuir吸附模型,表明Freundlich吸附模型更适用于当前的吸附系统。 图3 Freundlich吸附等温线拟合结果Fig.3 Fitting results of Freundlich adsorption isotherm 表2 吸附等温线方程及相关参数 Table 2 Adsorption isotherm equations and parameters 方程参数温度35℃40℃45℃Langmuir方程线性方程1/Qe=0.001 15/Ce+0.008 861/Qe=0.080 114/Ce+0.009 781/Qe=0.001 04/Ce+0.004 58KL7.706.334.40R20.972 940.988 20.980 64RL0.110.890.19Freundlich方程线性方程lnQe=0.363 17lnCe+4.733 99lnQe=0.323 96lnCe+4.619 58lnQe=0.558 81lnCe+5.442 95KF54.5954.59148.411/n0.363 170.323 960.558 8R20.983 110.981 280.999 4 通过对改性壳聚糖吸附镍离子过程热力学进行研究,不仅能够了解吸附过程中热力学参数的变化,还有助于对改性壳聚糖吸附镍离子过程的机制研究[16]。改性壳聚糖与镍离子在固液界面发生吸附时,镍离子从液相主体迁移至固液相界面,达到吸附平衡时,镍离子在液相主体和界面吸附相的化学势相等[17]。 在液相主体中: μl=μ*l+RTln(xlfl) (12) 在吸附相中: μs-l=μ*s-l+RTln(xs-lfs-l) (13) 其中:xl和xs-l分别是镍离子在液相主体以及吸附相中的摩尔分数;fl和fs-l分别为液相主体以及吸附相中的活度系数。 当改性壳聚糖吸附镍离子达到平衡时,吸附吉布斯自由能变化△G=0,整理后可得: △G*=-RTlnKL (14) 根据克劳修斯-克拉佩龙方程可得[21]: (15) 经积分,线性变换后可得: (16) 然后,根据吉布斯-亥姆霍兹方程可得吸附过程熵变计算公式为 (17) 根据公式(14)、(16)和(17)计算热力学参数,结果见表3。通过对吸附过程焓变的计算,可以推断改性壳聚糖吸附镍离子过程的主要作用力。由表3可知吸附过程焓变△H为-46.56J/mol,表明改性壳聚糖吸附镍离子过程中无配位基交换、化学键等强作用力,△H<0,表明改性壳聚糖吸附镍离子为放热过程[18]。吸附过程自由能变化△G是吸附驱动力的体现,其值越大,表明吸附越容易发生,此外,△G的计算有助于改性壳聚糖吸附镍离子过程机制的研究[19]。一般物理吸附的吉布斯自由能变化在-20~0kJ/mol范围内变化,由表3可知改性壳聚糖吸附镍离子为自发进行的物理吸附过程,并且随着温度升高,吸附过程吉布斯自由能变化越来越小,表明吸附驱动力减小,这与改性壳聚糖吸附镍离子为放热过程结论一致。在吸附过程中,吸附与解吸过程同时存在,吸附过程,自由度下降,是熵减小过程,而解吸过程是熵增加过程,吸附过程熵变是吸附与解吸过程熵变的总和[20]。由表3可知,熵变△S大于0,这可能是由于改性壳聚糖的溶胀致使吸附过程中熵增加。 表3 热力学参数 Table 3 Thermodynamic parameters 温度/K△G∗ /(kJ·mol-1)△H∗ /(J·mol-1)△S∗/(J·mol-1·K-1)308-5.2316.82313-4.80-46.5615.19318-3.9212.18 本研究利用微波辅助技术制备改性壳聚糖,通过对吸附过程等温线、动力学以及吸附热力学的研究,探讨改性壳聚糖吸附镍离子过程的机制,得到的主要结论如下: 1)准二级动力学模型更适合于改性壳聚糖吸附镍离子过程,吸附过程由内部扩散和边界层扩散共同控制。 2)Freundlich吸附等温线较适合于改性壳聚糖吸附镍离子过程,该吸附过程较容易进行,为优惠吸附。 3)改性壳聚糖吸附镍离子为自发进行、放热的物理吸附过程。


2.3 吸附热力学
3 结论
