等离子体活化冰对东方对虾保鲜及品质的影响
2019-04-29艾春梅谢小本廖新浴苏远高凌霄王珏帆刘东红叶兴乾丁甜姜竹茂
艾春梅谢小本廖新浴苏 远高凌霄王珏帆刘东红叶兴乾丁 甜姜竹茂
(1. 烟台大学生命科学学院,山东 烟台 264005;2. 浙江大学生物系统工程与食品科学学院, 浙江 杭州 310058;3. 绍兴咸亨食品股份公司,浙江 绍兴 312000;)
东方对虾(Penaeusorientalis)又称大正虾,“世界三大名虾”之一,是中国主要的增殖养殖种类[1]。
在传统方法中,虾的储存方式是将其放置在0~4 ℃的温度下,或者在冷海水中保藏[2-3],虽然操作简单,成本低,但货架期短[4],在加工、储存与运输过程中容易腐败变质。近年来国内外对虾的保鲜技术也有广泛的研究,Li等[5]利用高静水压力(HHP)处理白对虾,以提高虾体内多酚氧化酶(PPO)的失活率;Bono等[6]研究冷冻结合MAP技术与亚硫酸盐处理(SUL)技术对红魔虾贮藏期间的相关品质进行对比;刘品[7]在研究中提到了低温保鲜、化学保鲜、生物保鲜及酸性电解水保鲜等技术。
低温等离子体活化水(PAW)是一种新型的杀菌技术,具有广谱的杀菌特点。近几年PAW在医院消毒、水果的杀菌及肉质保鲜护色方面应用较多,还并未运用到肉制品方面保鲜。沈瑾等[8]研究了低温等离子体活化水的杀菌效果及相关性能,结果显示:每次制备活化水对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌,都有杀菌作用,杀灭对数值均>5.0。Ma等[9]利用非热等离子体活化水对采后杨梅果实腐烂和品质的影响进行研究,结果显示:PAW处理过的果实,腐烂率减少50%,贮藏结束,杨梅的品质也并未发生变化。因此,本试验以等离子体活化冰贮藏东方对虾,评估等离子体活化冰对虾的保鲜效果和品质的影响,旨在开发出合适的等离子体活化冰的贮藏技术,为东方对虾的加工贮藏提供理论依据。
1 材料与方法
1.1 材料
鲜活东方对虾:重量为6~8 g/只,中国杭州三水蔬菜有限公司。
1.2 试剂
三氯乙酸、硫代巴比妥酸(TBA)、氯仿、乙二胺四乙酸(EDTA)、无水乙醇、盐酸、氢氧化钠、氯化钠:分析纯,国药集团化学试剂有限公司;
PCA培养基:生化试剂,青岛高科技工业园海博生物技术有限公司;
高氯酸、甲基红、溴甲酚绿:分析纯,上海阿拉丁生化科技有限公司。
1.3 仪器与设备
恒温水浴锅:SHJ-6AB型,常州金坛良友仪器有限公司;
介质阻挡放电等离子发生仪:CTP-2000K型,南京苏曼科技有限公司;
色差仪:WSD-Ⅲ型,北京康光仪器有限公司;
质构仪:TA-XT2i型,英国Stable Micro System公司;
电导率仪:DDS-22C型,杭州陆恒生物科技有限公司;
便携pH计:pHB-1型,上海三信仪表厂;
高速低温离心机:HC-3018R型,安徽中科中佳科学仪器有限公司;
分光光度计:722N型,上海仪电科学仪器股份有限公司;
恒温培养箱:LRH-250型,上海—恒科技有限公司;
全波长酶标仪:1510型,赛默飞世尔(上海)仪器有限公司;
全自动凯氏定氮仪:ZDDN-111型,浙江托普仪器有限公司;
拍打式均质机:I Mix®型,法国iMAX公司。
1.4 方法
1.4.1 等离子体活化冰制备方法 使用介质阻挡放电式等离子体发生仪运用离子水不间断处理5 min,收集2 L后装入无菌自封袋,在-20 ℃冰箱避光保存待用。纯水制冰同法。
1.4.2 样品处理与贮藏方法 将虾放入托盘中,分别在虾上下铺上纯水碎冰(A组)与等离子体碎冰(B组),分为2组,每组冰量2 L。置于20 ℃下放置,每隔12 h换一次冰,并在不同贮藏时间(0,1,2,3,4,5,6 d)条件下,对虾进行品质分析。
1.4.3 等离子体活化冰挥发动力学研究方法 纯水制备等离子体中过氧化氢、OH自由基及活性氧等活性物质在冰藏过程中发挥重要作用,根据等离子体活化冰贮藏期的pH、电导率、氧化能力以及过氧化氢含量随贮藏时间的变化,以判断其等离子体活化冰的稳定性[10]53-83。
1.4.4 对虾在等离子体活化冰贮藏期的品质
(1) pH测定:使用pH计测定。每组随机取3只虾剪成碎肉,取5 g虾肉置于100 mL锥形瓶,加45 mL去离子水,浸泡30 min,每5 min搅匀1次,之后取滤液测定pH值,每次测定3个平行。
(2) 硫代巴比妥酸(TBA)检测:参照迟海等[11]的试验方法处理样品,采用外标法标定虾肉中TBA含量,在532 nm处测定吸光度值,根据标准曲线,以每1 kg肉中丙二醛的mg来表示。每次测定3个平行。
(3) 挥发性盐基氮(TVB-N)检测:按照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》执行,每次测定3个平行。
(4) 菌落总数检测:按照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》执行,每次测定3个平行。
(5) 细菌多样性检测:使用第二代基因组测序方法[12-13]对虾中的菌群进行分析,寻找其中是否存在食源性致病菌[14],提取不同处理组虾的DNA进行测序,结果与文库对比分析计算出细菌的菌属及其在所有菌属中的占比。
(6) 硬度检测:试验使用质构仪(圆柱探针直径5 mm,型号P5)进行测定,测前速率1 mm/s,测试速率5 mm/s,测后速率5 mm/s,感应力5 g,试样变形50%,在室温下进行TPA分析。每次测定3个平行。
(7) 色差检测:试验使用色差仪测定对虾虾头的亮度L,红绿a,蓝黄b值,根据式(1)计算总色差值,每次测定3个平行。
(1)
式中:
L0——仪器经自检及零点、白板校正后贮藏虾头的L值;
a0——仪器经自检及零点、白板校正后贮藏零点虾头的a值;
b0——仪器经自检及零点、白板校正后贮藏零点虾头的b值。
1.5 数据处理
数据采用Origin绘图,采用SPSS进行统计分析。
2 结果与分析
2.1 等离子体活化冰的挥发动力学研究
2.1.1 等离子体活化冰贮藏期pH变化 根据图1可以看出,B组贮藏过程pH一直恒定在3左右,且平行性较好,主要原因是等离子活化冰在贮藏过程中产生硝酸、亚硝酸等[10]60-64,具有较好的稳定性。
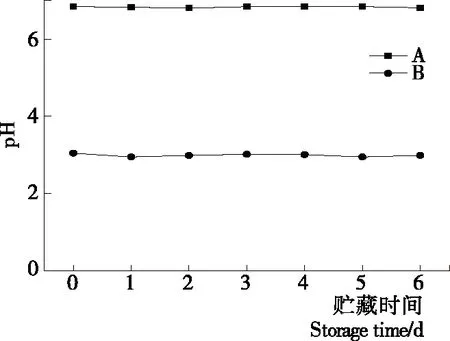
图1 A组与B组贮藏期pH值变化
2.1.2 等离子体活化冰贮藏期电导率变化 如图2所示,在整个贮藏期内,B组数值上远远大于A组,A组电导率为1.8~2.4 μS/cm,B组的电导率在第0天时为429.3 μS/cm,后续在1~6 d时直线下降。
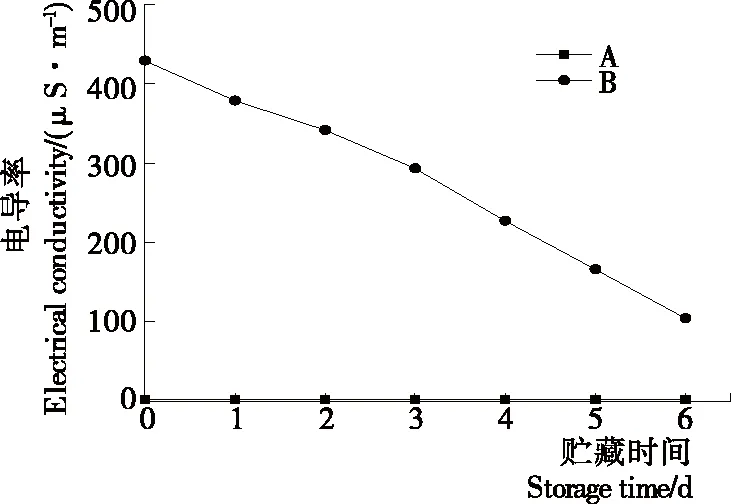
图2 A组与B组贮藏期电导率值变化
2.1.3 等离子体活化冰贮藏期氧化还原电位与过氧化氢含量变化 由图3可知,在整个贮藏期内,A组的氧化还原电位几乎保持恒定,B组氧化还原电位随着贮藏时间的延长呈下降趋势。贮藏时间第0天的氧化还原电位是484 mV,第1天的氧化还原电位是442 mV,下降了42 mV,与郭俭[10]55-83的研究结果一致。
如图4所示,与氧化还原电位相比,过氧化氢浓度与氧化还原电位变化趋势一致,A组的过氧化氢浓度几乎保持恒定,B组过氧化氢浓度随着贮藏时间的延长呈下降趋势,但贮藏时间在第6天时,过氧化氢浓度与A组相同。

图3 A组与B组贮藏期氧化还原电位变化
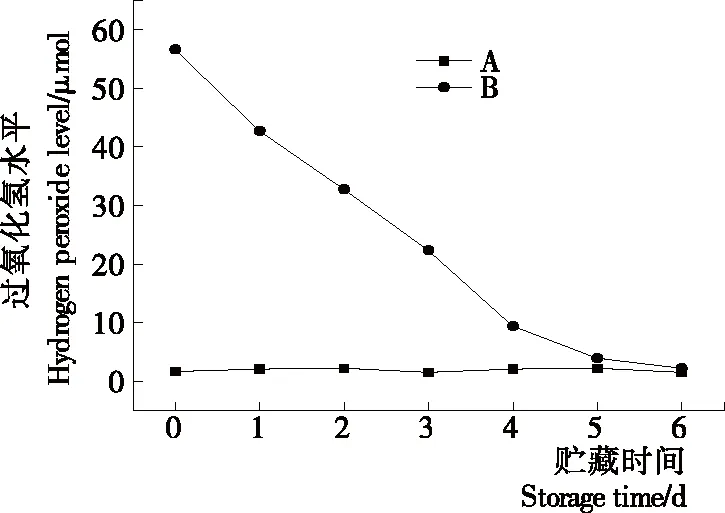
图4 A组与B组贮藏期过氧化氢浓度变化
Figure 4 Changes of hydrogen peroxide concentration during the storage period of group A and group B
综合等离子体活化冰在贮藏期4个指标的变化,等离子体活化冰中的过氧化氢的含量较稳定,并能以一定的速率挥发。在储存期内,等离子体活化冰氧化还原电位始终高于标准值222 mV,储存期内保持有一定的氧化能力,有利于破坏细菌蛋白质与核酸结构,从而抑制细菌生长[15]。
2.2 对虾贮藏期的品质分析
2.2.1 等离子体活化冰贮藏中虾的pH值变化 如图5所示,2个处理组虾的pH值均由中性逐渐上升变为弱碱性,这与其他保鲜剂处理对虾的结果相符合[16]。前3 d 2组相差不明显,到第6天,2组虾的pH差值增大至0.4,B组虾的pH达到最大值7.53,而A组虾的pH值达到7.94。说明等离子体活性物质可以抑制细菌分解蛋白质与含氮化合物,进而造成虾肉碱性增大。
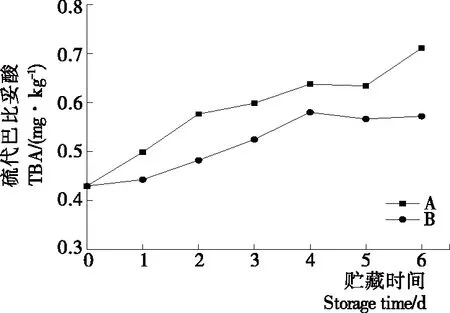
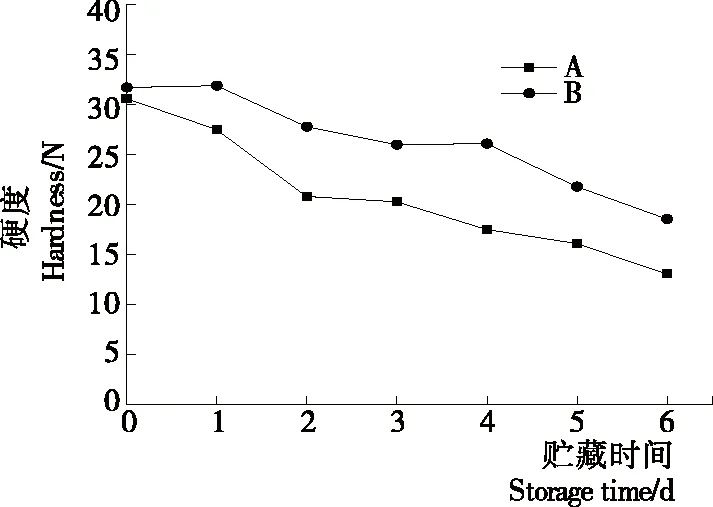
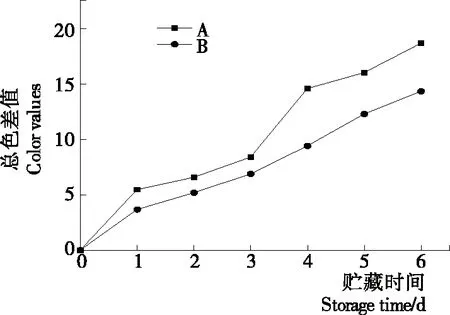
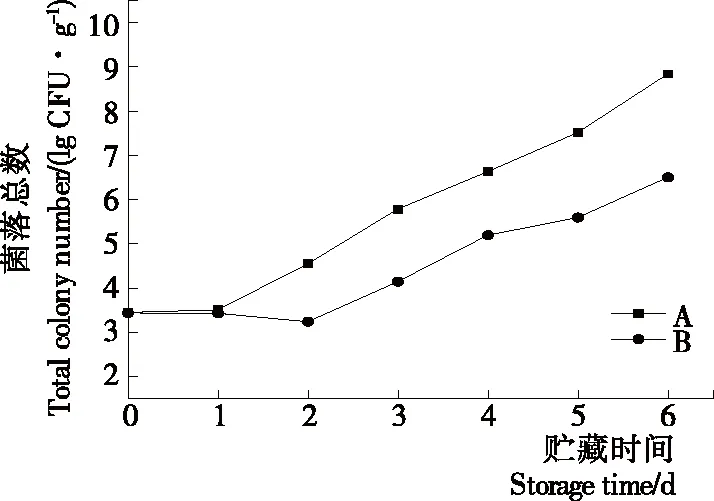
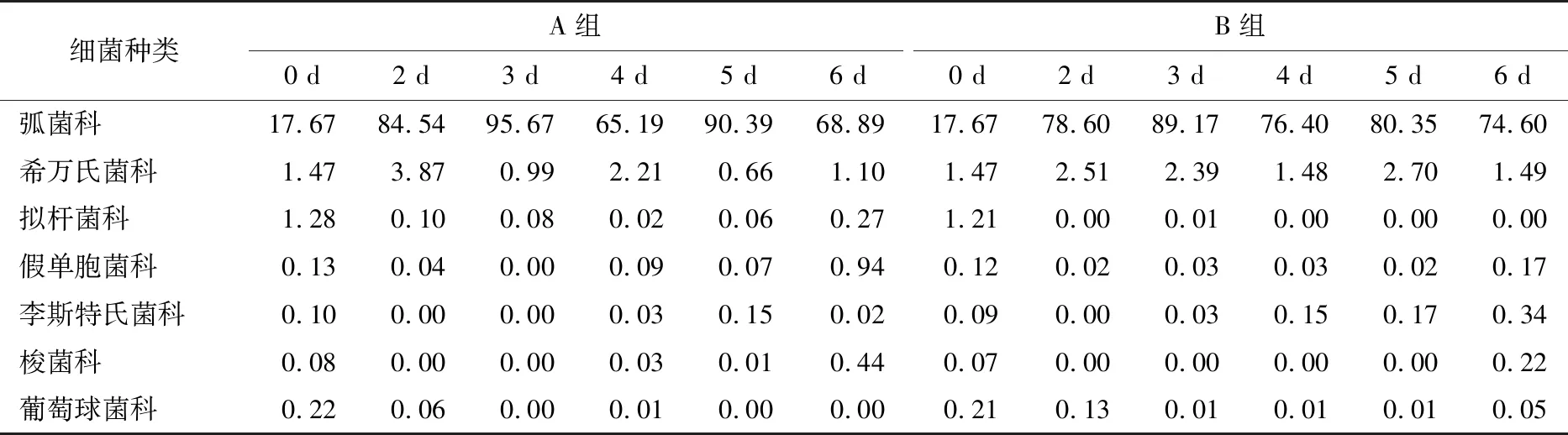
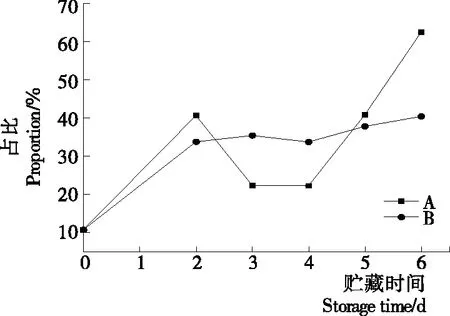
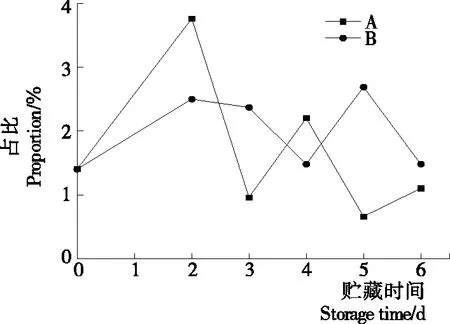
2.2.2 等离子体活化冰贮藏中虾的TBA及TVB-N值变化 由图6可知,TVB值随着贮藏时间的延长而逐渐上升。A组虾的TBA值在贮藏期0~4 d中缓慢增长,而B组在第5~6天TBA含量再无增长,整个贮藏期内B组TBA数值始终 图5 A组与B组贮藏期对虾pH值变化 图6 A组与B组贮藏期对虾TBA值变化 如图7所示,在贮藏期0~2 d 2组虾的TVB-N值差别较小。在第3天时,A组虾的TVB-N值达到了29.9 mg/kg,超过了GB 2733—2015《食品安全国家标准 鲜冻动物性水产品》中对合格虾的鲜度等级要求(20 mg/kg),之后迅速增长,在贮藏第6天达到最高值(86.4 mg/kg)。而B组虾在贮藏期内TVB-N值增长缓慢,在第4天才达到18.1 mg/kg,符合GB 2733—2015对虾挥发性盐基氮的鲜度等级要求,到第6天B组虾的TVB-N值上升速率远远小于A组的。表明等离子体冰抑制TVB-N机理可能与等离子体对虾表面的腐败希瓦氏菌、弧菌与铜绿假单胞菌细菌的生长抑制和杀灭效果有关[18]。 2.2.3 等离子体活化冰贮藏中虾的硬度变化 如图8所示,硬度值在贮藏第0天时有最高值,之后随着贮藏时间延长,2组虾的硬度都逐渐下降,符合虾保藏过程中的硬度变化规律。试验期间B组虾的硬度值始终高于A组的,说明B处理对虾对硬度下降有延缓作用,其作用机理可能是对虾在贮藏期间等离子体活化冰可以有效地抑制微生物生长[17,19],减缓微生物分解虾肉蛋白,从而降低虾肉蛋白的变质[20-21],使得硬度缓慢下降。 图7 A组与B组贮藏期对虾TVB-N值变化 图8 A组与B组贮藏期对虾硬度值变化 2.2.4 等离子体活化冰贮藏中虾的色差变化 由图9可知,在试验期内2组虾的总色差值均呈上升趋势且趋势较为一致,B组虾的色差总值始终低于A组。在贮藏期1~3 d时,B组虾的总色差值与A组虾的相差1.5~2.0,在贮藏期第4天以后,总色差值数值差扩大到5.0以上。证明等离子体活化冰贮藏在一定期限内可以有效地抑制虾保存过程中的黑变。 2.3.1 等离子体活化冰贮藏中虾的菌落总数测定变化 根据图10,贮藏期内2组虾的菌落总数均呈上升趋势且趋势较为一致,B组菌落总数始终低于A组。说明等离子体活化冰贮藏处理可以抑制微生物的生长。抑制细菌生长的机理可能是,等离子体产生的羟基自由基和臭氧等强氧化性活性物质,使细菌细胞壁肽聚糖分子关键化学键断裂[10]55-84,并引起细菌内蛋白质或者核酸损伤[22-23]。 2.3.2 等离子体活化冰贮藏中虾中细菌多样性分析 对第二代高通量测序结果分析发现,虾中主要细菌为γ变形菌纲细菌,贮藏期内γ-变形菌纲菌所占比例最多,占比为55.31%。在贮藏期内,2组虾中的γ-变形杆菌纲的占比始终高于90%,B组的γ-变形菌纲占比比A组低2%~4%(表1)。说明B组贮藏处理对虾中的γ-变形菌纲(Gammaproteobacteria)细菌的生长有明显的控制作用。在γ-变形菌纲中,B组贮藏处理对弧菌目(Vibrionales)细菌生长的控制作用最明显。贮藏第0天时,弧菌目在所有目中占比17.22%。在贮藏期2~3 d内,B组弧菌目占总菌比例对比A组要低6%~8%(表2)。从细菌科等级水平上对比分析发现,等离子体活化冰对γ-变形菌纲中弧菌目中弧菌科(Vibrionaceae)细菌生长有明显抑制作用,贮藏期内B组弧菌科细菌占比与A组对比,B组弧菌科比A组低10%左右(表3)。 图9 A组与B组贮藏期对虾色差值变化 2.3.3 等离子体活化冰贮藏对虾中致腐菌与致病菌的控制作用分析 采用细菌基因二代测序在细菌属等级上分析虾类产品中常见的致腐菌(类肠膜明串珠球菌、枝芽孢杆菌、少动鞘氨单胞醇菌、阴沟肠杆菌、腐败希瓦氏菌、荧光假单胞菌和栖冷克吕沃尔菌[24])和致病菌(副溶血性弧菌、沙门氏菌、金黄色葡萄球菌、单增李斯特菌、创伤弧菌[25-26])共12种菌属在贮藏期内在所有菌群中的含量占比与变化。 图10 在贮藏期对虾菌落总数变化 (1) 其中枝芽孢杆菌、肠膜明串珠球菌、吕沃尔菌、少动鞘氨单胞醇菌、栖冷克、沙门氏菌、单增李斯特菌及其菌属未有明显检出。 (2) 弧菌属细菌广泛存在于海水与鱼、贝等海产品中,因此弧菌属细菌有明显检出。弧菌属中存在霍乱弧菌、副溶血弧菌、创伤弧菌、溶澡弧菌、拟态弧菌等几种与人类感染性腹泻有关的细菌[27],对人体生命健康威胁较大。由图11看出,弧菌属贮藏第0天时占比10.73%,贮藏期第6天A组弧菌属占比62.52%,B组为40.45%,2组之间差值最大达到22.07%。 表1 贮藏期对虾不同种类纲的细菌占比变化 表2 贮藏期对虾不同种类目的细菌占比变化 表3 贮藏期对虾不同种类科的细菌占比变化 图11 贮藏期对虾中弧菌属占比变化 Figure 11 Variation in the proportion ofVibriogenus in bacterial population on shrimps during storage change (3) 希瓦氏菌属、假单胞菌菌属和葡萄球菌属都有检出,但量较少。由图12可知,贮藏过程中,A组和B组希瓦氏菌属菌属占比变化差别较小。图13中,对虾中假单胞菌菌属在贮藏期0~6 d,A组占比变化几乎>B组,到贮藏第6天2组之差为0.79%。在图14中,对虾在贮藏第3天开始,2组葡萄球菌属占比变化趋于0。 综上所述,等离子体活化冰贮藏处理对弧菌属控制效果较明显,对假单胞菌属细菌生长有一定抑制作用,但作用较小,对抑制葡萄球菌属、希瓦氏菌属细菌生长未见明显作用。 图12 贮藏期对虾中希瓦氏菌属菌属占比变化 Figure 12 Variation in the proportion ofShewanellagenus in bacterial population on shrimps during storage 图13 贮藏期对虾中假单胞菌菌属占比变化 Figure 13 Variation in the proportion ofPseudomnasgenus in bacterial population on shrimps during storage 图14 贮藏期对虾中葡萄球菌菌属占比变化 Figure 14 Variation in the proportion ofStaphylococcusgenus in bacterial population on shrimps during storage 等离子体活化冰可以有效地抑制贮藏期对虾微生物的生长速度,对γ-变形菌纲弧菌目生长抑制效果较为明显。其次,在虾贮藏期间等离子体活化冰可以有效地抑制虾脂质氧化与蛋白质分解,延缓鲜虾的腐败过程,延长对虾的货架期,且不会对虾的感官(如硬度)造成不良影响。 等离子体活化冰在对虾贮藏过程中,冰的性质稳定,其存在的活性成分能相对稳定地存在于冰中,并以较恒定的速率从固态冰中挥发,对产品施加影响,不会产生有害物质。但利用等离子体活化冰贮藏东方对虾,其机理尚不明确,有待进一步研究。

2.3 微生物检测




3 结论
