单羧酸转运蛋白1促进胰腺导管癌细胞浸润转移的机制研究
2019-04-29王琳娜
张 敏,王琳娜,孙 超
1.济南市人民医院检验科,山东 济南 271100;
2.山东省青岛疗养院检验科,山东 青岛 266071;
3.青岛市市立医院高压氧科,山东 青岛 266071
胰腺导管癌是一种恶性程度很高的消化道恶性肿瘤,5年生存率不足8%[1]。90%的胰腺癌为起源于胰腺管上皮的导管腺癌,侵袭性强,易转移,早期确诊率低,手术死亡率高,治愈率低,是预后极差的恶性肿瘤之一[2]。胰腺导管癌的侵袭转移机制尚不明确。肿瘤细胞的增殖依赖于有氧糖酵解;葡萄糖的有氧糖酵解产生大量的乳酸,导致酸性的肿瘤微环境[3]。研究发现,酸性的肿瘤微环境有助于肿瘤细胞的局部浸润、转移及肿瘤复发[4]。由此可见,乳酸代谢在肿瘤中起着重要作用[5]。因此,研究胰腺导管癌中的乳酸代谢有着重要意义。
单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)是一种跨膜蛋白,几乎存在于所有肿瘤细胞中,主要参与转运酮体、乳酸及丙酮酸等[3]。在肿瘤细胞中,有氧糖酵解是主要的代谢方式[6],细胞内代谢产生的乳酸增多,需要依赖于MCT1及时将细胞内的乳酸转运至细胞外,维持细胞内的pH值不至于过低;同时,乳酸亦可以作为“替代燃料”,当细胞内的葡萄糖缺乏时,肿瘤细胞会利用乳酸作为能源,MCT1会将细胞外游离的乳酸转运至细胞内,以维持肿瘤细胞的能量需求[7]。因此,MCT1在乳酸转运及代谢中起着重要作用。研究证实,MCT1在肿瘤发生、发展及转移中发挥着重要作用[8],但MCT1在胰腺导管癌中的作用仍不清楚,有待于进一步研究。本研究拟从体内胰腺导管癌临床组织水平及体外细胞系水平探讨MCT1在胰腺导管癌组织中表达的临床病理学意义及在胰腺导管癌细胞系迁移浸润中的作用。
1 材料和方法
1.1 组织样本
从济南市人民医院病理科调取2006—2010年手术切除的胰腺导管癌组织及癌旁正常组织样本78对,组织均为术前病理冰冻诊断所取,未经任何放化疗。所有样本均经常规石蜡切片,H-E染色,并由高年资临床病理科医师检查确诊为胰腺导管癌。从济南市人民医院普外科收集51对新鲜液氮速冻的胰腺癌及癌旁正常组织标本用于提取总RNA。本研究所调取的石蜡包埋样本和液氮冻存的新鲜组织均得到济南市人民医院医学伦理委员会批准,所有样本均由相应的患者签署知情同意书。
1.2 细胞培养与miRNA转染
胰腺癌细胞系PANC-1(人胰腺上皮样癌细胞,超三倍体)和Capan-1(人胰腺上皮肿瘤细胞,携带BRCA2 6174位移码突变)购自中国医学科学院肿瘤医院肿瘤细胞库。PANC-1和Capan-1接种到含10%胎牛血清和双抗的RPMI-1640培养基中,置于37 ℃、CO2体积分数为5%的细胞培养箱中静置培养。MCT1慢病毒干扰载体的MCT1干扰序列、对照序列及具体构建方法主要参照参考文献[9]进行。干扰序列及其对照序列主要由生工生物工程(上海)股份有限公司合成。病毒转染参照病毒载体说明书进行。miR-124-3p mimic(5’-UAAGGCACG CGGUGAAUGCC-3’)、miR-124-3p inhibitor(5’-GGCAUUCACCGCGUGCCUUA-3’)和阴性对照miR-124-3p-scramble(5’-ACUA CUGAGUGACAGUAGA-3’)均由上海吉玛制药技术有限公司设计合成用于转染胰腺癌细胞。miR-124-3p mimic、miR-124-3p inhibitor和阴性对照miR-124-3p-scramble转染根据参考文献[10]进行具体操作。
1.3 总RNA提取及实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测
运用TRIzol(购自美国Thermo Fisher Scientific公司)法提取细胞总RNA。取1 μg总RNA用NCode™ miRNA第一链cDNA合成试剂盒进行mRNA或miRNA反转录成20 μL体系cDNA。使用SYBR Green Master mix(购自日本Takara公司)和IQ5 RTFQ-PCR系统(购自美国Bio-Rad公司)扩增cDNA模板。检测MCT1 mRNA以β-actin作为内参基因,检测miR-124-3p则以U6作为内参基因。miR-124-3p茎-环结构反转录引物序列:5’-GCCTATGGCTTTTTATTCCTATGT-3’。反转录条件:16 ℃、30 min,42 ℃、30 min,75 ℃、15 min。反转录结束后进行PCR扩增。PCR反应体系按试剂盒说明配制。miR-124-3p的正义链为5’-GCTAAGGCACGCGGTG-3’,反义链为5’-GTGCAGGGTCCGAGGT-3’;MCT1的正义链为5’-AAGGCATCCAGACCAGA AACCG-3’,反义链为5’-AGCATCGAGCA G G G C T C TA A C C-3’;U 6的正义链为5’-G T G C T C G C T T C G G C A G C A C ATA TA C TA A A AT T G G A A-3’,反义链为5’-ATCCAGTGCAGGGTCCGAGG -3’,特异性反转录引物为5’-GTCGTATCCAGT GCAGGGTCCGAGGTATTCGCACTGGA TACGACAAAATA-3’;β-actin的正义链为5’-GAAAGCCTGCCGGTGACTAA-3’,反义链为5’-AGGAAAAGCATCACCCGGAG-3’。PCR扩增的反应条件为:95 ℃、2 min,95 ℃、30s,60 ℃、35 s,共40个循环,记录循环阈值(Ct),采用2-△△Ct法计算miR-124-3p和MCT1 mRNA的相对表达量。每组实验重复3次。
1.4 荧光素酶报告检测
为了验证miR-124-3p能否结合MCT1 3’-UTR序列,我们运用生物信息学分析预测MCT1 3’-UTR序列,发现MCT1 3’-UTR序列上具有miR-124-3p的结合位点。我们自行构建了在GV272载体上亚克隆包含预测结合位点或突变的3’-UTR的片段。经生工生物工程(上海)股份有限公司DNA测序验证正确后,使用LipofectamineTM3000根据说明书将该质粒与miR-124-3p mimic或scramble序列共转染至HEK-293T细胞中,转染后48 h收集细胞,用双荧光素酶报告系统进行分析。
1.5 免疫组织化学检测
石蜡切片均应放置到60 ℃恒温箱中烘烤1 h;石蜡切片移入新鲜配制二甲苯溶液中浸泡20 min,更换二甲苯后再次浸泡20 min;切片分别置于梯度乙醇中进行脱蜡处理;蒸馏水;3%H2O2浸泡切片10 min,尽可能灭活内源性过氧化物酶;PBS清洗后,进行柠檬酸缓冲液抗原热修复。滴加羊血清封闭液,室温温育1 h;弃去封闭液并直接滴加一抗(稀释度1∶200,购自美国Origene公司),切片置于免疫组织化学湿盒中,于4 ℃冰箱中温育过夜;第2天,弃去一抗,PBS清洗3次,每次5 min;滴加相应的二抗(鼠/兔通用型二抗,购自北京中杉金桥生物技术有限公司),室温温育1 h;PBS清洗3次,每次5 min;每张切片滴加1滴新鲜配制的DAB显色液进行显色,当肉眼可见切片组织呈棕色或显微镜观察到组织经DAB显色后呈现出浅棕色着色时,应注意及时终止显色反应;切片晾干后封片(中性树胶),显微镜下逐一观察切片染色效果,并使用Leica图像采集系统进行病理组织图像采集。
1.6 免疫组织化学定量评分
MCT1表达定位于细胞膜和细胞质,为棕黄色或棕褐色颗粒。免疫组织化学染色后,每张病理切片均随机选取4个高倍视野,切片分别经低、中、高倍镜观察分析,由2名高年资病理科医师根据切片的染色强度及组织阳性细胞数进行综合评分,评分标准如下:根据阳性细胞的比例定义为:<5%,0分;5%~25%,1分;26%~50%,2分;51%~75%,3分;>75%,4分。根据染色强度定义为:阴性(基本不着色),0分;弱阳性(呈浅黄色),2分;中等阳性(呈棕黄色),3分;强阳性(呈棕褐色),4分。染色指数(staining index,SI)是综合切片阳性细胞数的染色强度及切片阳性细胞数所占比例,两者的乘积为染色指数评定的最终得分(即SI=切片染色强度×阳性细胞所占比例)。SI评分结果(0、1、2、3、4、6、8、9、12、16分),0~4分被判定为低表达,6~12分被判定为高表达。
1.7 蛋白质印迹法(Western blot)
收集细胞,加入RIPA裂解液(购自北京百泰克生物技术有限公司)以裂解细胞,提取总蛋白质,用BCA(购自美国Thermo Fisher Scientific公司)法测定样品蛋白的浓度,加入5×蛋白缓冲液,在100 ℃下煮沸5 min使蛋白变性;准备10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶,用于蛋白质电泳,转到硝酸纤维性素膜上(购自美国Sigma-Aldrich公司),用5%的脱脂奶粉室温封闭1 h,膜洗涤3次后,滴加特异性MCT1抗体(稀释度1∶800,购自美国Santa Cruz Biotechnology公司)和β-actin抗体(稀释度1∶1 000,购自美国R&D公司),在4 ℃的条件下培养过夜后,用TBST洗膜,加入辣根过氧化物酶标记的二抗,室温培育1 h,再次洗膜,滴加ECL行膜的曝光反应。使用Quantity One软件分析蛋白条带的灰度值,比较蛋白质的变化。
1.8 细胞克隆形成实验
细胞克隆形成实验,主要参照参考文献[11]进行。将要接种的细胞悬液混匀,将细胞悬液缓慢地沿壁加入24孔板孔内,梯度按照每孔400、200、100个细胞,静止5 min,然后转移至细胞培养箱培养14 d以上。计数、统计并拍照。
1.9 细胞划痕实验分析迁移能力
细胞划痕实验主要参照参考文献[12]进行。划痕所需工具均用75%乙醇擦拭,并置于超净工作台内紫外照射10 min;用直尺和标记笔在6孔细胞培养板背面均匀划线,所划直线横穿过孔,每孔划3条直线;常规培养细胞,至对数生长期后接种于6孔细胞培养板(细胞密度约3×105个/mL)上,在显微镜下观察细胞融合率达80%~90%后,用移液器吸嘴(10 μL吸嘴)沿着直尺并尽量垂直于培养板背面的横线划痕;用无菌PBS清洗去除划下的细胞,并更换为不含双抗和血清的RPMI-1640培养基;划痕后细胞静置培养,根据实验目的,在不同的时间点进行拍照取样,每组试验重复3次。统计分析使用Image J软件对划痕的修复情况进行定量分析。
1.10 Transwell实验检测侵袭能力
胰酶消化细胞并用PBS清洗,1 000 r/min离心5 min(离心半径为13.5 cm),用无血清RPMI-1640培养基吹打细胞沉淀制成细胞悬液(细胞密度约3×104个/mL);小室上室接种细胞悬液(100 μL/室),小室下室接种无血清培养基(500 μL/室),置于细胞培养箱内静置培养48 h;取出Transwell 24孔细胞培养板,弃去小室内液体,上室用4%多聚甲醛溶液固定30 min;PBS清洗小室上室,用棉签擦拭小室内Matrigel和残留的细胞,小室置于0.1%结晶紫染液中,染色15 min;蒸馏水充分清洗结晶紫染液,小室置于通风橱中风干,用倒置相差显微镜观察穿出的细胞并拍照,每组试验重复3次;统计分析使用Image J软件对小室穿出的细胞进行计数及定量分析。
1.11 统计学处理
运用SPSS 19.0统计软件对试验数据进行统计分析。试验数据在进行比较之前,先进行数据的方差齐性检验和正态分布检验。经SPSS软件进行检验后,如数据不符合正态分布,可先将数据进行函数转换,使其符合正态分布,随后再对试验数据进行后续的比较分析。数据的组间比较采用交叉表及χ2检验分析。采用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义,采用Log-rank法对差异进行显著性检验。
2 结 果
2.1 MCT1在胰腺导管癌中的表达显著上调
为明确MCT1在胰腺导管癌中的表达水平,我们运用免疫组织化学技术检测了78例胰腺导管癌及配对癌旁正常组织。免疫组织化学结果显示,MCT1阳性颗粒定位于细胞膜和细胞质,相比癌旁正常组织,MCT1显著高表达;其表达强度从阴性表达(7例)、弱阳性(15例)、中阳性(26例)到强阳性(30例)不等。将中阳性和强阳性归为MCT1高表达(56例),弱阳性及阴性表达归为低表达(22例)(图1)。MCT1在癌旁正常组织中鲜有阳性表达(4例),大部分癌旁正常组织(74例)中免疫组织化学技术难以检测到阳性表达。由此可见,MCT1在胰腺导管癌组织中的表达显著上调,提示MCT1可能起着癌基因的作用。
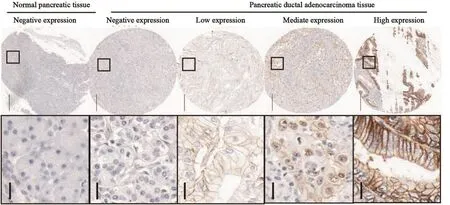
图 1 MCT1在胰腺导管癌中的表达显著上调Fig. 1 MCT1 was observed to be significantly over-expressed in pancreatic ductal adenocarcinoma tissues
2.2 MCT1高表达与胰腺导管癌的转移及预后有显著相关性
在明确MCT1在胰腺导管癌组织中的表达显著上调后,我们分析了其表达的临床病理学意义。统计分析发现,MCT1高表达与胰腺导管癌的分化程度(P=0.001)、临床分期(P=0.042)和淋巴结转移(P=0.012)具有显著相关性;而与其他临床病理学参数,如性别、年龄、肿瘤大小等均无显著相关性(表1)。此外,在我们收集的78例临床组织样本中,有8例无预后信息,其余均有生存预后信息。为明确MCT1表达的预后意义,我们运用Kaplan-Meier生存曲线分析了MCT1低表达与高表达的预后差异。其中在56例MCT1高表达患者中,有3例总预后信息缺失;22例MCT1低表达患者中,有5例总预后信息缺失。Kaplan-Meier生存曲线显示,MCT1低表达与高表达之间胰腺导管癌患者的总预后差异有统计学意义(P=0.016,图2),提示MCT1的表达强度可以作为胰腺导管癌患者的预后预测标志物。
2.3 沉默MCT1能够显著抑制胰腺癌细胞的增殖、迁移和侵袭
为明确MCT1在体外胰腺癌细胞恶性行为中的生物学作用,我们在体外细胞系水平采用细胞克隆形成实验、细胞划痕实验和Transwell实验分别探讨了MCT1在胰腺癌细胞增殖、迁移和侵袭中的作用。细胞克隆形成实验结果显示,沉默MCT1能够显著抑制胰腺癌细胞的增殖(图3)。我们设置了3个接种细胞密度梯度,分别为100、200和400个细胞每孔。相比对照组[PANC-1细胞对照组为(61±7)个,Capan-1细胞对照组为(69±6)个],MCT1沉默后PANC-1细胞和Capan-1细胞其克隆形成数分别下降至(22±3)和(28±5)个,差异有统计学意义(P<0.05)。细胞划痕实验结果显示,相比对照组[PANC-1细胞对照组中间划痕面积为(99.875±3.228)mm2,Capan-1细胞对照组中间划痕面积为(102.147±2.630)mm2],MCT1沉默后PANC-1细胞及Capan-1细胞划痕面积分别下降至(37.343±5.772)及(60.281±5.904)mm2,差异有统计学意义(P<0.05)。Transwell实验结果提示,相比对照组[PANC-1细胞对照组浸润细胞
数目为(81±4)个,Capan-1细胞对照组浸润细胞数目为(43±3)个],MCT1沉默后PANC-1细胞及Capan-1细胞穿透Transwell基质胶后细胞数分别下降至(22±7)及(21±5)个,差异有统计学意义(P<0.05)。

表 1 MCT1在胰腺导管癌中表达的临床病理学意义分析Tab. 1 Clinicopathological analysis of MCT1 expression in pancreatic ductal adenocarcinoma

图 2 MCT1表达与胰腺导管癌患者预后的相关性分析Fig. 2 Prognostic analysis of MCT1 expression in pancreatic ductal adenocarcinoma tissues
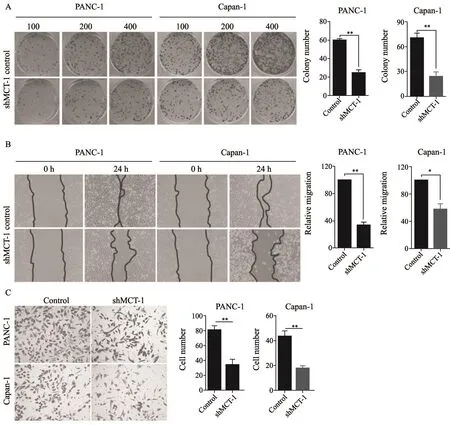
图 3 MCT1促进胰腺导管癌细胞的增殖、迁移和侵袭Fig. 3 MCT1 was able to promote the proliferation, migration and invasion of pancreatic ductal adenocarcinoma cells
2.4 miR-124-3p负调控MCT1蛋白表达
为探讨MCT1的可能作用机制,首先我们运用生物信息学分析方法预测了MCT1 3’-UTR序列,发现其3’-UTR序列具有miR-124-3p的结合位点(图4A),提示miR-124-3p可能是MCT1的一个潜在调控miRNA。其次为了验证生物信息学预测结果,我们进一步运用荧光素酶报告载体实验分析了miR-124-3p与MCT1 3’-UTR序列的结合性。结果显示,相比对照组荧光活性值(1.238±0.478),miR-124-3p与MCT1 3’-UTR共转染组荧光活性值(0.498±0.102)显著下降,由此推断miR-124-3p能够结合在MCT1 3’-UTR序列上(图4B),这也说明了我们前期生物信息学预测的正确性,揭示miR-124-3p能够调控MCT1的表达,但其调控的性质不明确。我们进一步运用Western blot,发现miR-124-3p能够负调控MCT1的表达,即上调miR-124-3p能够显著性抑制MCT1蛋白的表达;反之亦然(图4C)。为了在体内临床组织水平上进一步验证miR-124-3p对MCT1的调控关系,我们运用RTFQ-PCR技术分别检测了51对新鲜液氮冻存的胰腺癌组织及癌旁正常组织中MCT1和miR-124-3p mRNA的表达水平。结果显示,相比癌旁正常胰腺组织,miR-124-3p在胰腺癌组织中显著低表达,差异有统计学意义(P<0.001);相比癌旁正常组织,MCT1 mRNA在胰腺癌组织中显著高表达,差异亦有统计学意义(P<0.01);采用Pearson相关分析统计方法,可以看到在胰腺癌组织中,MCT1和miR-124-3p mRNA的表达水平显著负相关(图4D),提示miR-124-3p可以显著性负调控MCT1的蛋白水平。
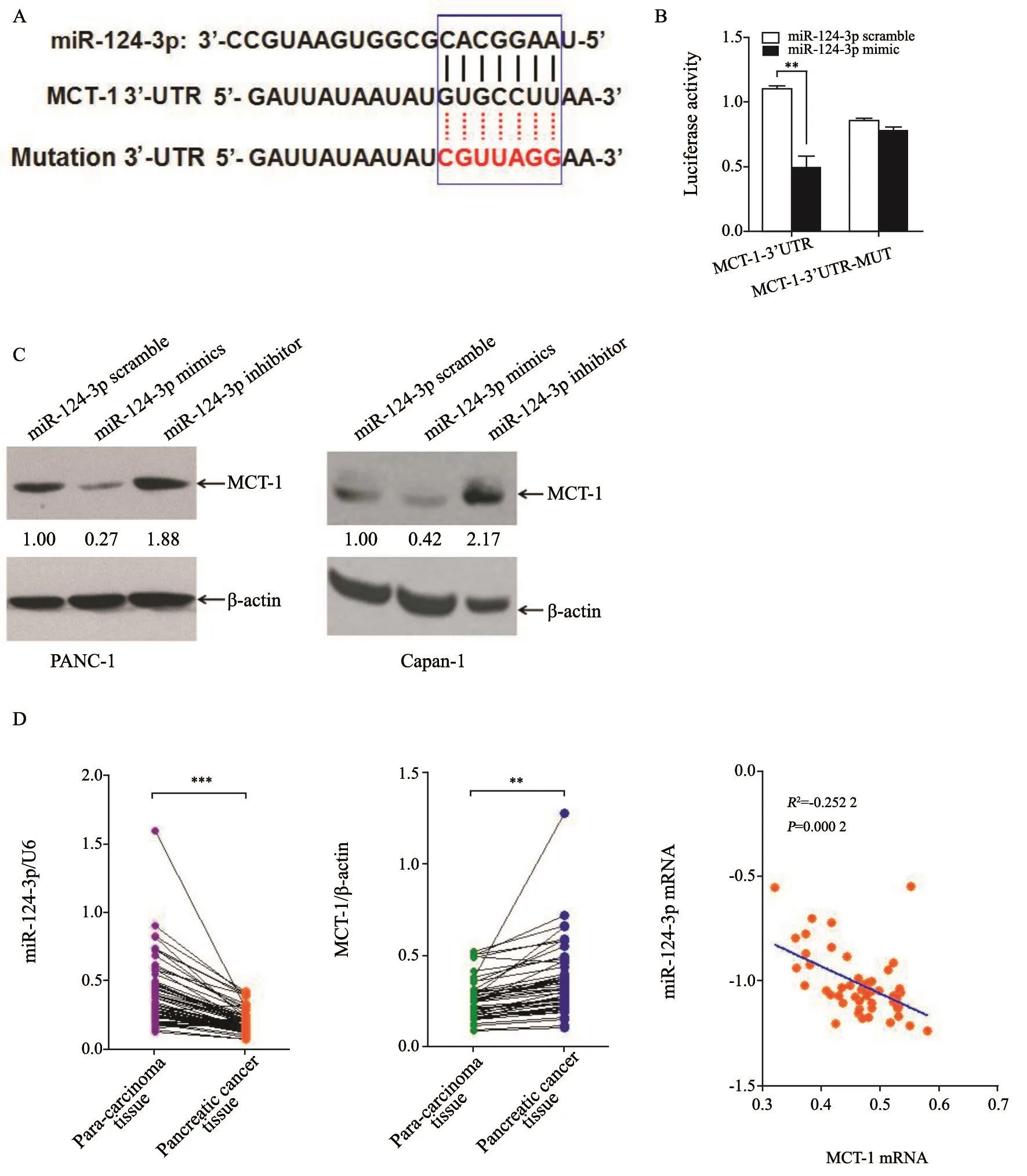
图 4 miR-124-3p负调控MCT1蛋白表达Fig. 4 miR-124-3p was identified to negatively regulate MCT1 expression
3 讨 论
本研究发现MCT1在胰腺导管癌组织中的表达显著上调,上调的MCT1与胰腺导管癌的分化程度、临床分期、淋巴结转移和预后具有显著相关性。在体外细胞系水平上,沉默MCT1能够显著抑制胰腺癌细胞的增殖、迁移和侵袭能力。结果提示,MCT1在胰腺导管癌中起着癌基因的作用[13],可能是胰腺导管癌治疗的一个潜在靶标。
MCT作为一种跨膜转运蛋白,存在于多种肿瘤细胞中。主要参与乳酸及其他单羧酸的跨膜转运,特别是对乳酸具有较高的亲和力[13]。MCT家族已发现有14个成员,分别命名为MCT1到MCT14,他们具有相似的生化特征及不同的组织分布,但均能跨越细胞膜快速转运H+/乳酸。在肿瘤组织中以MCT1和MCT4最为常见[3],几乎所有的肿瘤均含有这两种蛋白。并且MCT1与MCT4均需要CD147的辅助才能起作用。因此,在本研究中我们主要关注MCT1在胰腺导管癌中表达的临床病理学意义及在体外胰腺癌细胞中所介导的生物学作用。本研究发现,MCT1在胰腺导管癌组织中显著高表达,这与De Oliveira等[14]在胃肠道间质瘤中的报道是一致的,即MCT1在胃肠道间质瘤中显著高表达,且其表达与预后差具有显著相关性。MCT1在胰腺导管癌中的表达与预后差有关,这与Simoes-Sousa等[15]在口腔癌中及Johnson等[16]在乳腺癌中的发现均相一致,即MCT1高表达与预后差具有显著相关性。我们在体外胰腺癌细胞系PANC-1和Capan-1中发现,沉默MCT1表达能够显著抑制胰腺癌细胞的增殖、迁移和侵袭;Payen等[17]的报道支持了我们的这一结果,提示MCT1是肿瘤转移的相关基因。亦有研究发现,MCT1与肿瘤化疗耐药相关[18]。本研究未能开展有关MCT1表达与化疗耐药的实验,因此有关MCT1的表达与化疗耐药相关性仍有待于进一步研究证实。此外,Jeon等[19]在肝癌细胞中深入分析了沉默MCT1后肝癌细胞在乳酸摄取、氧气消耗及脂肪合成方面的变化,发现沉默MCT1能够显著降低肝癌细胞对乳酸的摄取;此外,线粒体氧化磷酸化、脂肪合成及细胞增殖等均受到显著性抑制。本研究未能分析沉默MCT1后,胰腺癌细胞内乳酸浓度、线粒体氧化磷酸化和脂肪合成的变化;只观察到胰腺癌细胞增殖受到了显著性抑制。在后续研究中,我们将分析检测沉默MCT1后胰腺癌细胞内乳酸的浓度变化及相关代谢通路的改变。
为了探讨MCT1在胰腺癌中作用的相关机制,我们运用生物信息学分析预测了miR-124-3p可能是MCT1的一个负调控miRNA。随后的双荧光素酶报告载体实验及免疫印迹实验证实了miR-124-3p对MCT1 3’-UTR序列区域的结合,提示我们的假设是正确的。本研究发现,MCT1是miR-124-3p的一个新的负向调控靶基因。为了明确miR-124-3p在胰腺癌组织中的表达水平,我们运用RTFQ-PCR技术检测了51对新鲜冻存的胰腺癌及配对癌旁正常组织中miR-124-3p的表达水平,发现相比癌旁正常组织,miR-124-3p在胰腺癌组织中的表达显著下调,这与先前在胰腺癌中的报道[20-22]是一致的。miR-124-3p不仅在胰腺癌组织中显著低表达,在肝癌中亦呈现低表达[23],提示miR-124-3p在癌组织中可能起着类似抑癌基因的作用。本研究并未探讨miR-124-3p在胰腺癌细胞增殖、迁移和侵袭中所发挥的作用。本研究的样本例数有限,有待于进一步扩大样本量进行验证[24];此外,本研究未能分析沉默MCT1后,胰腺癌细胞内乳酸浓度的变化及线粒体氧化磷酸化的变化,这也是本研究的一大缺憾。考虑到MCT1需要CD147蛋白的辅助才能发挥功能[25],我们在后续实验中将继续探讨CD147在胰腺癌细胞中的作用。
综上所述,MCT1在胰腺导管癌中起着癌基因的作用,miR-124-3p能够负调控MCT1的表达。
