仙鹿健骨汤对膝骨性关节炎大鼠关节软骨损伤的修复作用及机制研究*
2019-04-29袁宝明冯学会李宇能
袁宝明 冯学会 李宇能
(1.北京朝阳急诊抢救中心,北京 100000;2.中国人民解放军第三〇二医院,北京 100039;3.北京积水潭医院,北京 100000)
膝骨性骨关节炎(KOA)临床表现为疼痛和肌肉骨骼疾病,可导致残疾,生活质量下降和严重的社会经济负担。其特征主要为膝关节软骨的退化、滑膜炎、骨重建和肌肉无力[1-3]。尽管已经进行了大量研究,但KOA的具体原因尚不清楚。目前,KOA关节软骨损伤的机制被认为与炎症免疫反应有关,p38在识别内源性激动剂中起重要作用,如大分子降解产物,热休克蛋白,蛋白水解物级联产物,破裂细胞的细胞内成分,以及被炎症激活的基因产物。有越来越多的证据证明p38在引发与关节炎中的具有重要作用[4-5]。p38的激活启动信号转导级联,最终激活核因子-κB(NF-κB)转录因子。作为p38信号传导中最重要的下游分子之一通路,NF-κB是许多细胞因子表达所需的转录因子,包括基质金属蛋白酶(MMP)的调节,这有助于细胞外基质的降解,增加膝关节软骨损伤[6-8]。在各种MMP中,胶原酶如MMP-1和MMP-3通过降解细胞外基质在KOA进展中起关键作用。此外,在炎症介质中,白细胞介素-1β(IL-1β)与KOA中的炎症和软骨退化中的滑膜有关[9-10]。仙鹿健骨汤具有抗炎、成骨细胞修复的功效。本研究拟探讨仙鹿健骨汤对KOA大鼠关节软骨损伤的修复作用及机制,为KOA大鼠关节软骨损伤的治疗提供理论及临床依据。现报告如下。
1 材料与方法
1.1 实验动物 清洁级SD(Sprague Dawley)大鼠100只,12 周龄,体质量(117.43±13.21) g,湖南斯莱克实验动物有限公司提供 [许可证号:SCXK (湘)2011-0003],动物自由摄取饲料、自由饮水,自动控制昼夜循环(12/12 h),室温(22±1) ℃。
1.2 试药与仪器 仙鹿健骨汤组成:淫羊藿20 g,鹿角胶 12 g,紫河车 10 g,补骨脂 12 g,白术 12 g,山药12 g,鸡血藤 15 g,当归 12 g,石菖蒲 12 g。 制作工艺为:仙鹿健骨原药适度粉碎。按1∶4物液比加入蒸馏水浸泡24 h,70℃水浴加热回流提取,每次加热2 h,共4次。提取液趁热过滤,药渣按1∶20物液比加入蒸馏水,加热2 h,提取温度保持在70℃,回流提取4次,最后将提取液合并浓缩,每克仙鹿健骨汤浓缩液相当于生药5.14 g。将浓缩液溶入蒸馏水,根据成人剂量公式换算,大鼠用药量为成人的20.13倍,以10.0 mL/kg体质量灌胃,将药液浓度配制成为10.0 g/mL。p38、NF-κB、MMP-9、MMP-13、IL-1β ELISA 试剂盒购于上海邦奕生物科技有限公司、热电MK3酶标仪。Trizol RNA提取试剂和逆转录 (RT)试剂盒购自美国的Invitrogen Corporation(City,State,USA),P38、NF-кB RNA 定量逆转录酶聚合酶链反应 (qRT-PCR)试剂盒购自上海Gene Pharma有限公司。使用的TePCR热循环仪是Ro-che Light Cycler(Kaiseraugst,Rheinfelden,Switzerland)。
1.3 分组与造模 根据体质量随机分成5组:对照组、模型组、仙鹿健骨汤低剂量组(10.0 mg/kg)、仙鹿健骨汤中剂量组 (20.0 mg/kg)、仙鹿健骨汤高剂量组(40.0 mg/kg)、每组20只,雌雄各半。模型组、仙鹿健骨汤各剂量组腹腔注射6%戊巴比妥钠进行麻醉,取仰卧位固定操作台上,右侧后肢膝关节内侧备皮,取髌骨内侧纵行术口长约1 cm,逐层暴露,寻找并剪断大鼠膝关节内侧副韧带,切除内侧半月板,剪断前后交叉韧带。完成后无菌0.9%氯化钠注射液冲洗关节,缝合术口,包扎固定。术后,肌注青霉素连续3 d(8万U)。
1.4 给药方法 仙鹿健骨汤各剂量组于造模成功第1天开始给予相应药物灌胃(灌胃体积1.0 mL/100 g),持续给予3个月,对照组和模型组给予等体积0.9%氯化钠注射液。实验结束后,进行大鼠KOA软骨Mankin′s评分。
1.5 标本采集与检测 1)p38、NF-кB在膝关节软骨组织中表达的测定。根据制造商的说明,使用Trizol Reagent(Invitrogen,USA)从膝关节软骨组织(癌旁组织)中提取总RNA。使用One Step PrimeScript miRNA cDNA合成试剂盒(TaKaRa)将RNA逆转录为cDNA,并使用 SYBR Premix Ex TaqⅡ(TaKaRa)进行定量实时PCR。使用内源性U6小核RNA(U6)进行标准化(U6 正向引物 5′-CTCGCTTCGGCAGCACA-3′; 反向5′-AACGCTTCACGAATTTGCGT-3′)。 通过 2-ΔΔCT方法计算p38、NF-κB在膝关节软骨组织中的相对表达水平。PCR引物的序列如下:p38正向引物:5′-AGTCTATACAAGGGCAAGCTCTC-3′, 反向引物:5′-CCCAATACGACCAAATCCGTT-3′;NF-κB 正向引物:5′-ATTTCACCAATCTTGTCTCCATCA-3′, 反向引物:5′-CTCCTCCTGTTC GACAGTCAGC-3′。 反应体系为:正向引物 10 μL、 反向引物 10 μL、RNA 模版 0.6 μL、超级酶混合物 0.2 μL、2×μByr一步法 RT-qPCR 缓冲液5 μL、去 RNA 水 3.4 μL。循环如下:95 ℃持续 10 min,进行40个循环,持续15 s温度60℃。2)ELISA测定大鼠膝关节软骨组织中 p38、NF-κB、MMP-9、MMP-13、IL-1β蛋白水平。按照无菌条件操作,称取0.1 g膝关节软骨组织组织,加入少量液氮,在研钵中迅速将膝关节软骨组织碾碎至粉末状;将组织粉末转入2 mL Eppendorf管中,加入 1.2 mL PBS(pH7.4),充分振荡混匀,2 000 g,4℃,离心20 min。仔细收集上清液。获取膝关节软骨组织匀浆后,采用Elisa法检测膝关节软骨组织中 p38、NF-κB、MMP-9、MMP-13、IL-1β 蛋白水平。3)免疫组化方法测定p38、NF-κB蛋白在大鼠膝关节软骨组织的表达。大鼠取膝关节软骨组织制作常规石蜡切片,3%H2O2液常温阻断内源性过氧化氢酶活性, 微波修复抗原,PBS常规冲洗,1%p38、NF-κB抗体工作液,4℃过夜,加入二抗(IgG),室温 30 min,加链霉素抗生物素蛋白-过氧化物,PBS冲洗,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,封片。采用双盲法统计结果,随机选取5个高倍视野(×400)计数,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为 3 分,同时计数;>50%为(+++),26%~50%为(++),6%~25%为(+),阳性细胞≤5%为(-)。
1.6 统计学处理 应用Epidata、SPSS19.0对数据进行录入、统计学分析。计量资料以(±s)表示,分析前进行正态检验,若满足正态性,采用LSD-q两两检验,若不满足正态性,数据转换后再进行LSD-q检验,检验水准α为0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠膝关节软骨结构比较 见图1。对照组膝关节软骨结构完整,软骨表面光滑,软骨细胞分布均匀且排列整齐,核呈卵圆形位于中央,较为清晰,未见炎症细胞浸润;模型组软骨组织坏死,呈均质红染,软骨细胞疏松紊乱,结构破坏,崩解,结构紊乱,核固缩、大量中性粒细胞浸润,纤维组织增生;仙鹿健骨汤组高剂量组软骨细胞染色清晰,可见少量坏死软骨细胞,伴少量淋巴、中心细胞浸润,纤维组织增生减少;仙鹿健骨汤组中、低剂量组较模型组而言,软骨表面局部粗糙不平、溃疡形成坏死软骨细胞减少,炎症细胞浸润减少,但软骨结构疏松紊乱,具有明显的剂量依赖效应。

图1 各组大鼠膝关节软骨结构比较(HE染色,400倍)
2.2 各组大鼠膝关节软骨p38、NF-κB mRNA表达水平与Mankin′s评分比较 见表1。与对照组比较,模型组、仙鹿健骨汤各剂量组p38、NF-κB mRNA表达水平明显升高(P<0.05);与模型组比较,仙鹿健骨汤各剂量组 p38、NF-κB mRNA 表达水平明显降低(P<0.05),且随着仙鹿健骨汤给药剂量的增加,p38、NF-κB mR NA表达水平逐渐降低,剂量-效应关系明显(P<0.05)。与对照组比较,模型组、仙鹿健骨汤各剂量组KOA软骨 Mankin′s评分升高(P<0.05);与模型组比较,仙鹿健骨汤各剂量组 Mankin′s评分显著降低(P<0.05),且随着仙鹿健骨汤组给药剂量的增加,Mankin′s评分逐渐降低,剂量-效应关系明显(P<0.05)。
表1 各组大鼠膝关节软骨p38、NF-κB mRNA表达水平与Mankin′s评分比较(x±s)

表1 各组大鼠膝关节软骨p38、NF-κB mRNA表达水平与Mankin′s评分比较(x±s)
与对照组比较,*P<0.05;与模型组比较,△P<0.05。 下同
组 别 n Mankin′s评分(分)对照组 20 1.30±0.42模型组 20 13.65±1.98*仙鹿健骨汤低剂量组 20 10.05±1.23*△p38 mRNA NF-κB mRNA 0.76±0.17 0.96±0.16 3.98±0.12* 3.78±0.15*3.19±0.17*△ 2.89±0.19*△仙鹿健骨汤中剂量组 20 6.23±1.87*△2.12±0.16*△ 2.10±0.23*△仙鹿健骨汤高剂量组 20 1.13±0.20*△ 1.22±0.15*△ 2.40±1.54*△
2.3 各组大鼠膝关节软骨p38、NF-κB蛋白表达水平比较 见表2,图2~图3。与对照组比较,模型组、仙鹿健骨汤各剂量组p38、NF-κB蛋白表达水平明显升高(P<0.05);与模型组比较,仙鹿健骨汤各剂量组p38、NF-κB mRNA 表达水平明显降低(P<0.05),且随着仙鹿健骨汤给药剂量的增加,p38、p38、NF-κB蛋白表达水平逐渐降低,剂量-效应关系明显(P<0.05)。免疫组化法下,p38、NF-κB阳性表达为棕褐色,各组p38、NF-κB阳性表达情况与各蛋白表达水平符合。
表2 各组大鼠膝关节软骨P38、NF-κB蛋白表达水平比较(ng/g,x±s)
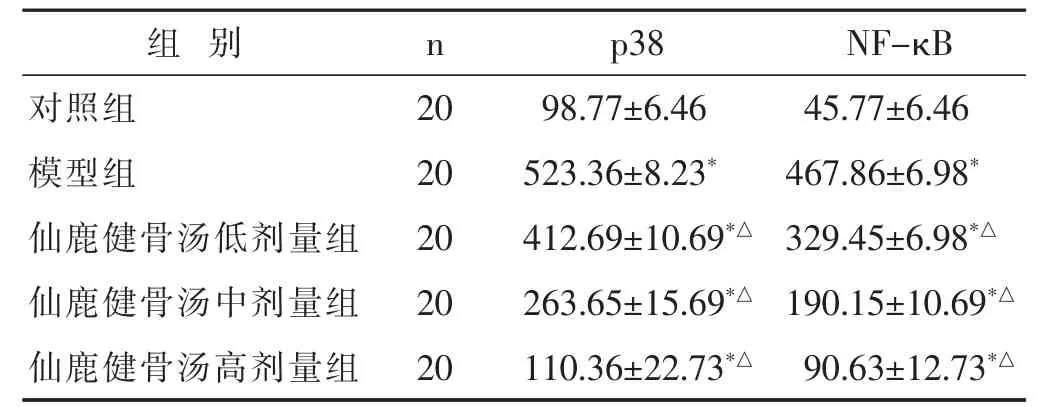
表2 各组大鼠膝关节软骨P38、NF-κB蛋白表达水平比较(ng/g,x±s)
组 别 n对照组 20模型组 20仙鹿健骨汤低剂量组 20 p38 NF-κB 98.77±6.46 45.77±6.46 523.36±8.23* 467.86±6.98*412.69±10.69*△ 329.45±6.98*△仙鹿健骨汤中剂量组 20 263.65±15.69*△ 190.15±10.69*△仙鹿健骨汤高剂量组 20 110.36±22.73*△ 90.63±12.73*△
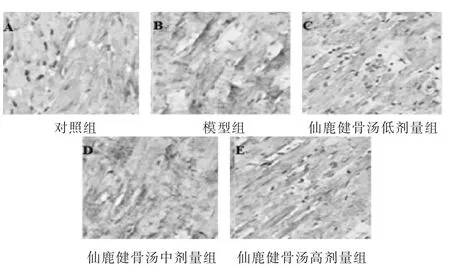
图2 各组大鼠膝关节软骨p38表达比较(免疫组化,1 000倍)
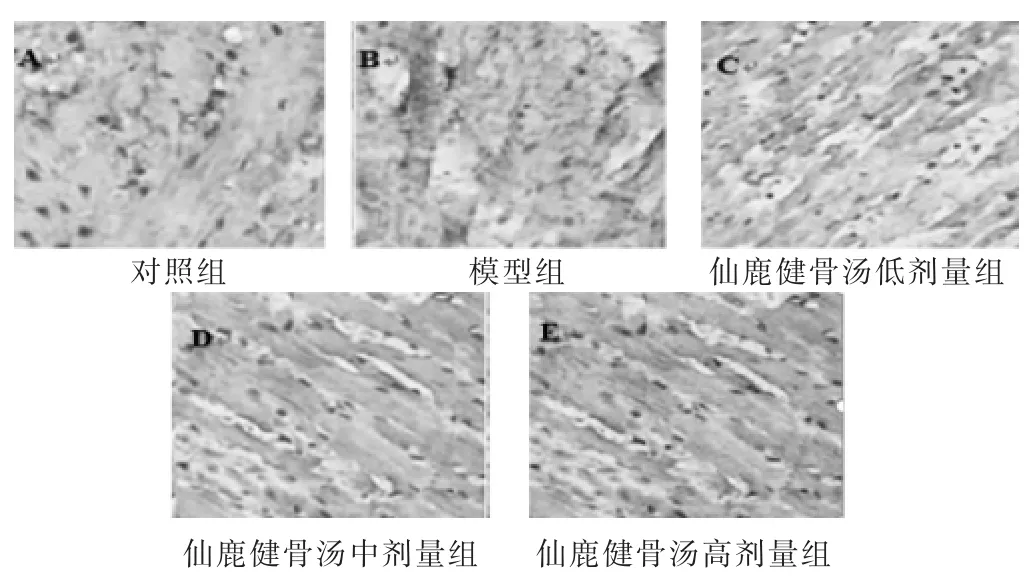
图3 各组大鼠膝关节 软骨NF-κB表达比较(免疫组化,1 000倍)
2.4 各组大鼠膝关节软骨 MMP-9、MMP-13、IL-1β蛋白表达水平比较 见表3。与对照组比较,模型组、仙鹿健骨汤各剂量组MMP-9、MMP-13、IL-1β蛋白表达水平明显升高(P<0.05);与模型组比较,仙鹿健骨汤各剂量组MMP-9、MMP-13、IL-1β蛋白表达水平明显降低 (P<0.05),且随着仙鹿健骨汤给药剂量的增加,MMP-9、MMP-13、IL-1β 蛋白表达水平逐渐降低,剂量-效应关系明显(P<0.05)。
表3 各组大鼠膝关节软骨MMP-9、MMP-13、IL-1β蛋白表达水平比较(ng/g,x±s)

表3 各组大鼠膝关节软骨MMP-9、MMP-13、IL-1β蛋白表达水平比较(ng/g,x±s)
组 别 n IL-1β对照组 20 99.36±18.63模型组 20 589.36±18.34*仙鹿健骨汤低剂量组 20 432.39±15.39*△MMP-9 MMP-13 78.98±16.32 123.65±23.21 326.21±19.69* 413.65±13.69*261.36±15.32*△ 302.67±19.32*△仙鹿健骨汤中剂量组 20 269.25±19.99*△196.32±18.32*△ 203.36±17.32*△仙鹿健骨汤高剂量组 20 171.32±24.36*△ 160.68±36.69*△ 1 393.26±26.39*△
3 讨 论
目前,临床上已将非甾体消炎药,皮质类固醇和透明质酸用于临床治疗KOA。但是,它们不能逆转软骨损伤,还导致不良的心血管和胃肠道副作用。因此,需要用于治疗KOA的新型更好的药剂。仙鹿健骨汤是从中草药鹿角胶、骨碎补、仙茅、黄芪、白术、仙鹤草、当归中纯化的汤剂,据报道它在体外和体内作为抗氧化剂和抗炎剂起作用[11-12]。仙鹿健骨汤预处理可以防止成骨细胞在无血清培养条件下诱导细胞凋亡。这种作用可能与其抗氧化潜力有关,阻断HIF-1α/SDF-1通路的激活[13]。本研究结果显示,与对照组比较,模型组、仙鹿健骨汤各剂量组KOA软骨Mankin′s评分升高;与模型组比较,仙鹿健骨汤各剂量组Mankin′s评分显著降低,且随着仙鹿健骨汤组给药剂量的增加,Mankin′s评分逐渐降低,剂量-效应关系明显;这说明仙鹿健骨汤能对膝骨性关节炎关节软骨损伤具有一定程度的修复作用。病理学结果显示对照组膝关节软骨结构完整,软骨表面光滑,软骨细胞分布均匀且排列整齐,核呈卵圆形位于中央,较为清晰,未见炎症细胞浸润;模型组软骨组织坏死,呈均质红染,软骨细胞疏松紊乱,结构破坏,崩解,结构紊乱,核固缩、大量中性粒细胞浸润,纤维组织增生;仙鹿健骨汤组高剂量组软骨细胞染色清晰,可见少量坏死软骨细胞,伴少量淋巴、中心细胞浸润,纤维组织增生减少;仙鹿健骨汤组中、低剂量组较模型组而言,软骨表面局部粗糙不平、溃疡形成坏死软骨细胞减少,炎症细胞浸润减少,但软骨结构疏松紊乱,具有明显的剂量依赖效应。这提示仙鹿健骨汤能减轻明显减轻软骨细胞损伤程度。
p38在控制先天免疫中起关键作用,其能激活先天免疫响应多种病原体相关分子模式[14-15]。p38介导的细胞内信号通路会聚以激活NF-κB和c-Jun N末端激酶(JNKs),这些激酶诱导一系列炎症细胞因子的转录,这些细胞因子参与炎症反应的启动或调节[16]。已经在人类细胞和其他一些物种的膝关节软骨中发现了p38。p38家族也可以被许多内源性配体激活,如热休克蛋白,坏死细胞,细胞外基质和受损脊髓中的氧化脂质[17]。 本次研究同时提示,NF-κB信号通路的激活是大鼠膝骨性关节炎软骨损伤的核心。通过损伤诱导的氧化应激,细菌内毒素和细胞因子,NF-κB可被激活。NF-κB的功能在于其调节多种细胞因子基因启动子的能力[18]。MMP-9和MMP-13由于它们能够切割细胞外基质而在OA中软骨降解的进展中起重要作用。MMP-9以不可逆转的方式分解纤维状胶原蛋白,而MMP-13降解多种基质底物,包括Ⅱ型胶原蛋白和聚集蛋白聚糖。许多研究报道,在KOA患者的滑膜,滑膜液和软骨中MMP-9水平上调,表明MMP-9在关节软骨的病理性降解中具有重要作用[19]。MMP-13可用作KOA进展的预后生物标志物。近年来,炎症介质IL-1β在骨关节炎发病机理中的作用越来越受到关注。IL-1β与KOA的炎症和软骨退化中的滑膜有关[20]。KOA患者的滑膜液和软骨中存在升高的IL-1β水平,暗示IL-1β在KOA的发病机制中起作用。本研究结果显示,与对照组比较,模型组、仙鹿健骨汤各剂量组p38、NF-κB mRNA、蛋白表达水平明显升高;与模型组比较,仙鹿健骨汤各剂量组p38、NF-κB mRNA、蛋白表达水平明显降低,且随着仙鹿健骨汤给药剂量的增加,p38、NF-κB mRNA、蛋白表达水平逐渐降低,剂量-效应关系明显;而膝骨性关节炎大鼠关节软骨损伤模型大鼠MMP-9、MMP-13、IL-1β水平明显上调,给予仙鹿健骨汤后可以抑制其表达。这说明仙鹿健骨汤组能通过抑制炎症信号通路p384、NF-κB mRNA、蛋白表达水平的表达进而抑制细胞因子MMP-9、MMP-13、IL-1β的表达。
综上所述,仙鹿健骨汤能减轻明显减轻软骨细胞损伤程度,对KOA节软骨损伤具有一定程度的修复作用,其机制与仙鹿健骨汤组能通过抑制炎症信号通路p384、NF-κB mRNA、蛋白表达水平的表达进而抑制细胞因子 MMP-9、MMP-13、IL-1β 的表达有关。
