调胃承气汤对肠源性脓毒症大鼠血液流变学指标和凝血功能的影响*
2019-04-29赵锋利张先进徐运升林新峰冼绍祥
赵锋利 赵 馥 张先进 徐运升 曹 蕊 林新峰 冼绍祥
(广州中医药大学第一附属医院,广东 广州 510405)
脓毒症是在细菌、内毒素等有害物质侵入机体后引起机体产生全身炎症反应综合征(SIRS),导致多器官功能障碍,在ICU死亡率较高达25%的一种疾病[1]。脓毒症发生时常伴有严重炎症反应发生,后续会引起血液流变性异常与凝血功能障碍,进而引发弥散性血管内凝血(DIC),使微循环过程发生障碍。这一异常变化会引起组织缺血缺氧,从而加剧炎症因子对于小肠等多种组织器官的破坏,形成多器官功能障碍综合征(MODS)[2]。有研究证明调胃承气汤具有一定的抗菌,增强免疫的功能,有改善肠道血液循环的作用[3]。本实验研究意在应用符合临床表征的脓毒症模型,观察调胃承气汤通过对肠源性脓毒症大鼠血液流变学指标和凝血功能的影响,并探讨其改善肠黏膜屏障功能的机制。现报告如下。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠40只,体质量280~320 g,由广东省医学实验动物中心提供,实验动物生产许可证号SCXK(粤)2013-0002,实验动物质量合格证号No.44007200047550。动物实验环境:广东省中医药工程技术研究院SPF级动物实验室,设施使用许可证号SYXK(粤)2010-0059。
1.2 试药与仪器 调胃承气汤高剂量组为9.45 g/kg,低剂量组为4.73g/kg。大黄(130908261)、芒硝(130707541)、甘草(130713191)均购自康美药业股份有限公司。活化部分凝血活酶时间(APTT)测定试剂盒(凝固法,生产批号 173211012);凝血酶原时间(PT)测定试剂盒(凝固法,生产批号 176209011);凝血酶时间(TT)测定试剂盒(凝固法,生产批号172911011)。以上试剂均购自北京普利生仪器有限公司。大鼠肿瘤坏死因子-α酶联免疫检测试剂盒(TNF-α),生产批号 569180115;大鼠D-乳酸酶联免疫检测试剂盒 (D-LA),生产批号254180115。以上试剂盒均购自天津安诺瑞康生物技术有限公司。锇酸晶体、Epon812纯树脂与柠檬酸铅,均购自美国TED PELLA公司;醋酸双氧铀,购自美国SPI公司。C2000-A高性能血凝仪(北京普利生仪器有限公司)。Hemsr全自动血流变检测仪(LBY-N7500A,中国);L-600台式大容量低速离心机 (上海利鑫坚离心机有限公司);Varioskan Flash型全波长多功能酶标仪,美国Thermo公司;UC-7超薄切片机,德国莱卡公司;JEM-1400 PLUS日本电子透射电子显微镜,日本JEOL公司。
1.3 模型制备 根据临床表现,采用表征与之最为相似的盲肠结扎穿刺法(CLP)建立肠源性脓毒症大鼠模型[4]。造模前大鼠禁食12 h,不禁水,用10%水合氯醛(3 mL/kg)腹腔注射以麻醉大鼠。大鼠处于麻醉状态后备皮,采用无菌手术刀沿腹中线盲肠区域开口约1~2 cm,小心取出盲肠并置于消毒纱布上,用消毒棉签将部分粪便推至盲肠尾端。采用1号医用真丝编织线结扎盲肠中段,注射1 mL 0.9%氯化钠注射液稀释粪便以便流出,用10 ml注射器针头将盲肠穿3次孔,粪便能顺利慢慢流出即可,将盲肠放回腹腔。逐层缝合后腹腔注入5 mL 37℃0.9%氯化钠注射液进行生理复苏大鼠。归笼,自由饮食饮水。
1.4 分组与给药 采用随机数字表法将40只雄性SD大鼠随机分为5组,每组8只。具体组别与给药方案见表1。给药时间为模型建立成功后2 h、10 h与24 h。
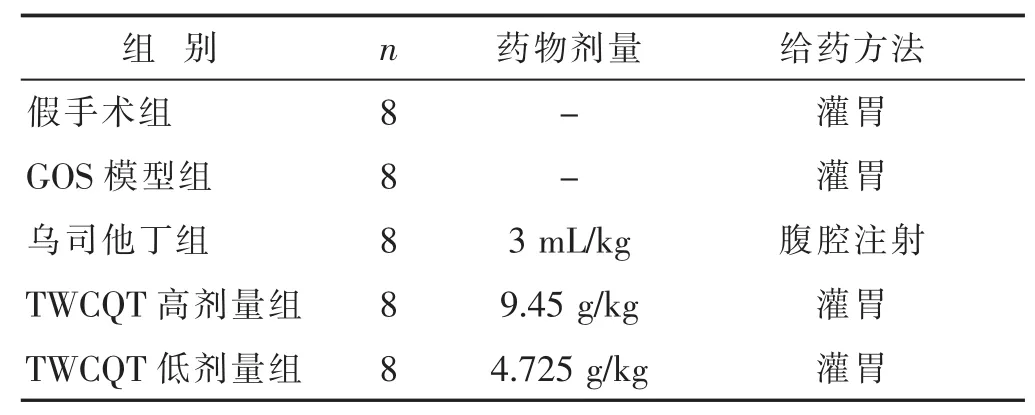
表1 大鼠组别与给药方案
1.5 标本采集与检测 24 h给药完成0.5 h后用10%水合氯醛麻醉大鼠,腹主动脉采血,3 mL枸橼酸抗凝血,4 mL非抗凝血,血液3 000 r/min离心10 min后取血清。取约1 mm3小肠组织块置于预冷2.5%中性戊二醛固定液中,前固定2 h或以上。以备电镜检查。1)血液系统相关指标检测。运用Hemsr全自动血流变检测仪检测各组大鼠全血黏度(低切、中切与高切)、红细胞聚集指数和血浆黏度;运用C2000-A高性能血凝仪检测各组大鼠血清中APTT、PT和TT。严格按照酶联免疫吸附(ELISA)试剂盒检测血清中TNF-α和D-LA含量。2)肠黏膜组织超微结构观察。取2.5%戊二醛固定标本,用0.1 mmol/L磷酸缓冲液漂洗6次,每次30 min。1%锇酸固定1.5~2 h。用0.1 mmol/L磷酸缓冲液漂洗3次,每次10 min。酒精梯度脱水,树脂浸透,包埋,固化,切8 nm超薄片,铀铅双染色,透射电镜下观察。
1.6 统计学处理 应用SPSS22.0统计软件。首先进行正态性检验和方差齐性检验,服从正态分布以(±s)表示,组间比较采用单因素方差分析,方差齐时用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血液流变学指标比较 见表2,图1。与假手术组相比,GOS模型组大鼠全血黏度(低切、中切与高切)、红细胞聚集指数与血浆黏度显著升高 (P<0.01)。与GOS模型组相比,乌司他丁组、TWCQT高剂量与低剂量组大鼠全血黏度(低切、中切与高切)、红细胞聚集指数与血浆黏度显著降低(P<0.01)。
表2 各组大鼠血液流变学指标比较(x±s)
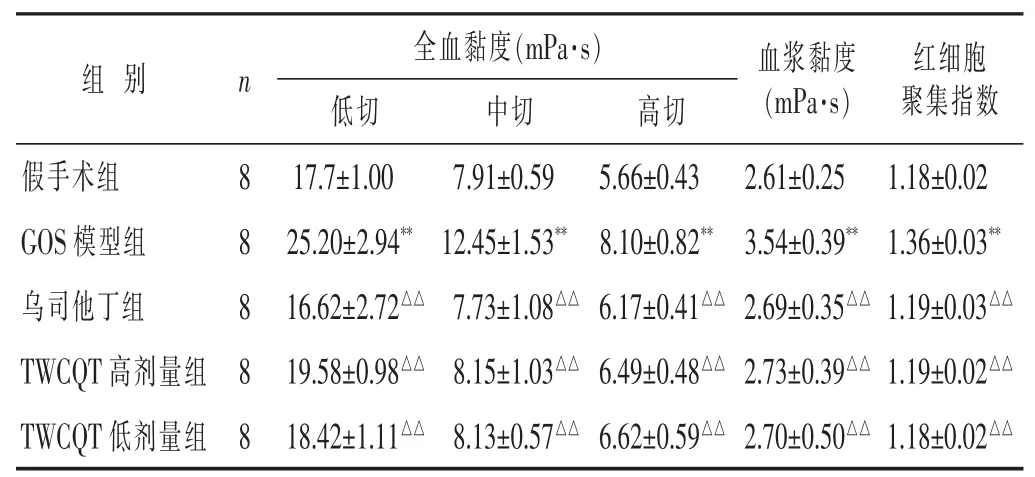
表2 各组大鼠血液流变学指标比较(x±s)
与假手术组比较,**P<0.01;与 GOS 模型组比较,△△P<0.01。 下同
全血黏度(mPa·s)组 别 n低切 中切 高切17.7±1.00 7.91±0.59 5.66±0.43 2.61±0.25 1.18±0.02血浆黏度(mPa·s)红细胞聚集指数假手术组 8 GOS模型组 8乌司他丁组 8 25.20±2.94**12.45±1.53** 8.10±0.82**16.62±2.72△△ 7.73±1.08△△ 6.17±0.41△△3.54±0.39**1.36±0.03**2.69±0.35△△ 1.19±0.03△△TWCQT高剂量组 8 TWCQT低剂量组 8 19.58±0.98△△ 8.15±1.03△△ 6.49±0.48△△ 2.73±0.39△△ 1.19±0.02△△18.42±1.11△△ 8.13±0.57△△ 6.62±0.59△△ 2.70±0.50△△ 1.18±0.02△△

图1 各组大鼠血液流变学指标变化
2.2 各组大鼠凝血功能的比较 见表3,图2。与假手术组相比,GOS模型组大鼠血清中APTT、PT与TT显著延长(P<0.01)。与GOS模型组相比,乌司他丁组、TWCQT高剂量与低剂量组大鼠血清中APTT、PT与TT 明显缩短(P<0.01)。
2.3 各组大鼠血清中相关指标的比较 见表4,图3。与假手术组相比,模型组血清中TNF-α和D-LA含量显著升高(P<0.01)。与GOS模型组相比,乌司他丁组、TWCQT高与低剂量组血清中TNF-α和D-LA含量显著降低(P<0.01)。
表3 各组大鼠凝血功能比较(s,x±s)

表3 各组大鼠凝血功能比较(s,x±s)
组 别 n TT假手术组 8 23.80±1.26 GOS模型组 8 33.92±3.20**乌司他丁组 8 25.20±3.43△△APTT PT 27.17±2.01 15.92±0.70 44.02±2.82**23.72±1.38**28.80±1.20△△ 17.51±1.08△△TWCQT高剂量组 8 27.89±2.49△△32.84±2.26△△ 18.75±1.11△△TWCQT 低剂量组 8 32.07±2.58△△17.40±1.13△△ 25.56±1.81△△

图2 各组大鼠凝血功能的变化
表4 各组血清TNF-α和D-LA含量比较(s,x±s)

表4 各组血清TNF-α和D-LA含量比较(s,x±s)
组 别假手术组GOS模型组乌司他丁组TWCQT高剂量组TWCQT低剂量组n 8 8 8 TNF-α(pg/mL) D-LA(nmol/mL)85.63±8.93 0.18±0.02 125.69±9.10** 0.37±0.04**93.54±9.45△△ 0.23±0.04△△8 93.72±6.09△△ 0.26±0.05△△8 90.61±10.13△△ 0.25±0.03△△
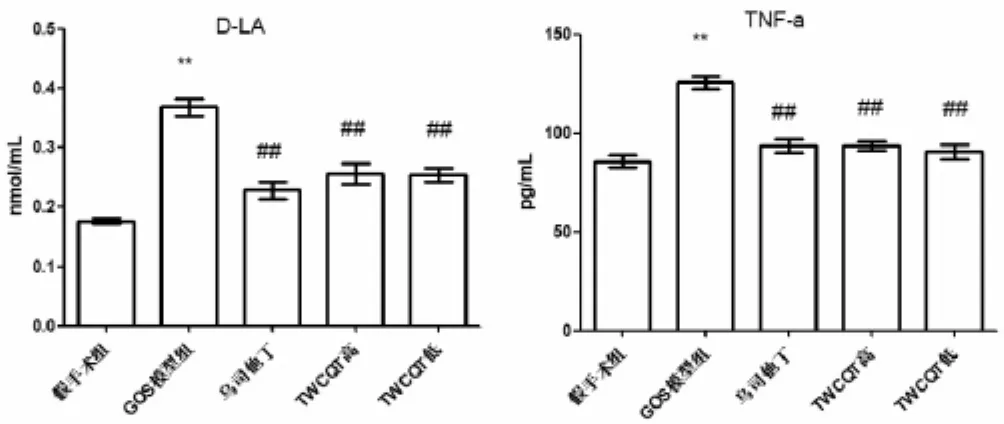
图3 各组大鼠血清TNF-α和D-LA含量的变化
2.4 各组大鼠肠黏膜结构电镜观察 见图4。假手术组大鼠微绒毛结构完整且排列紧密,线粒体与内质网等细胞器无异常,紧密连接并无增宽;GOS模型组大鼠微绒毛严重断裂脱落,线粒体严重肿胀且破裂,内质网变形,紧密连接扩张;乌司他丁组、TWCQT高剂量组与低剂量组大鼠较GOS模型组微绒毛无断裂脱落,线粒体无严重肿胀,内质网破坏较少,紧密连接无明显扩张,整体结构完整。
3 讨 论

图4 各组大鼠肠黏膜超微结构
脓毒症初发期,细菌与内毒素感染迫使机体迅速启动抗炎系统进行调控,大量炎症因子释放入血[5]。产生的炎症因子直接损伤具有抗凝与抗黏附作用的血管内皮细胞,内皮细胞功能破坏后可引起出血导致DIC,伴随血液流变学指标与凝血功能异常[6]。这种血液循环系统的障碍会延长炎症因子在组织中的浸润,产生持久性的器官损害作用[7]。一般肠黏膜组织最先受到炎症因子的攻击[8],因此,血液流变学与凝血功能的障碍使得小肠黏膜组织屏障功能被炎症因子破坏后,会引起其破坏作用的进一步加剧形成SIRS,导致多种器官的障碍,加剧脓毒症的危害。
一旦炎症因子激活凝血系统,抗凝血酶与凝血因子之间平衡打破。同时,纤溶系统被抑制,造成纤维蛋白溶解速度远小于形成速度。二者将导致凝血功能的严重紊乱,且呈现出凝血系统激活后又促进炎症因子作用的正反馈调节,加重炎症反应的进行[9]。现代医学研究中,通过对凝血功能指标APTT、PT与TT的测定,可判断机体凝血功能的变化情况[10]。脓毒症炎症反应使血液黏度增加,导致血液循环阻力增大,血流速度减慢,血管内皮及其他组织细胞缺血缺氧,这种血液流变学指标异常会引起组织器官的损伤[11]。血液流变学指标中的红细胞聚集指数反映红细胞表面电荷大小,其值越大细胞越趋向于聚集,引起全血黏度增大。血浆黏度指标的变化也可反应凝血功能的变化,血浆黏度值越大表明其加速纤维蛋白原的“搭桥”的作用越强,从而加速凝血过程的能力越强[12]。因此,检测血液流变学与凝血功能指标即可反映血液循环系统障碍变化,从而判断其对机体炎症反应的影响程度。
当细菌、内毒素进入血液循环系统引起感染时,体内促炎因子与抗炎因子的动态平衡状态被打破,刺激巨噬细胞等分泌大量TNF-α等促炎因子,进而对组织器官产生损伤作用[13]。因此,血清中TNF-α可判断机体炎症反应严重程度;D-LA是胃肠道内大肠杆菌、乳酸菌、克雷白杆菌等多种固有细菌产生的代谢产物,哺乳动物正常组织无法产生D-LA,并且也无相应的乳酸脱氢酶将其代谢[14]。当肠黏膜屏障受损时,D-LA会通过受损黏膜进入血液循环,此时血中D-LA水平显著增加。因此,检测血中D-LA含量即可反映肠黏膜受损程度。
本研究结果显示,调胃承气汤能显著抑制肠源性脓毒症大鼠APTT、PT与TT的延长,抑制肠源性脓毒症大鼠全血黏度、血浆黏度与红细胞聚集数的增加,有效地改善脓毒症的血液流变性与凝血功能障碍。血清中TNF-α的显著降低也反映了调胃承气汤对血液循环系统的改善作用,从而抑制了炎症反应的加剧。肠黏膜超微结构与D-LA含量变化则显示调胃承气汤减少了炎症因子对小肠黏膜组织的破坏,起到肠黏膜屏障功能的保护作用。
综上,调胃承气汤能有效地改善肠黏膜屏障功能,这种改善作用的机制可能是调胃承气汤能通过对肠源性脓毒症大鼠血液流变学指标和凝血功能的影响,减少炎症因子对肠黏膜组织结构的破坏作用。
