苏木乙酸乙酯提取液靶向调控miRNA-99a抑制动脉粥样硬化的作用机制研究*
2019-04-29曹丽娟周亚滨
于 玲 曹丽娟 孙 静 周亚滨△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江哈尔滨 150040)
心源性死亡仍然是目前世界范围内导致死亡的主要原因,据调查数据显示,每年有超过1 700万人死于心血管疾病[1]。作为心源性死亡的独立预测因素之一,冠状动脉粥样硬化斑块病变是导致管腔狭窄、闭塞的主要原因,能够引发心肌缺血或心肌坏死,增加冠状动脉不良事件的风险[2]。因此,减少动脉粥样硬化斑块病变是改善患者预后的主要途径之一。
作为血管壁最丰富的固有细胞,血管平滑肌细胞(VSMC)在维持血管张力和血管壁结构的构成中扮演着重要的角色。既往研究证实,VSMC的过度增殖是造成动脉粥样硬化、血管成形术后再狭窄和肺动脉高压的病理学基础,故调控VSMC的增殖和凋亡,是预防冠状动脉病变的关键[3]。我们前期研究发现,苏木乙酸乙酯提取液(SAEE)不仅能够抑制炎性因子的分泌,还能够改善动脉粥样硬化大鼠腹主动脉的组织形态和内皮细胞功能,并且抑制基质金属蛋白酶-9(MMP-9)蛋白的表达,从而起到抗动脉粥样硬化的作用[4]。因此本研究以细胞中miRNA-99a的表达为媒介,并通过观察VSMC的增殖和凋亡水平,进一步探索SAEE的抗动脉硬化作用机制和作用靶点。现报告如下。
1 材料与方法
1.1 细胞系 大鼠主动脉VSMC购于湖南丰晖生物科技有限公司,细胞常规培养于DMEM培养基中,培养条件:37℃,5%CO2。每3日换1次培养液,并以0.25%的胰酶消化传代,取3~6代细胞用于实验。
1.2 试剂与仪器 苏木生药购于黑龙江中医药大学附属第一医院,经乙醇提取、乙酸乙酯萃取后得SAEE(生药质量浓度设置为200 μg/mL);氧化型低密度脂蛋白(ox-LDL)购于广州奕元生物科技有限公司;胰蛋白酶、DMEM培养基、胎牛血清均购于美国Thermo Fisher公司;青霉素-链霉素溶液购于上海酶联生物研究所;Hilymax转染试剂盒购于上海东仁化学科技有限公司;MTT细胞增殖试剂盒、Annexin V-FITC凋亡试剂盒购于上海碧云天生物技术有限公司;兔抗大鼠Ki-67、PCNA、Bax、Bcl-2、MMP-1、TIMP-1、β-actin 单克隆抗体和辣根过氧化物酶(HRP)标记的羊抗兔二抗购于北京博尔迈生物技术有限公司。
1.3 细胞转染与分组 miRNA-99a模拟剂(mimics)和抑制剂(inhibitor)由上海拓然生物科技公司设计并化学合成,按照试剂盒设定的转染浓度,分别将miRNA-99a mimics和miRNA-99a inhibitor配制成终浓度为80 nmol/L和50 nmol/L的溶液。分别加入3 μL Hilymax转染试剂,混匀,冰上静置20 min。取对数生长期细胞,按照1×105/mL的密度接种于6孔板中,每孔2 mL。当细胞长至80%融合时,更换为无胎牛血清的无抗生素DMEM培养液。将细胞分为5组,空白组(20%无血清无抗生素DMEM),模型组(50 μg/mL ox-LDL),SAEE 组(200 μg/mL SAEE),miRNA-99a mimics组(80 nmol/L miRNA-99a micmics)和 miRNA-99a inhibitor组(50 nmol/L miRNA-99a inhibitor)。
1.4 检测指标 1)MTT法检测细胞增殖:取不同处理方法干预后VSMC细胞以1×104/孔接种于96孔板中,每组设6个复孔,实验平行设置24、48、72、96 h 4个时间点。每孔加入 20 μL MTT(5 mg/mL)后继续孵育 1 h,采用酶标仪测定各孔570 nm处吸光度(OD值)。2)流式细胞检测细胞凋亡:将不同处理方法干预后24 h的VSMC细胞接种于96孔板中,用1×Binding buffer配制成1×106个/mL的细胞悬液。分别加入5 μL Annexin V和10 μL的PI溶液染色15 min,流式细胞仪检测细胞凋亡。3)Western blotting检测细胞中蛋白的表达:各组细胞经处理48 h后,用PBS冲洗2次,加入含PMSF的RIPA裂解液冰上裂解30 min提取总蛋白。BCA法测定蛋白浓度,SDS-PAGE凝胶电泳分离,将蛋白转移至0.22 μm PVDF膜。5%脱脂牛奶封闭1 h,加入一抗,4℃孵育过夜,磷酸盐缓冲液洗涤5次,加入HRP标记的山羊抗兔二抗,室温孵育1 h。化学发光试剂显影后,凝胶图像分析系统采集图片并分析各蛋白条带灰度值。4)RT-PCR检测miRNA-99a的表达:各组细胞经处理48 h后,Trizol一步法提取总RNA,经纯化、定量后逆转录合成cDNA,采用SYBR Green I real-time PCR检测mRNA的相对表达量。引物设计如下(上海生工公司合成):miRNA-99a上游5′-CATTACTAAACCCGTAGATCCGAT-3′;下游 5′-TAT GGTTTTGACGACTGTGTGAT-3′;U6 上 游 5′-ATTGGAA CGATACAGAGAAGATT-3′;下游 5′-GGAACGC TTCACGAATTTG-3′。PCR循环条件为 95℃ 10 s;95℃ 5 s,60℃ 34 s,40个循环。以U6作为内参,并采用2-△△CT法分析miRNA-99a的相对表达量。
1.5 统计学处理 应用SPSS19.0统计软件。各组数据以(±s)表示,符合正态分布及方差齐性检验,则组间比较采用ANOVA分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组VSMC细胞增殖情况的比较 见表1。ox-LDL刺激后的VSMC细胞增殖能力显著增加,4个时间段与空白组比较,差异均具有显著统计学意义(P<0.01);miRNA-99a inhibitor组中VSMC细胞增殖能力显著增加,与模型组比较差异均有统计学意义(P<0.01),而SAEE组与miRNA-99a mimics组均能显著抑制VSMC细胞增殖,与模型组比较差异均有统计学意义(P<0.01)。
2.2 各组VSMC细胞凋亡率的比较 见表2,图1。模型组中VSMC细胞凋亡率显著增加,其中早期凋亡与空白组比较,差异无统计学意义(P>0.05),而晚期凋亡和总凋亡率与空白组比较,差异均有统计学意义(P<0.01);miRNA-99a inhibitor组中晚期凋亡和总凋亡率亦显著增加,与模型组比较,差异均有统计学意义(P<0.01)。SAEE组与miRNA-99a mimics组均能显著抑制VSMC细胞凋亡,其中以晚期凋亡和总凋亡率显著,与模型组比较,差异均有统计学意义(P<0.01),早期凋亡与模型组比较,差异无统计学意义(P>0.05)。
表1 各组VSMC细胞增殖情况的比较(吸光度值,x±s)

表1 各组VSMC细胞增殖情况的比较(吸光度值,x±s)
与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。下同
组 别 n空白组 6模型组 6 SAEE组 6 24 h 48 h 72 h 96 h 0.34±0.11 0.68±0.12 1.08±0.23 1.43±0.18 0.51±0.06△△ 1.07±0.13△△ 1.52±0.23△△ 2.02±1.10△△0.37±0.03**0.72±0.10**1.08±0.18** 1.45±0.23**miRNA-99a mimics组 6 0.40±0.03**0.79±0.11**1.14±0.13**1.52±0.17**miRNA-99a inhibitor组 6 0.64±0.06**1.32±0.23**1.86±0.15**2.44±0.29**
表2 各组VSMC细胞凋亡率的比较(%,x±s)

表2 各组VSMC细胞凋亡率的比较(%,x±s)
组别 n空白组 6模型组 6 SAEE组 6总凋亡率 早凋 晚凋6.64±1.08 1.96±0.03 4.68±1.10 11.66±1.60△△ 1.94±0.08 9.71±1.59△△6.98±1.28**2.04±0.12 4.94±1.18**miRNA-99a mimics组 6 8.72±1.01**2.04±0.09 6.68±1.02**miRNA-99a inhibitor组 6 14.03±1.42**1.86±0.09 12.17±1.40**
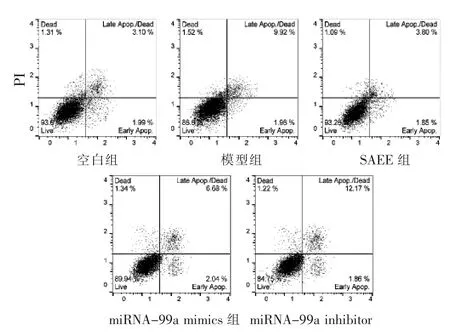
图1 各组VSMC细胞的流式凋亡结果
2.3 各组VSMC细胞中 Survivin、PCNA、Bax、Bcl-2蛋白表达的比较 见表3,图2。模型组中Ki-67、PCNA、Bax蛋白的表达及Bax/Bcl-2的比值显著增加,Bcl-2蛋白的表达显著降低,与空白组比较,差异均有统计学意义 (P<0.01);SAEE 组与 miRNA-99a mimics组中Ki-67、PCNA、Bax蛋白的表达及Bax/Bcl-2的比值显著降低,Bcl-2蛋白的表达显著增加,与空白组比较,差异均有统计学意义 (P<0.01),miRNA-99a inhibitor组中Ki-67、PCNA、Bax蛋白的表达及Bax/Bcl-2的比值显著增加,Bcl-2蛋白的表达显著降低,与模型组比较,差异均有统计学意义(P<0.01)。
表3 各组VSMC细胞中Survivin、PCNA、Bax、Bcl-2蛋白表达的比较(x±s)

表3 各组VSMC细胞中Survivin、PCNA、Bax、Bcl-2蛋白表达的比较(x±s)
组 别 n空白组 6模型组 6 SAEE组 6 Bcl-2 β-actinBax/Bcl-2 1.23±0.24 0.18±0.03 0.55±0.11△△ 1.69±0.43△△1.03±0.19**0.33±0.07**miRNA-99a mimics组 6 0.77±0.11** 0.76±0.25** 0.44±0.05** 0.89±0.11**0.50±0.09**miRNA-99a inhibitor组 6 1.50±0.23** 2.01±0.40** 1.21±0.26** 0.30±0.04**4.05±0.89**Ki-67 β-actin PCNA β-actin Bax β-actin 0.30±0.09 0.37±0.10 0.22±0.03 1.12±0.27△△ 1.41±0.28△△ 0.90±0.15△△0.58±0.14** 0.62±0.15** 0.34±0.04**

图2 各组VSMC细胞中Survivin、PCNA、Bax、Bcl-2蛋白表达的比较
2.4 各组VSMC细胞中MMP-1、TIMP-1蛋白表达的比较 见表4。模型组中MMP-1蛋白的表达及MMP-1/TIMP-1的比值显著增加,TIMP-1蛋白的表达显著降低,与空白组比较,差异均有统计学意义(P<0.01);SAEE组与miRNA-99a mimics组中MMP-1蛋白的表达及MMP-1/TIMP-1的比值显著降低,TIMP-1蛋白的表达显著增加,与空白组比较,差异均有统计学意义 (P<0.01),miRNA-99a inhibitor组中 MMP-1 蛋白的表达及MMP-1/TIMP-1的比值显著增加,TIMP-1蛋白的表达显著降低,与模型组比较,差异均有统计学意义(P<0.01)。
表4 各组VSMC细胞中MMP-2、TIMP-2蛋白表达的比较(x±s)

表4 各组VSMC细胞中MMP-2、TIMP-2蛋白表达的比较(x±s)
组 别 n空白组 6模型组 6 SAEE组 6 MMP-1 β-actin TIMP-1 β-actin MMP-1/TIMP-1 0.39±0.06 1.01±0.18 0.39±0.05 1.24±0.22△△ 0.49±0.14△△ 2.76±1.05△△0.62±0.12** 1.14±0.27** 0.59±0.23**miRNA-99a mimics组 6 0.70±0.23** 0.85±0.09** 0.83±0.28**miRNA-99a inhibitor组 6 1.53±0.22** 0.22±0.03** 7.25±1.27**

图3 各组VSMC细胞中MMP-2、TIMP-2蛋白表达的比较
2.5 各组VSMC细胞中miRNA-99a表达的比较 见表5。与空白组比较,模型组中miRNA-99a的表达显著降低(P<0.01);SAEE能够显著增加VSMC细胞中miRNA-99a的表达,与模型组比较,差异均有统计学意义(P<0.01),与 miRNA-99a mimics作用相同,与miRNA-99a inhibitor作用相反。
表5 各组VSMC细胞中miRNA-99a表达的比较(x±s)
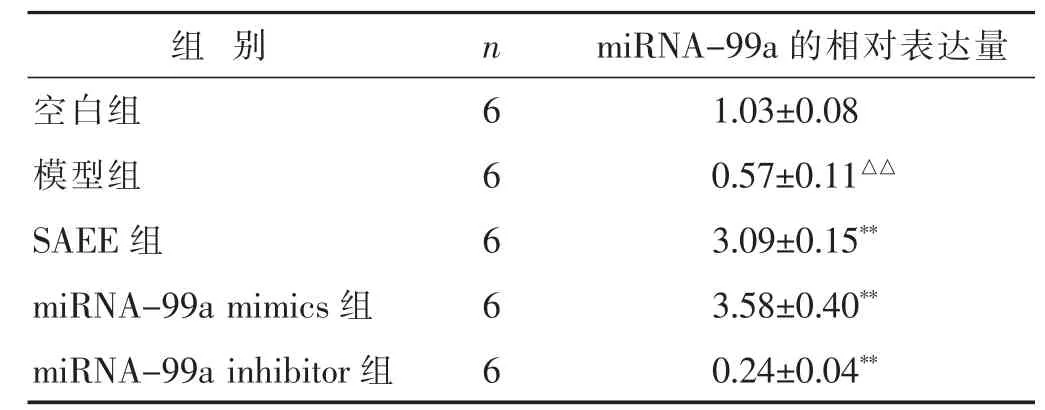
表5 各组VSMC细胞中miRNA-99a表达的比较(x±s)
组 别 n空白组 6模型组 6 SAEE组 6 miRNA-99a的相对表达量1.03±0.08 0.57±0.11△△3.09±0.15**miRNA-99a mimics组 6 3.58±0.40**miRNA-99a inhibitor组 6 0.24±0.04**
3 讨 论
脉粥样硬化形成的初期,低密度脂蛋白汇集于斑块的中央部位,其内的不饱和脂肪酸在自由基和其他致氧因素作用下,经过一系列的氧化和修饰过程,最后形成 ox-LDL[5]。 ox-LDL 能够通过刺激 VSMC、内皮细胞和巨噬细胞释放多种趋化因子和炎性因子,是促进斑块的形成和失稳的关键[6]。本研究采用ox-LDL刺激的方式复制VSMC模型,能够更加可靠地反映动脉粥样硬化形成及失稳过程中的病理变化。
VSMC的增殖能够引起内膜增厚和斑块形成,是管腔狭窄和动脉粥样硬化的病理学基础。Ki-67与细胞的有丝分裂过程密切相关,是目前公认的检测细胞增殖活性的重要标志物[7]。作为DNA复制过程和细胞增殖的关键标志物之一,PCNA是一种分子量为36KD的DNA聚合酶δ的辅助蛋白,主要存在于细胞核内,在调控细胞周期、DNA损伤修复和甲基化的过程中发挥着重要的作用[8]。虽然VSMC的凋亡能在一定程度上抗衡增殖引起的斑块形成,但是近年来大量的研究发现,细胞凋亡亦与动脉粥样硬化的生成和稳定性密切相关[9]。 VSMC 的凋亡能够导致 IL-8、IL-1α 等细胞因子的释放,促进巨噬细胞的浸润和加重斑块内的炎症反应,令斑块失稳;同时,晚期凋亡的VSMC能够增加凝血酶的合成和局部凝血酶的活性,促进血栓形成[10]。Bax和Bcl-2是Bcl-2家族的主要成分,其能够阻止线粒体细胞色素C释放发挥抗凋亡的作用[11]。Bax作为Bcl-2家族的前凋亡蛋白,能够促进线粒体释放细胞色素C和促进内质网中钙离子的释放,拮抗Bcl-2的抗凋亡作用进而促进细胞凋亡[12]。
细胞外基质(ECM)是构成动脉粥样硬化斑块纤维帽的主要成分之一[13]。ECM的合成、降解和成分的稳定,取决于MMP和基质金属蛋白酶组织抑制剂(TIMP)之间的动态平衡。在生理状态下MMP-1处于低浓度水平,而在炎症因子的刺激下MMP-1的分泌持续增加,TIMP-1能够结合MMP-1形成非共价的复合物,限制其降解胶原的作用[14]。在本研究中我们发现,SAEE能显著抑制VSMC细胞增殖和晚期凋亡,降低细胞中Ki-67、PCNA、Bax、MMP-1 蛋白的表达及 Bax/Bcl-2、MMP-1/TIMP-1的比值,增加Bcl-2和TIMP-1蛋白的表达,说明SAEE具有促进斑块的稳定和防止斑块的脱落或破裂的作用,其作用机制是通过调控VSMC细胞增殖、凋亡和细胞外基质的合成、降解实现的。
近年来大量的的研究表明,MicroRNA在动脉硬化的发生与发展过程中,发挥着重要的作用[15]。其中miRNA-99a能够通过抑制IGF-1R and mTOR信号通路的活化,从而抑制VSMC的增殖,延缓动脉硬化的发生与发展[16]。本研究结果显示,SAEE能够显著增加VSMC细胞中miRNA-99a的表达,与miRNA-99a mimics组结果相同,与miRNA-99a inhibitor结果相反,因此我们推断SAEE调控VSMC细胞增殖、凋亡和ECM的合成、降解的作用,可能是通过上调细胞中miRNA-99a的表达实现的。
综上所述,SAEE能够抑制VSMC细胞增殖、凋亡和细胞外基质的降解,促进斑块的稳定和防止纤维帽的破裂,其作用机制是通过上调细胞中miRNA-99a的表达实现的。
