15N同位素示踪技术研究辣椒器官氮素分配特性和基质氮素运移规律
2019-04-29曹超群张国斌胡琳莉强浩然马国礼杜淼鑫李雨桐
曹超群,张国斌,胡琳莉,强浩然,马国礼,杜淼鑫,李雨桐
(1.甘肃农业大学 园艺学院,甘肃 兰州 730070; 2.兰州新区农业科技开发有限责任公司,甘肃 兰州 730070;3.哈密市伊州区种业研究开发中心,新疆 哈密 839000)
辣椒(CapsicumannuumL.)为茄科辣椒属,属于我国设施蔬菜主栽作物之一[1]。氮肥的施用是限制植物生长的重要因素,不合理施用氮会降低肥料利用率,并使残留氮素向下迁移,引发地下水污染,造成环境污染[2-3]。15N示踪技术是研究土壤-作物体系中氮素迁移、分配的重要方法,通过研究不同水氮处理下蔬菜对氮素吸收、利用及氮素去向可为田间管理提供理论依据,并揭示氮素的来源与去向途径[4-6]。
水分不足或过量均可抑制蔬菜正常生长,降低氮肥利用率[7]。向友珍[8]研究了滴灌施肥对甜椒水氮耦合效应的影响,结果表明,适当协调灌水与氮肥施用量会对甜椒正常的生长发育起促进作用,且可提高水分利用率。所以,合理地协调水、氮供应在农业生产中显得尤其重要。吕剑[9]在研究日光温室基质栽培番茄中发现60%~70%下限的灌水更有利于植株生物量的积累,而80%的灌水条件下会增加辣椒植株徒长速率。由于水分作为氮素运移的载体,氮素的淋失量与灌水量有密切关系,所以合理控制灌水量能够有效降低番茄在盛果期的氮素流失量[10]。于红梅等[11]在研究不同水氮管理对蔬菜地硝态氮淋洗中表明,控制灌水可以减少水分漏渗量,当土壤含水量在50%~80%,NO3--N的淋洗量较弱。邢英英等[12]、孙杨[13]、史书强等[14]研究表明,土壤含水量较高会引起土壤盐渍化,栽培基质中含水量与水分运移规律对基质中盐分的分布规律有密切关系:蒸腾及基质表层蒸发等共同作用可引起土壤盐分向上迁移。柴付军等[15]研究表明,对于含盐较低的土壤中,高频滴灌和低频滴灌对棉花产量没有显著差异。前人关于水氮互作的研究,大多是以露地栽培蔬菜为研究对象,而露地种植有许多不可控的环境因素。目前,利用同位素示踪技术研究不同灌水条件对日光温室氮素迁移和分配特性的影响鲜见报道。本试验在日光温室条件下,以基质栽培辣椒为研究对象,采用15N同位素示踪技术研究2种不同灌水下限条件下,基质中氮素运移积累规律、氮素的吸收利用及其在辣椒各器官中的分配特性,为日光温室辣椒基质栽培水肥精准管理提供理论依据。
1 材料和方法
1.1 试验材料
试验材料是由甘肃省农科院蔬菜研究所选育的 陇椒10号(甘肃省设施辣椒主栽品种)。供试肥料有硝酸钾(K2O 46.3%)、过磷酸钙(P2O512%)、尿素(N 46%)以及由上海化工研究院提供的丰度为50.30%的K15NO3。栽培基质中草炭、蛭石、育苗基质(体积比)=1∶1∶2。栽培基质理化性状见表1。

表1 基质理化性状Tab.1 Substrate physicochemical properties
1.2 试验方案
1.2.1 试验设计 2017年3-9月,本试验于甘肃农业大学日光温室进行,在处理后第90 天拉秧并开始测定指标。试验设2因子2水平:灌水量分别为田间持水量的60%,80%;从栽培基质表面向下5~10 cm或15~20 cm深处标记15N。灌溉方式采用膜下滴灌,由水表控制灌水量。试验设4个处理,处理组合见表2。
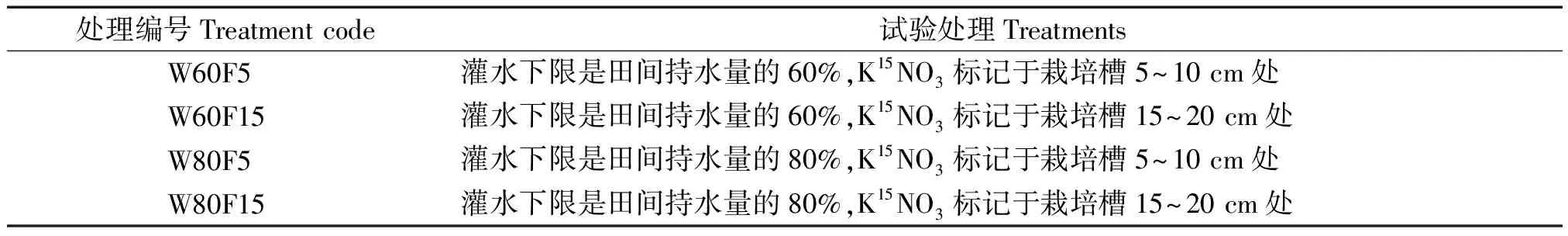
表2 试验处理方案Tab.2 Experimental treatment
1.2.215N标记方式与栽培槽设置 试验采用槽式栽培,栽培槽大小为4 m×0.48 m×0.30 m(长×宽×高),在槽底铺衬1层有出水孔的塑料薄膜(图1)。每槽基质用量为0.5 m3,装填高度为25 cm,标记时将15.2 g外源 K15NO3(15N 1 060 mg,标记氮占总施氮量的1.7%)与相应层次基质混合均匀后填入栽培槽(图1)。采用膜下滴灌灌溉,每3槽(3个重复)为一个小区,每小区面积为3×3.84 m×0.48 m=5.53 m2,选择生长健壮且大小一致的辣椒苗双行定植,每小区共定植辣椒42株。
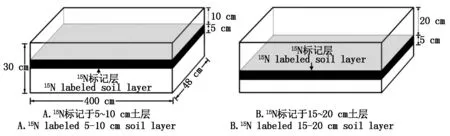
图1 15N标记与栽培槽示意图Fig.1 15N marking and cultivation trough schematic
1.2.3 施肥与田间管理 目标产量为7.5 kg/m2,按当地农肥施用量每生产1 000 kg辣椒需吸收纯N 4.8 kg,P2O50.9 kg,K2O54 kg(即N∶P2O5∶K2O=1∶0.2∶1.2)[16]。磷肥作基肥一次性施入,钾肥与氮肥作基肥施入一次,然后分别在辣椒1、2、4穗果膨大期随水施入。试验通过烘干法来监测基质水分动态含量变化[9,17]。当基质水分含量降至灌水下限时,可通过公式M=r×p×s×h×θf×(q1-q2)/η,将其补充至灌溉上限。各小区灌水量具体见表3。
式中:M. 灌水量,m3;r.基质容重,0.23 g/cm3;p.基质湿润比,取85%;s.灌水面积,5.53 m2;h.灌水计划层,0.25 m;θf.田间持水量,105%;q1.灌水相对田间持水量上限,100%;q2.灌水相对田间持水量下限,80%,60%;η.水分利用系数,100%。

表3 处理组灌水量Tab.3 Irrigation volume of treatment group
1.3 样品测定
1.3.1 植株样品采集 于2017年9月7日(处理90 d)采集样品,各处理分别采集9株,将其分为根、茎、叶、果实,把植株洗净并做好标记。将植株各器官于105 ℃作杀青处理30 min,80 ℃烘干至恒质量,然后称其地上部干质量。再取辣椒各器官干样品进行粉碎、研磨,用于植株各器官的全氮和15N丰度的测定。
1.3.2 基质样品采集 植株和基质样品同时采集。基质分4层(每5 cm为一层)取样,相同层面随机选取4个采集点,将各个重复的4个层面的基质样品分别装入自封袋,最后将样品带回实验室自然风干后过80 mm筛备用。通过MAT253质谱仪 (杨凌启翔生物科技有限公司测定) 测定基质和植株样品的15N丰度;采用 K1100全自动凯氏定氮仪测定全氮含量。
1.4 计算公式[9,18]
基质15N残留量=基质全氮15N原子百分超×基质各层全氮含量;15N的吸收量=植株吸氮量×植株15N丰度;15N的利用率=15N的吸收量/标记氮带入15N的量×100%。
1.5 数据处理
应用SPSS 19.0、Origin 8.5和Excel 2010等软件进行数据分析与统计。
2 结果与分析
2.1 不同处理下辣椒植株生物量及吸氮量
如表4所示,相同灌水条件下,植株总生物量随着15N标记深度的加深呈下降趋势。60%的灌水下限植株总生物量比80%的灌水下限显著增高了72.3%(5~10 cm),82.4%(10~15 cm),平均高77.4%。
由表5可得,W80F15处理植株总氮含量比W60F15处理降低了36.0%,W80F5处理植株的总氮含量较W60F5处理下降了41.3%。处理W80F5中辣椒果实含氮量随着标记深度的加深,较W80F15处理显著增加了83.3%;在W60F5处理下,辣椒茎、叶、果实中的氮素含量较处理W60F15分别增加了22.2%,22.0%,35.7%。由此表明,同一灌水条件下基质层5~10 cm处的氮素可促进辣椒植株的吸收与利用。辣椒茎、叶、果中氮素含量最高的处理均是W60F5。不同处理下辣椒植株各器官的含氮量为茎<果<叶。
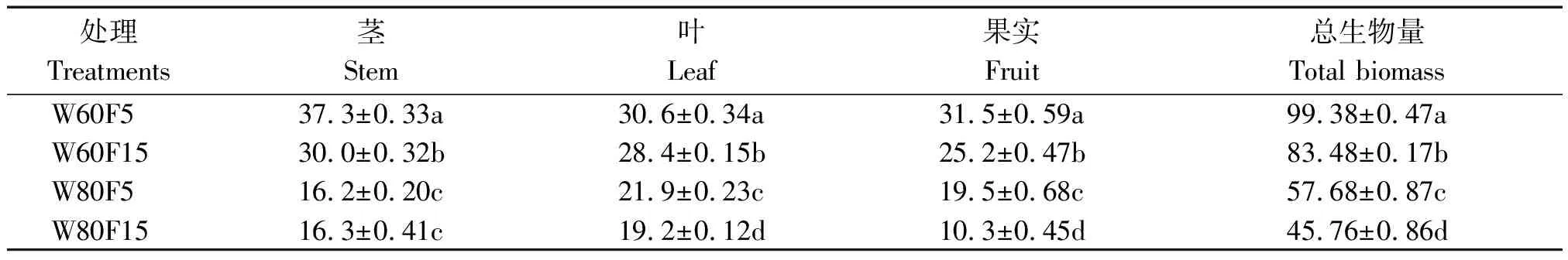
表4 辣椒不同处理地上部分的生物量Tab.4 Above group biomass of pepper affected by different treatments g/株
注:同列中不同字母表示差异达0.05显著水平。表5-7同。
Note: Different letters in the same column indicate significant difference at 0.05 level. The same as Tab.5-7.
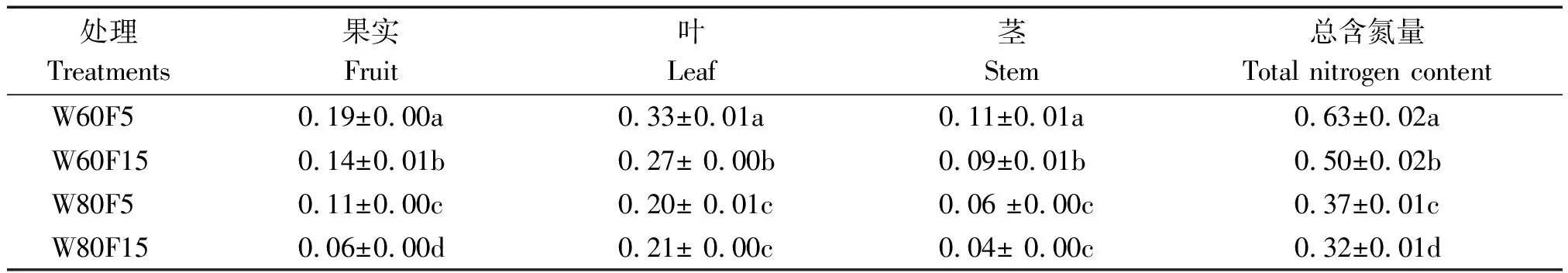
表5 不同处理辣椒地上部含氮量Tab.5 Different treatment of nitrogen content in the upper part of pepper g/株
2.2 辣椒植株对不同标记深度的15N的吸收和利用
如表6所示,同一灌水下限条件下,茎、果及植株总15N吸收量和利用率随着15N标记深度从5~10 cm下降到15~20 cm,均显著下降,而叶片中15N的吸收量和利用率与之相反。在W60F15处理下,辣椒各器官对15N总利用率较W80F15处理显著增加了2.66百分点;W60F5处理下,辣椒植株15N总利用率较W80F5处理显著增加了2.52百分点,植株总15N的吸收量与利用率在W80F5处理下较W80F15显著增加了49.3%和0.86百分点;W60F5植株所吸收的15N总量较W60F15处理显著增加了17.7%。W60F5处理下,辣椒15N利用率最高,为5.44%。基质中15N随着较高灌水(80%灌水下限)下渗,加大其淋失量,从而减小植株吸收利用率。
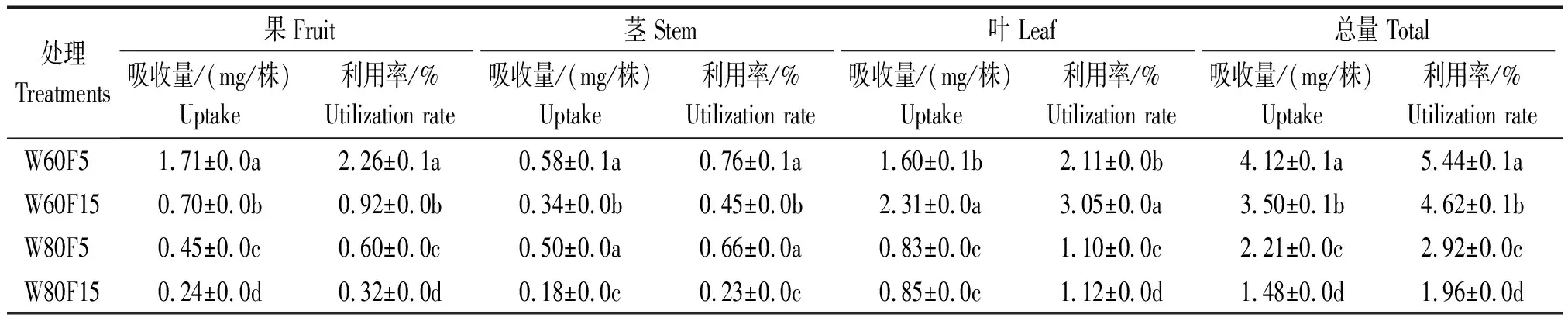
表6 辣椒对不同基质深度标记15N的吸收量和利用率Tab.6 Uptake and utilization rate of 15N by pepper from different substrate layers
2.3 基质中15N含量的累积与损失
由表7得知,15N的回收量是植株中15N的量加0~20 cm基质层中存留15N的量;15N损失量等于标记K15NO3带入15N的量减去15N的回收量。在灌水下限为60%(W60)的条件下,基质中15N的累积量随着15N标记深度的加深,显著降低了19.0%;灌水下限为80%(W80)的处理下,基质中15N的积累量变化随着15N标记层的加深没有显著差异。分析15N总回收量得知,W60F5处理下15N回收量较W80F5处理显著增加了23.8%;W60F15处理15N总回收量较W80F15显著增高了11.5%。就15N的损失率得知,W80F5处理15N损失率为29.42%,较W80F15减少了7.12百分点;W60F5较W60F15处理15N的损失率显著减少了16.38百分点;15N标记层于5~10 cm处,W60F5处理15N损失率较W80F5显著减少了16.79百分点;当15N标记层于15~20 cm处,W60F15处理15N损失率较W80F15显著减少7.53百分点。

表7 辣椒0~20 cm基质层中15N的回收与损失情况Tab.7 Recovery and loss of 15N in the 0-20 cm substrate layer
注:15.2 g K15NO3中含有15N 1 060 mg。
Note:15.2 g K15NO3contains15N 1 060 mg.
2.4 不同基质层15N的迁移与分布

同一折线中不同字母代表差异达5%显著水平。Different letters in the same line indicate significant difference at 5% level.
3 结论与讨论
高水氮处理促进了植株的营养生长,抑制植株生殖生长[18]。合理的灌溉与施氮可以改变植物根系的生长与分布,促使根系对水氮的吸收从而提高地上部生物量的积累[19]。龚江等[4]通过研究膜下滴灌水氮耦合对棉花生长的影响,结果表明,膜下滴灌对棉花干物质的积累影响较大,而施氮量对干物质的影响较小,在棉花整个生育期施氮对棉花的影响作用小于灌水作用。张振贤等[20]认为,在大白菜的莲座期,灌水下限为40%~80%,叶面积及干质量都随灌水下限的提高呈递增趋势,大于 80%则稍有下降。本试验结果表明,随着灌水下限的下降,植株总生物量呈增大趋势,与吕剑等[9,21]的研究结果相一致。辣椒植株的含氮量与植株总生物量的变化趋势基本一致。张永丽等[22]研究结果表明,适当提高灌水量,有利于植株对氮素的吸收与利用,但过高的灌水会导致氮素利用率下降。正如本试验结果,60%的灌水下限更有利于植株对氮素的吸收。不同灌水处理对小麦各器官氮素的运移分配影响不尽相同。本试验利用15N标记法研究植株各器氮素吸收情况,结果表明,不同灌水下限与15N标记层次对植株各器官15N的吸收量依次表现为叶>果>茎。董雯怡等[23]通过研究毛白杨对15N 标记铵态氮和硝态氮的吸收能力,结果表明,氮素在毛白杨器官中的分配量差异显著,含量多少依次为茎<根<叶,且叶片的数量和生物量积累最多,说明叶的光合作用强从而导致其对15N吸收最高。与本试验研究结果有差异,原因可能与基质灌水下限及测定的时间有关,不同灌水下限会影响根毛的数量与质量,结果盛期辣椒需要较多氮素供其生殖生长,所以果实的氮含量高于茎、根。气候和田间管理等因素会影响氮素的分布与损失情况,左红娟[24]通过对肥料氮利用与去向研究表明,土壤中氮肥损失率为11.3%~48.3%,正如本研究所示,在灌水下限为60%的条件下,在标记层5~10 cm处,15N损失率为12.63%,当标记层为15~20 cm时,15N损失率为29.01%;在80%灌水下限下,W80F5与W80F15处理15N的损失率分别为29.42%,36.54%。本研究与王春辉等[2]研究结果一致。董雯怡等[23]采用15N示踪法研究毛白杨苗木对氮素的吸收及分配,结果发现,0~40 cm土层中土壤残留氮占残留氮总量的60.3%~76.5%。左红娟[24]研究发现,随土层深度的加深,标记氮在土壤中的残留率显著下降。试验研究结果显示,60%的灌水下限减弱了水分向深层的运移量,从而增大15~20cm处15N的损失率。
各处理辣椒植株各器官的全氮含量大小依次为叶>果>茎。辣椒植株对15N利用率表现为W60F5>W60F15>W80F5>W80F15。灌水下限60%或80%时,随着15N标记层的下降,15N在基质层中的残留量逐渐下降,损失率显著增高。W60F5更有利于植株对氮素吸收与利用。
