甲亢源性心房颤动与心房交感神经重构相关的发病机制研究
2019-04-28郑甲林代华磊张新金李建美
郑甲林 代华磊 张新金 李建美


[摘要] 目的 研究甲亢源性房顫与心房交感神经重构相关的发病机制。 方法 选取50只成年健康日本大耳兔,按照随机数字表法分为给药2月组(n = 20)、给药4月组(n = 20)、对照组(n = 10)。给药2月组每日腹腔内注射甲状腺素50 μg/kg,持续2个月;给药4月组每日腹腔内注射甲状腺素50 μg/kg,持续4个月;对照组每日腹腔内注射等剂量生理盐水,持续4个月。制备甲亢房颤易患动物模型,比较三组基础资料、左心房有效不应期(LAERP)、房颤诱发率,以及交感神经激活和重构相关指标的表达情况。 结果 ①实验后,给药2月组和给药4月组体重低于对照组,且给药4月组体重低于给药2月组(P < 0.05);给药2月组和给药4月组心率快于对照组(P < 0.05)。②给药2月组、给药4月组的LAERP均短于对照组,且给药4月组短于给药2月组(P < 0.05)。③给药4月组的房颤诱发率高于给药2月组和对照组(P < 0.05)。④给药2月组和给药4月组去甲肾上腺素水平高于对照组(P < 0.05)。⑤给药2月组、给药4月组酪氨酸羟化酶(TH)和生长相关蛋白-43(GAP-43)的mRNA相对表达量高于对照组(P < 0.05),且给药4月组GAP-43 mRNA相对表达量高于给药2月组(P < 0.05)。⑥给药2月组、给药4月组TH和GAP-43蛋白相对表达量高于对照组(P < 0.05),且给药4月组GAP-43蛋白相对表达量高于给药2月组(P < 0.05)。 结论 持续高水平甲状腺素暴露下心房交感神经被过度激活、重构,其可能是甲亢源性心房颤动的发病机制之一。
[关键词] 心房颤动;甲亢;交感神经;重构
[中图分类号] R541.7 [文献标识码] A [文章编号] 1673-7210(2019)02(b)-0009-06
[Abstract] Objective To study the pathogenesis of hyperthyroidism-induced atrial fibrillation and atrial sympathetic nerve remodeling. Methods According to random number table method, 50 adult healthy Japanese big ear rabbits were divided into two month administration group (n = 20), four month administration group (n = 20) and control group (n = 10). The two month administration group received intraperitoneal injection of thyroxine 50 μg/kg daily for 2 months, the four month administration group received intraperitoneal injection of thyroxine 50 μg/kg daily for 4 months, and the control group received intraperitoneal injection of equal dose of normal saline for 4 months. Animal models of hyperthyroidism and atrial fibrillation vulnerability were prepared. The basic data, left atrial effective refractory period (LAERP), induced rate of atrial fibrillation, and expression of related indicators of sympathetic nerve activation and remodeling were compared among the three groups. Results ①After the experiment, the body weight of two month administration group and four month administration group were lower than those of control group, and the body weight of four month administration group was lower than that of two month administration group (P < 0.05); the heart rate of two month administration group and four month administration group were faster than those of control group (P < 0.05). ②The LAERP in the two month administration group and four month administration group were shorter than those in the control group, and that in the four month administration group was shorter than that in the two month administration group (P < 0.05). ③The induced rate of atrial fibrillation in the four month administration group was higher than that in the two month administration group and the control group (P < 0.05). ④The level of norepinephrine in the two month administration group and the four month administration group were higher than those in the control group (P < 0.05). ⑤The relative expression of tyrosine hydroxylase (TH) and growth associated proteins-43 (GAP-43) mRNA in the two month administration group and four month administration group were higher than those in the control group (P < 0.05), and the relative expression of GAP-43 mRNA in the four month administration group was higher than that in the two month administration group (P < 0.05). ⑥The relative expression of TH and GAP-43 protein in the two month administration group and four month administration group were higher than those in the control group (P < 0.05), and the relative expression of GAP-43 protein in the four month administration group was higher than that in the two month administration group (P < 0.05). Conclusion Atrial sympathetic nerve is overactivated and remodeled under continuous high level of thyroxine exposure, which may be one of the pathogenesis of hyperthyroidism-induced atrial fibrillation.
[Key words] Atrial fibrillation; Hyperthyroidism; Sympathetic nerve; Remodeling
甲状腺功能亢进(甲亢)与心血管疾病,尤其是心房颤动(房颤)有显著的关联性[1-2]。甲状腺激素受体位于细胞核,一般认为甲状腺激素通过与其受体结合实现对靶基因的直接调节[3-4]。而有研究发现,甲状腺激素还可激活其他系统如交感神经系统,间接作用于靶器官[5]。甲亢引起心脏损害部分依赖于交感神经兴奋,而交感神经与心律失常,尤其是与房颤密切相关[6-7]。因此,甲亢激活交感神经可能是房颤发生的原因之一。国内外对交感神经参与甲亢源性房颤的相关研究甚少,具体机制尚未阐明。本研究通过建立兔甲亢房颤易患模型,检测去甲肾上腺素、左心房交感神经重构标志物酪氨酸羟化酶(TH)、生长相关蛋白(GAP-43)的基因及蛋白表达水平,从而明确甲亢源性心房颤动与左心房交感神经相关的发病机制,为临床治疗甲亢源性房颤患者提供部分新的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 动物 50只成年健康日本大耳兔[使用许可证号:SYXK(滇)K2013-0011],由昆明医科大学动物实验中心提供[生产许可证号:SCXK(滇)2011-0004],体重为2.4~3.6 kg。
1.1.2 试剂与设备 左旋甲状腺素钠五水合物(美国MCE公司,1 g/瓶,生产批号:HY-18341A);注射用异戊巴比妥钠(上海上药新亚药业有限公司,规格:0.25 g,生产批号:20150814);荧光定量PCR试剂盒(美国KAPA Biosystem公司);cDNA逆转录试剂盒(瑞士Roche公司);PCR引物(北京擎科生物技术有限公司);BCA法蛋白浓度测定试剂盒(武汉博士德生物有限公司);PVDF膜(美国millipore公司);小鼠抗兔TH蛋白多克隆抗体(美国Santa Cruz公司);小鼠抗兔GAP-43蛋白多克隆抗体(美国Santa Cruz公司);羊抗小鼠IgG辣根过氧化物酶标记二抗(美国Santa Cruz公司);兔去甲肾上腺素ELISA试剂盒(森贝伽生物公司)。多道电生理记录仪(Labsystem PRO,巴德电生理医疗公司);电生理刺激仪(EP-4-04,St. Jude Medical);十极标测电极(1 mm/节,两电极间距1 mm,相邻电极对间距为2 mm,心诺普医疗技术有限公司)。
1.2 实验方法
1.2.1 兔甲亢房颤易患模型的制备 按照随机数字表法将50只成年健康日本大耳兔分为给药2月组(n = 20)、给药4月组(n = 20)和对照组(n = 10)。给药2月组每日腹腔内注射甲状腺素50 μg/kg,持续注射2个月;给药4月组每日腹腔内注射甲状腺素50 μg/kg,持续注射4个月;对照组每日腹腔内注射等剂量生理盐水,持续注射4个月。分别标记编号,记录实验前后的心率、体重。
1.2.2 左心房电生理指标检测 检测于各组实验结束后分别进行。用绳索将日本大耳兔外固定,耳缘静脉注射3%戊巴比妥钠实施麻醉,剂量为30 mg/kg。在咽喉镜辅助下经食道插入电极。刺激脉宽设定为1.0 ms,测定刺激阈值,以2~3倍阈值作为刺激强度。①左心房有效不应期(LAERP)[8]:为确保夺获心房,测定刺激阈值时的刺激脉宽为2.0 ms,刺激频率快于基础心率10~20次。采用电生理刺激仪进行程序刺激,S1S1基础刺激周长为200 ms、150 ms,以8∶1为S1S2的刺激比例,自不应期内递增扫描,步长5 ms,将最长无法夺获心房的S1S2间期作为LAERP,测量3次取平均值,单位:毫秒(ms)。②房颤诱发率:以电极远端作猝发刺激,S1S1刺激周长100 ms,脉宽2.0 ms,刺激电压是刺激阈值的2倍,30 s/次,刺激5次,查看诱发情况;基础刺激周长200 ms,S1S2以5 ms步长,200/200 ms开始递减刺激。若S1S1、S1S2刺激诱发出房颤持续10 min以上,则为诱发成功。
1.2.3 動物模型采血和左心房肌组织材料的收集 各组兔左心房电生理检测结束后经耳缘静脉采血2 mL,经EDTA抗凝于4℃、3000 r/min(离心半径10 cm)离心10 min,分离血浆分装于1.5 mL EP管中,于-70℃保存。以空气栓塞方式处死兔,开胸取其心脏,于无菌台切取左心房(包括房间隔),用磷酸盐缓冲液冲洗去血,将左心房肌组织分为两份,取一份置于15 mL无菌离心管,液氮保存;另一份以4%多聚甲醛固定。
1.3 相关分子生物学指标检测
①ELISA检测各组兔血浆去甲肾上腺素水平;②实时荧光定量PCR检测各组兔左心房肌组织TH(前向引物5′-GTGGAGTACACGGCCGAGGAG-3′,逆向引物5′-GGATGTGGTCCTCGCTGTAG-3′)、GAP-43(前向引物5′-AAAATTCAGGCGAGCTTCCG-3′,逆向引物5′-TTCTTCTCCACCCCATCAGC-3′)mRNA表达水平,甘油醛-3-磷酸脱氢酶(GADPH)为内参(前向引物5′-CCACTTTGTGAAGCTCATTTCCT-3′,逆向引物5′-TCGTCCTCCTCTGGT GCTCT-3′)。实验步骤:总RNA提取及鉴定,合成第一链cDNA,实时荧光定量PCR检测;反应体系:RNase-free双蒸水、qPCR Master Mix、模板、引物等;反应条件:95℃预变性5 min;95℃变性30 s;60℃退火30 s;72℃延伸1 min,30个循环后72℃延伸10 min。③采用免疫组织化学检测各组兔左心房肌组织是否有神经重构发生,免疫印迹法检测组织中TH和GAP-43蛋白水平,以目的蛋白条带的光密度和内参β-actin的光密度的比值作为相对表达量。
1.4 统计学方法
采用SPSS l7.0软件进行统计学数据分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用用LSD-t检验;计数资料采用百分率表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 三组基础资料比较
给药2月组死亡2例,给药4月组死亡3例。最终纳入统计分析共45例。实验前三组的体重、心率比较,差异无统计学意义(P > 0.05);实验后,给药2月组和给药4月组体重低于对照组,且给药4月组体重低于给药2月组(P < 0.05);给药2月组和给药4月组心率快于对照组(P < 0.05)。见表1。
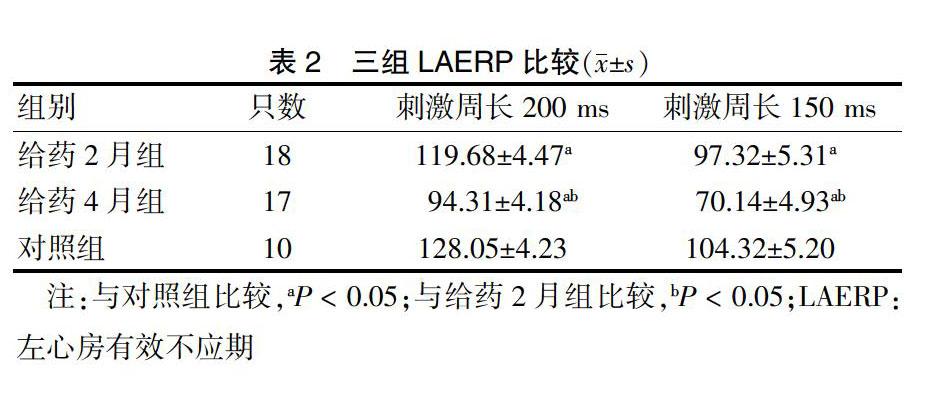
2.2 三组LAERP比较
刺激周长为200 ms和150 ms时,给药2月组、给药4月组LAERP均短于对照组,且给药4月组均短于给药2月组(P < 0.05)。见表2。
2.3 三组房颤诱发率比较
对照组未诱发房颤,给药4月组房颤诱发率为41.2%(7/17),高于给药2月组的16.7%(3/18),三组比较差异有统计学意义(P < 0.05)。给药4月组房颤诱发率高于给药2月组和对照组(P < 0.05)。
2.4 三组血浆去甲肾上腺素水平比较
三组去甲肾上腺素水平比较,差异有统计学意义(P < 0.05),给药2月组和给药4月组去甲肾上腺素水平高于对照组(P < 0.05);给药4月组和给药2月组之间比较,差异无统计学意义(P > 0.05)。见图1。
2.5 三组左心房肌组织TH、GAP-43 mRNA表达水平比较
三组左心房肌组织TH mRNA相对表达量比较,差异有统计学意义(P < 0.05),给药2月组、给药4月组表达量高于对照组(P < 0.05);给药4月组和给药2月组比较,差异无统计学意义(P > 0.05),见图2。三组左心房肌组织GAP-43 mRNA相对表达量比较,差异有统计学意义(P < 0.05),給药2月组、给药4月组表达量高于对照组(P < 0.05),且给药4月组表达量高于给药2月组(P < 0.05),见图3。
2.6 三组左心房肌组织TH、GAP-43蛋白表达量比较
免疫组织化学检测发现给药2月组、给药4月组左心房肌均发生了交感神经重构,TH蛋白、GAP-43蛋白均有阳性表达。神经组织被染为棕褐色,如红色箭头所示,见图4~5(封三)。进一步比较左心房肌组织TH、GAP-43蛋白表达,见图6。三组左心房肌组织TH蛋白相对表达量比较,差异有统计学意义(P < 0.05),给药2月组、给药4月组表达量高于对照组(P < 0.05),给药4月组和给药2月组之间比较,差异无统计学意义(P > 0.05)。三组左心房肌组织GAP-43蛋白相对表达量比较,差异有统计学意义(P < 0.05),给药2月组、给药4月组表达量高于对照组,且给药4月组表达量高于给药2月组(P < 0.05)。见图7。
3 讨论
有关报道显示,甲亢患者中有9%~22%的患者发生房颤,而房颤患者中约有13%的患者甲状腺激素相关生化指标发生异常,两者之间存在明显相关性[9-10]。亚临床甲亢和甲亢患者有同等的房颤发病率,亚临床甲亢也是房颤的一大危险因素[11-12]。甲亢患者常伴有交感神经兴奋,甲亢引起心脏损害部分依赖交感神经兴奋。一方面,长期高甲状腺素水平会可能引起心脏交感神经重构。Liu等[13]新近研究发现,甲亢大鼠心房交感神经发生重构。猪甲亢模型研究结果显示,心脏交感神经被激活,心肌细胞膜上β肾上腺素受体数量高于正常对照组[14]。心房分布的β肾上腺素能受体较心室高,并且高甲状腺素可上调心肌细胞β受体,心房可增加对儿茶酚胺的敏感性,致使自主神经结构和功能紊乱。另有研究发现,高位胸髓硬膜外麻醉可抑制心房电重构、解剖重构,减少房颤的发生和维持,提示交感神经参与了房颤的发生[15-16]。对兔自主神经刺激,可缩短心房和肺静脉的有效不应期,改变心房的传导性,促使房颤容易诱发及发作后持续时间延长[17]。另一方面,神经递质去甲肾上腺素主要来自交感神经节后纤维,甲亢兴奋交感神经,去甲肾上腺素经交感神经节后纤维释放后,与肾上腺能受体结合,使心肌细胞多种离子通道特性改变,继而缩短有效不应期和降低频率适应性[18];甲状腺激素还能刺激肾上腺髓质分泌儿茶酚胺,而且甲亢患者心血管对儿茶酚胺的敏感性增加。Jayachandran等[19]发现正常犬的心耳组织去甲肾上腺素的含量较房颤犬低。另有研究表明,心房神经节丛内的交感神经元兴奋后,释放更多的去甲肾上腺素,引起神经节丛附近的肺静脉及心房肌细胞钙负荷增加,诱发这些心房肌细胞的早期后除极,使触发活动增加,从而形成肺静脉及心房内的快速放电区,驱动房颤发生。反之,在检测房颤患者的左心耳组织后发现,交感神经支配和局部去甲肾上腺素的表达量均明显增加[20],房颤患者交感神经被激活,进一步促进房颤发生[21],因此房颤与交感神经互为因果促进。长期儿茶酚胺的作用最终引起心脏电重构、解剖重构,为一系列甲亢源性心脏疾病,尤其是房颤发生奠定基础。
本研究发现,给药2月组、给药4月组较对照组体重下降,心率增快,LAERP缩短,房颤诱发率增高;给药2月组、给药4月组较对照组血浆去甲肾上腺素水平升高。研究结果提示在持续高甲状腺素水平作用下,兔心脏交感神经被激活,部分动物模型具有甲亢源性房颤易患倾向。TH是交感神经递质儿茶酚胺合成的限速酶,GAP-43是神经细胞发育、再生的一个相关因子;TH、GAP-43被认为是心脏自主神经的重要标志,二者表达水平可作为评价心脏自主神经分布、再生的依据。进一步研究发现,给药2月组、给药4月组较对照组左心房肌组织TH mRNA表达水平增高;给药2月组、给药4月组较对照组左心房肌组织GAP-43 mRNA表达水平增高,给药4月组较给药2月组mRNA表达水平进一步增高;免疫组织化学检测发现给药2月组、给予4月组左心房肌均发生了交感神经重构,TH蛋白、GAP-43蛋白均有阳性表达;给药2月组、给药4月组较对照组左心房肌组织TH蛋白相对表达量增高;给药2月组、给药4月组较对照组左心房肌组织GAP-43蛋白相对表达量增高,给药4月组较给药2月组蛋白相对表达量进一步增高。研究结果提示高甲状腺素导致心房颤动发病过程中伴有心脏交感神经的激活、重构。
综上所述,本研究已证实高甲状腺素导致心房颤动过程中伴有心脏交感神经激活、重构,而甲亢导致房颤是一个未完全明确、复杂、多重机制的病理过程,其发病机制之一可能是心脏交感神被过度激活并发生重构,而进一步产生间接作用。因类似研究较少,尚缺乏全面、有力的依据,本研究结论仍需扩充样本量,通过重复实验进一步加以证实。
[参考文献]
[1] 李现彪.甲状腺机能亢进症对心血管系统功能的影响及分析[D].长春:吉林大学,2016.
[2] 陈海兰,高宇.甲状腺功能亢进症合并心血管疾病研究进展[J].中国老年学,2016,36(16):4122-4124.
[3] Li J,Tan H,Huang J,et al. Case report of recurrent atrial fibrillation induced by thyrotropin-secreting pituitary adenoma with Graves′ disease [J]. Medicine(Baltimore),2018,97(24):e11047.
[4] 黎国兴,李骊华.甲状腺功能亢进与心房颤动相关性的研究进展[J].西部医学,2017,29(7):1023-1027.
[5] 王芳.分析探讨甲状腺疾病的临床诊断与治疗[J].中国实用医药,2016,11(4):177-178.
[6] Shen MJ,Zipes DP. Role of the autonomic nervous system in modulating cardiac arrhythmias [J]. Circ Res,2014,114(6):1004-1021.
[7] Chen PS,Chen LS,Fishbein MC,et al. Role of the autonomic nervous system in atrial fibrillation:pathophysiology and therapy [J]. Circ Res,2014,114(9):1500-1515.
[8] 郑甲林,郭涛,张新金.高甲状腺素心房颤动易患模型制作及左心房电生理变化的影响研究[J].中国生化药物杂志,2015,35(4):48-50,54.
[9] 宋文荣.疏肝潜阳汤配合普萘洛尔治疗甲状腺功能亢进合并房颤疗效观察[J].现代中西医结合杂志,2018,27(9):969-972.
[10] 孟军,孙莉萍,陈涛.甲状腺激素与慢性心力衰竭衰患者心房颤动发生的相关分析[J].岭南心血管病杂志,2017, 23(1):67-70.
[11] Reddy V,Taha W,Kundumadam S,et al. Atrial fibrillation and hyperthyroidism:A literature review [J]. Indian Heart J,2017,69(4):545-550.
[12] Rosario PW,Carvalho M,Calsolari MR. Symptoms of thyrotoxicosis,bone metabolism and occult atrial fibrillation in older women with mild endogenous subclinical hyperthyroidism [J]. Clin Endocrinol(Oxf),2016,85(1):132-136.
[13] Liu L,Yun F,Zhao H,et al. Atrial sympathetic remodeling in experimental hyperthyroidism and hypothyroidism rats [J]. Int J Cardiol,2015,187(1):148-150.
[14] Hammond HK,White FC,Buxton IL,et al. Increased myocardial beta-receptors and adrenergic responses in hyperthyroid pigs [J]. Am J Physiol,1987,252(2):H283-H290.
[15] Nammas W,Airaksinen JK,Paana T,et al. Renal sympathetic denervation for treatment of patients with atrial fibrillation:Reappraisal of the available evidence [J]. Heart Rhythm,2016,13(12):2388-2394.
[16] Kiuchi MG,Chen S,E Silva GR,et al. Pulmonary vein isolation alone and combined with renal sympathetic denervation in chronic kidney disease patients with refractory atrial fibrillation [J]. Kidney Res Clin Pract,2016,35(4):237-244.
[17] Oliveira M,Postolache G,Geraldes V,et al. Acute electrophysiological modulation of the atria and pulmonary veins:effects of sympathetic and parasympathetic interaction on atrial fibrillation inducibility [J]. Rev Port Cardiol,2012,31(3):215-223.
[18] 陈思,周忠.CT引导下胸交感神经阻滞治疗甲亢所致心力衰竭的价值探讨[J].中国现代医生,2017,55(7):12-15.
[19] Jayachandran JV,Sih HJ,Winkle W,et al. Atrial fibrillation produced by prolonged rapid atrial pacing is associated with heterogeneous changes in atrial sympathetic innervation [J]. Circulation,2000,101(10):1185-1191.
[20] Gould PA,Yii M,McLean C,et al. Evidence for increased atrial sympathetic innervation in persistent human atrial fibrillation [J]. Pacing Clin Electrophysiol,2006,29(8):821-829.
[21] de Jong MR,Hoogerwaard AF,Adiyaman A,et al. Treatment of atrial fibrillation in patients with enhanced sympathetic tone by pulmonary vein isolation or pulmonary vein isolation and renal artery denervation:clinical background and study design:The ASAF trial:ablation of sympathetic atrial fibrillation [J]. Clin Res Cardiol,2018,107(7):539-547.
(收稿日期:2018-06-22 本文編辑:罗乔荔)
