褪黑素对脓毒症小鼠急性肾损伤及miR-146a水平的影响
2019-04-28张家宁曹梦远李林成刘铭传刘洋何亭
张家宁 曹梦远 李林成 刘铭传 刘洋 何亭

[摘要] 目的 探讨褪黑素(MT)对内毒素(LPS)诱导的脓毒症肾损伤小鼠炎症及肾脏细胞凋亡的影响,以及MT对脓毒症肾损伤的作用及其与microRNA-146a(miR-146a)的关系。 方法 将48只雄性Balb/c小鼠按照随机数字表法分为假手术组(Sham组)、MT治疗组(MT组)以及假治疗组(NS组),每组16只。MT组、NS组小鼠腹腔注射LPS(10 mg/kg体重)制备脓毒症模型,MT组小鼠于建模前半小时、建模时、伤后4 h分3次注射MT(30 mg/kg体重),NS组及Sham组小鼠在MT组相应给药时间点注射等量生理盐水。LPS处理24 h后,检测各组白细胞介素(IL)-1β、IL-6 mRNA的水平、miR-146a的水平、凋亡蛋白Caspase-3、Bax的表达情况,以及血清肌酐(Cr)及尿素氮(BUN)水平。LPS处理72 h后观察各组小鼠肾脏病理变化及损伤情况。 结果 ①Sham组肾小球、肾小管结构完整,NS组肾小管内管型形成,肾小管结构不清,肾小球固缩,大量炎症细胞浸润;MT组坏死肾小球数目明显少于NS组。②NS组、MT组血清Cr、BUN含量显著高于Sham组(P < 0.01),MT组血清Cr、BUN含量则显著低于NS组(P < 0.01)。③MT组肾脏组织Cleaved-caspase-3、Bax表达量显著低于NS组(P < 0.01)。④三组肾脏组织中IL-1β和IL-6水平比较,差异有统计学意义(P < 0.05),其中MT组肾脏组织IL-1β、IL-6显著低于NS组(P < 0.01)。⑤三组肾脏组织中miR-146a水平比较,差异有高度统计学意义(P < 0.01),MT组显著高于NS组(P < 0.01)。 结论 MT对LPS诱导的脓毒症小鼠肾损伤有明显治疗作用,这种治疗作用可能是通过上调miR-146a,進而抑制炎症及细胞凋亡实现的。
[关键词] 褪黑素;脓毒症;肾损伤;微小RNA-146a
[中图分类号] R631 [文献标识码] A [文章编号] 1673-7210(2019)02(b)-0004-05
[Abstract] Objective To investigate the effect of melatonin (MT) on apoptosis of renal cells and inflammation in lipopolysaccharide (LPS)-induced septic mice, and to explore the effect of MT on renal injury in sepsis as well as the role that microRNA-146a(miR-146a) plays. Methods Forty-eight male Balb/c mice were divided into sham-operated group (Sham group), MT treatment group (MT group) and placebo group (NS group) according to random number table method, with 16 mice in each group. Mice in the latter two groups were injected with LPS (10 mg/kg body weight) intraperitoneally to prepare sepsis model. Mice in MT group were injected with MT (30 mg/kg body weight) three times separately at half an hour before LPS injection, the same time as LPS injection and 4 hours after injection. At the same time,mice in NS group and Sham group were injected with same volume saline. After LPS treatment for 24 hours, the levels of interleukin (IL)-1β and IL-6 mRNA, miR-146a, the expression of apoptotic proteins Caspase-3 and Bax, serum creatinine (Cr) and urea nitrogen (BUN) were detected. After LPS treatment for 72 hours, the renal pathological changes and injuries of mice in each group were observed. Results ①The renal structure was normal in Sham group. The renal tubules in NS group were of tubular type, with unclear tubular structure, glomerular pyknosis, and a large number of inflammatory cells infiltrating; the number of necrotic glomeruli in MT group was much less than that in NS group. ②The levels of serum Cr and BUN in NS group were significantly higher than those in Sham group (P < 0.01). The levels of Cr and BUN in MT group mice were significantly lower than those in NS group (P < 0.01). ③The levels of Cleaved-caspase 3 and Bax in MT group mice were significantly lower than those in NS group (P < 0.01). ④The levels of IL-1β and IL-6 in these three groups mice had statistically significant difference (P < 0.05). In MT group, the levels of IL-1β and IL-6 in renal tissues were lower than those in NS group (P < 0.01). ⑤The levels of miR-146a in renal tissues were highly statistically different in these three groups mice (P < 0.01). In MT group, it was significantly higher than that in NS group (P < 0.01). Conclusion MT can significantly improve renal injury in LPS-induced septic mice, which may related to the upregulation of miR-146a and suppression of inflammation and cell apoptosis.
[Key words] Melatonin; Sepsis; Renal injury; microRNA-146a
脓毒症是指感染或严重创伤导致的不可控的炎性反应,其发病率和死亡率极高,是重症监护室中患者死亡的主要原因之一[1]。脓毒症常致多器官功能衰竭综合征(MODS),肾脏是其经常累及的脏器之一[2]。据报道,脓毒症患者中急性肾损伤发生率高达40%,严重威胁患者生命健康安全[3]。褪黑素(MT)是由松果体分泌的吲哚类神经内分泌激素,具有调节生物钟、抗氧化、清除氧自由基、抗炎、调节免疫等多种生物学功能[5-6]。目前已有研究发现MT对脓毒症大鼠有一定的保护作用[7]。脓毒症合并急性肾损伤病死率较高,是亟待解决的医学难题。本研究拟通过观察MT对脓毒症小鼠急性肾损伤及miR-146a水平的影响,初步阐明MT对脓毒症肾损伤的作用及其与miR-146a水平的关系,为疾病的治疗提供新思路,为相关研究提供新视角。
1 材料与方法
1.1 动物及主要试剂与仪器
健康清洁级雄性Balb/c小鼠48只,重量20~25 g,购自空军军医大学实验动物中心,使用许可证号:SYXK(军)2012-0022。Cleaved-caspase-3(货号:9661)、Bax(货号:14796S)多克隆抗体、小鼠抗β肌动蛋白抗体(货号:3700)购自美国CST公司;辣根过氧化物酶标记的山羊抗兔IgG二抗(批号:01334)、山羊抗鼠IgG二抗(批号:01325)均购自武汉博士德生物工程有限公司;内毒素(LPS)(批号:037M4015V)购自Sigma公司;Trizol(批号:AHF1813A)试剂购自美国Invitrogen公司;肌酐(Cr)(货号:C011-2)、尿素氮(BUN)(货号:C013-2)ELISA检测试剂盒购自南京建成生物工程研究所;SYBR Green MasterMix(批号:A8605)购自美国ABI公司。3-18K型高速冷冻离心机购自Sigma公司;紫外线分光度计、mini PROTEAN型垂直电泳仪、电转移仪均购自美国Bio-Rad公司;7900HT型荧光定量PCR仪购自美国应用生物公司;ImageMaster凝胶成像分析仪购自Applied Biosystems公司。
1.2 模型制备及分组处理
Balb/c小鼠采取22~26℃ SPF环境饲养,自由饮食,光照控制12 h明/12 h暗,湿度50%~60%。实验前分笼饲养24 h,按照随机数字表法分为假手术组(Sham组)、MT治疗组(MT组)与假治疗组(NS组),每组16只。MT组与NS组小鼠腹腔注射LPS(10 mg/kg体重),MT组小鼠于建模前半小时、建模时、伤后4 h分3次注射MT(30 mg/kg体重),NS组小鼠在MT组相应给药时间点注射等量生理盐水;Sham组仅在相应给药时间点腹腔注射等量生理盐水。各组小鼠处理后分笼饲养,自由饮食。
1.3 标本采集
LPS注射24 h后,各组半数小鼠采用1%戊巴比妥钠40 mg/kg腹腔注射麻醉,眼球取血,室温静置15 min后,1500 r/min离心15 min,离心半径15 cm,收集血清分装,-80℃冻存。采血后脱颈处死小鼠。各组其余半数小鼠,在LPS注射72 h后,麻醉后颈椎脱臼处死,迅速切取双侧肾脏,部分组织用体积分数10%的甲醛固定,部分组织-80℃冻存。
1.4 观察指标
1.4.1 肾脏组织形态 取各组甲醛固定的肾脏组织标本,酒精梯度脱水,常规石蜡包埋,制成5 μm厚切片,脱蜡后HE染色,智能生物图像导航仪400倍镜下观察组织形态。
1.4.2 血清Cr、BUN含量 将收集到的血清稀释10倍后测定肾功能生化指标Cr和BUN的含量,操作严格按照试剂盒说明书进行。
1.4.3 肾脏组织中Cleaved-caspase-3、Bax蛋白表达 采用蛋白质印迹法(Westen blot)进行检测。将各组每只小鼠冻存肾脏组织标本50 mg加组织细胞裂解液匀浆,提取蛋白,BCA定量。蛋白样本均以50 μg上样,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),湿法转膜,50 g/L脱脂奶粉室温封闭2 h。分别加入兔抗鼠Cleaved-caspase-3、Bax一抗(稀释比例均为1∶1000),4℃孵育过夜后加入辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释比例为1∶3000),37℃孵育1 h。化学发光、显影,凝胶图像分析系统行灰度扫描分析,系统自带软件分析蛋白条带灰度值。实验重复3次。
1.4.4 肾脏组织中IL-1β、IL-6 mRNA表達 取各组每只小鼠冻存肾脏组织标本50 mg,用Trizol试剂提取总RNA,测定RNA浓度,反转录合成互补DNA。引物由日本TaKaRa公司设计合成,序列及产物大小见表1。按照SYRB Green荧光定量试剂盒说明书进行PCR,以GAPDH为内参照,PCR反应条件:95℃预变性10 min,95℃变性10 s,60℃退火与延伸20 s,共40个循环。采用△循环阈值(Ct)法处理结果并计算肾脏组织中IL-1β、IL-6 mRNA相对表达量,即2-△△Ct。实验重复3次。
1.4.5 肾脏组织中miRNA-146的表达 采用实时荧光定量RT-PCR法检测。取各组每只小鼠冻存肾脏组织标本50 mg,用Trizol试剂提取总RNA,测定RNA浓度,反转录合成互补DNA。引物由日本TaKaRa公司设计合成,序列分别为miR-146a:5′-TGAGAACTGAATTCCATAGGC-3′;U6:5′-GTGCTCGCTTCGGC-AGCACATAT-3′。按照SYRB Green荧光定量试剂盒说明书进行PCR,以U6为内参照,PCR反应条件不变。采用△循环阈值(Ct)法处理结果计算肾脏组织中miR-146a相对表达量,即2-△△Ct。实验重复3次。
1.5 统计学方法
应用SPSS 18.0统计软件包对所得数据进行统计学分析,计量资料以均数±标准差(x±s)表示,三组间比较采用One-way ANOVA检验,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
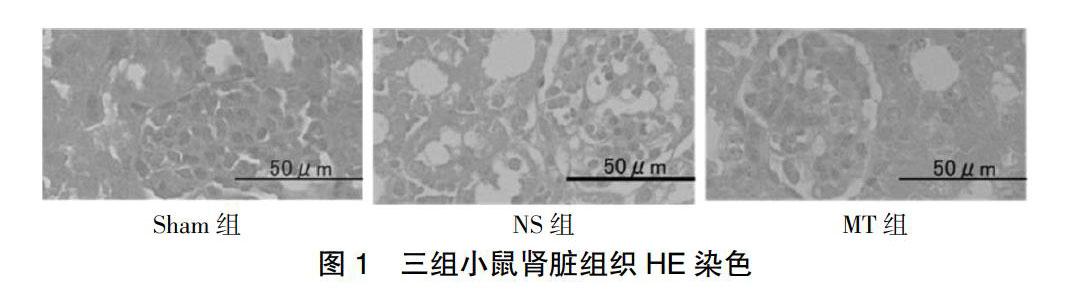
2.1 三组小鼠肾脏组织形态比较
伤后24 h,Sham组小鼠肾脏组织与正常肾脏组织无异;NS组肾小球固缩,肾小管上皮变性坏死,肾间质充血严重,大量炎症细胞浸润;MT组肾脏组织损伤程度远低于NS组。见图1。
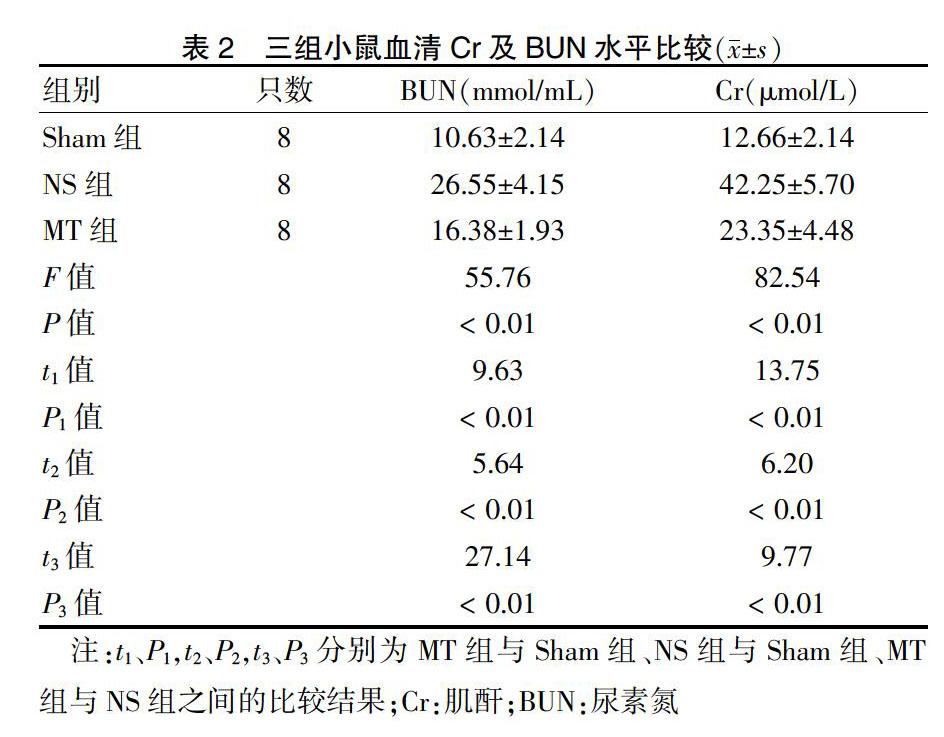
2.2 三组小鼠血清Cr及BUN水平比较
三组小鼠血清Cr及BUN水平总体比较差异均有统计学意义(P < 0.05)。NS组、MT组明显高于Sham组(P < 0.01),MT组明显低于NS组(P < 0.01)。见表2。
2.3 三组小鼠肾脏组织中凋亡相关蛋白表达比较
三组小鼠肾脏组织中Cleaved-caspase 3、Bax蛋白表达比较,差异均有统计学意义(P < 0.05)。MT组、NS组肾脏组织中凋亡相关分子Cleaved-caspase 3、Bax蛋白表达水平明显高于Sham组(P < 0.01),NS组明显高于MT组(P < 0.01)。见表3、图2。
2.4 三组小鼠肾脏组织中IL-1β、IL-6的mRNA表达水平比较
三组小鼠肾脏组织中IL-1β、IL-6的mRNA水平总体比较,差异均有统计学意义(P < 0.05)。MT组、NS组IL-1β、IL-6的mRNA表达水平明显高于Sham组(P < 0.01),MT组明显低于NS组(P < 0.01)。见表4。
2.5 三组小鼠肾脏组织中miR-146a的表达水平比较
Sham组、MT组及NS组小鼠肾脏组织miR-146a的表达水平分别为(1.00±0.03)、(3.44±0.95)、(2.12±0.61),总体比较,差异有高度统计学意义(P < 0.01)。MT组及NS组均高于Sham组(P < 0.01),MT组显著高于NS组(P < 0.01)。
3 讨论
脓毒症是ICU患者死亡的重要原因,而肾脏则是脓毒症最常累及的脏器之一[2]。脓毒症伴急性肾损伤发病率高,且病死率明显高于未合并急性肾损伤的脓毒症患者,亦高于非脓毒症急性肾损伤患者[8]。因此,在脓毒症患者的治疗过程中肾损伤的治疗十分重要。脓毒症发病机制十分复杂,目前研究认为脓毒症的发病与宿主炎性反应平衡失调和免疫功能紊乱密切相关[9]。而脓毒症导致的肾血流动力学的改变和大量炎性因子在肾脏的聚集是脓毒症伴发急性肾损伤的主要致病因素[10]。研究表明,MT具有抗炎、抗氧化、清除氧自由基、调节免疫及改善微循环等多种生物学作用[5-6],这对炎性疾病的治疗有重要意义。
本研究通过对比分析不同分组小鼠的肾脏病理改变情况,发现MT组小鼠肾脏组织炎症细胞浸润水平和肾脏组织损害程度要明显低于未经治疗的小鼠。同样,MT组的小鼠血清中Cr、BUN含量也明显低于未治疗小鼠,兩者比较差异有统计学意义。这提示MT对脓毒症伴发的急性肾损伤起到了一定的治疗作用。Caspase-3与Bax蛋白在介导细胞凋亡的信号通路中发挥着重要作用[11]。本研究发现,NS组活化的Caspase-3及Bax水平明显高于Sham组,提示LPS诱导产生了显著的肾损伤;而经过MT治疗后,活化的Caspase-3及Bax水平有了显著的下降,提示MT治疗对抑制肾脏细胞凋亡具有一定的意义。IL-1β、IL-6作为重要的促炎及免疫调控因子,在脓毒症发展过程中具有重要的作用[9]。经MT治疗的小鼠体内IL-1β、IL-6水平明显降低,提示MT可显著降低小鼠体内的炎性因子水平,减轻过度活化的炎性反应对组织的损伤,从而起到改善脓毒症的作用。
microRNA是一种广泛存在于真核细胞中,在体液中稳定存在,几乎不受RNA酶、温度等因素影响的物质[12],在细胞分化、增殖凋亡中起到重要作用[13]。此外,微小RNA作为一种血清学标志物,其在恶性肿瘤、组织损伤等方面的诊断价值也得到了诸多学者的认同[14-15],并对脓毒症早期诊断及其严重程度、预后的判断具有重要的意义[16-17]。miR-146a是miR-146家族中的一员,研究表明,miR-146a为核因子κB(NF-κB)依赖性基因,通过对其作用靶点肿瘤坏死因子受体相关因子6(TRAF-6)与白细胞介素1受体相关激酶1(IRAK-1)进行调控,进而起到降低TNF-α、IL-1β以及IL-6等炎性因子的作用,抑制炎性因子的表达和炎性细胞的浸润[18-20]。在脓毒症诱导的急性肺损伤中,研究者发现提高miR-146a的水平,可有效抑制脓毒症引起的炎症反应[21],且有研究发现miR-146a在固有免疫中发挥负反馈调控作用[22]。因此,提高miR-146a的水平成为许多炎性疾病潜在的治疗策略。本研究中,我们发现NS组小鼠体内miR-146a的水平高于Sham组,这可能与促炎因子刺激使miR-146a表达升高有关[23]。MT组中miR-146a显著升高,且脓毒症症状显著减轻,结合既往研究,提示MT组肾损伤情况的好转可能与miR-146a水平的升高密切相关。
综上,本研究认为,MT可提高动物体内miR-146a的水平,进而拮抗炎性因子的表达,减少组织细胞凋亡,抑制炎性反应,减轻脓毒症导致的急性肾损伤,进而改善脓毒症结局。
[参考文献]
[1] van Zanten AR,Brinkman S,Arbous MS,et al. Guideline Bundles Adherence and Mortality inSevere Sepsis and Septic Shock [J]. Crit Care Med,2014,42(8):1890-1898.
[2] Singer M,Deutschman CS,Seymour CW,et al. The Third International Consensus Definitions for Sepsis and Septic Shock(Sepsis-3) [J]. JAMA,2016,315(8):801-810.
[3] Bagshaw SM,George C,Bellomo R,et al. Early acute kidney injury and sepsis:a multicentre evaluation [J]. Crit Care,2008,12(2):R47.
[4] Nahid MA,Pauley KM,Satoh M,et al. miR-146a is critical for endotoxin-induced tolerance. Implication on innate immunity [J]. J Biol Chem,2009,284(50):34590-34599.
[5] Tocharus J,Chongthammakun S,Govitrapong P. Melatonin inhibits amphetamine-induced nitric oxide synthase mRNA overexpression in microglial cell lines [J]. Neurosci Lett,2008,439(2):134-137.
[6] Maestroni GJ. The immunotherapeutic potential of melatonin [J]. Expert Opin Investiq Drugs,2001,10(3):467-476.
[7] 宋潔琼,吴威,陈嵩,等.褪黑素对脂多糖诱导的脓毒症大鼠肺损伤的保护作用[J].中国临床医学,2016,23(5):550-553.
[8] Nisula S,Kaukonen KM,Vaara ST,et al. Incidence,risk factors and 90-day mortality of patients with acute kidney injury in Finnish intensive care units:the FINNAKI study [J]. Intensive Care Med,2013,39(3):420-428.
[9] 姚咏明,张艳敏.脓毒症发病机制最新认识[J].医学研究生学报,2017,30(7):678-683.
[10] Dellepiane S,Marengo M,Cantaluppi V. Detrimental cross-talk between sepsis and acute kidney injury:new pathogenic mechanisms,early biomarkers and targeted therapies [J]. Crit Care,2016,20:61.
[11] Valero JG,Cornutthibaut A,Juge R,et al. μ-Calpain conversion of antiapoptotic Bfl-1(BCL2A1)into a prodeath factor reveals two distinct alpha-helices inducing mitochondria-mediated apoptosis [J]. PLoS One,2012,7(6);e38620.
[12] Chen X,Ba Y,Ma L,et al. Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases [J]. Cell Res,2008,18(10):997-1006.
[13] Bartel DP. MicroRNAs:target recognition and regulatory functions [J]. Cell,2009,136(2):215-233.
[14] Wittmann J,Jack H. Serum microRNAs as powerful cancer biomarkers [J]. Biochimica Biophys Acta,2010,1806(2):200-207.
[15] Laterza OF,Lim L,Garrettengele PW,et al. Plasma MicroRNAs as sensitive and specific biomarkers of tissue injury [J]. Cli Chem,2009,55(11):1977-1983.
[16] Wang H,Zhang P,Chen W,et al. Serum microRNA signatures identified by Solexa sequencing predict sepsis patients′ mortality:a prospective observational study [J]. PloS One,2012,7(6):e38885.
[17] Wang HJ,Zhang PJ,Chen WJ,et al. Four serum microRNAs identified as diagnostic biomarkers of sepsis [J]. J Trauma Acute Care Surg,2012,73(4):850-854.
[18] Jiang W,Kong L,Ni Q,et al. miR-146a Ameliorates Liver Ischemia/Reperfusion Injury by Suppressing IRAK1 and TRAF6 [J]. PLoS One,2014,9(7):e101530.
[19] Selvamani SP,Mishra R,Singh SK. Chikungunya Virus Exploits miR-146a to Regulate NF-κB Pathway in Human Synovial Fibroblasts [J]. PLoS One,2014,9(8):e103624.
[20] 林海焕,莫泽珣,苏和毅,等.循环微小RNA作为脓毒症生物标志物的研究进展[J].中华危重病急救医学,2016, 28(8):752-755.
[21] 孟建斌,孙丽萍,瓦永禄,等.miRNA-146a在脓毒症引起的急性肺损伤中的作用机制[J].解放军医学杂志,2017, 42(3):207-210.
[22] Li C,Fu W,Zhang Y,et al. Meta-Analysis of microRNA-146a rs2910164 G>C polymorphism association with autoimmune diseases susceptibility,an update based on 24 studies [J]. PLoS One,2015,10(4):e121918.
[23] Perry MM,Moschos SA,Williams AE,et al. Rapid Changes in MicroRNA-146a Expression Negatively Regulate the IL-1β-Induced Inflammatory Response in Human Lung Alveolar Epithelial Cells [J]. J Immunol,2008,180(8):5689-5698.
(收稿日期:2018-06-08 本文編辑:罗乔荔)
