骨相关性浆细胞瘤的临床特征及其影响因素分析
2019-04-28安然景红梅甄敬飞庞萌
安然,景红梅,甄敬飞,庞萌
北京大学第三医院血液科,北京1001910
多发性骨髓瘤(multiple myeloma,MM)是浆细胞恶性克隆增殖性疾病,主要为单克隆浆细胞在骨髓中恶性增殖并广泛浸润,常伴有血液或尿液中大量单克隆免疫球蛋白和(或)轻链的分泌,使正常的多克隆浆细胞和免疫球蛋白的增殖及分泌受到抑制。目前认为MM均由意义未明的单克隆丙种球蛋白血症(monoclonal gammopathy of undermined significance,MGUS)发展而来[1]。髓外骨髓瘤(extramedullary myeloma,EMM)是指骨髓瘤细胞在髓外浸润,目前有关EMM的研究成为了热点。Touzeau和Moreau[2]将EMM进行了系统分类,分为骨相关性浆细胞瘤(bone-related plasmacytoma,BRP)、髓外病变(extramedullary disease,EMD)、浆细胞白血病(plasma cell leukemia,PCL)和孤立性浆细胞瘤(solitary plasmacytoma,SP)。由于BRP作为EMM新的分类鲜有报道,本文针对BRP患者的临床特征,探讨可能影响BRP发生的因素,现报道如下。
1 资料与方法
1.1 一般资料
收集2010年1月至2018年1月于北京大学第三医院确诊的229例MM患者的临床资料。MM诊断参考国际骨髓瘤工作组(International Myeloma Working Group,IMWG)标准[3]。根据计算机断层扫描(CT)、核磁共振成像、正电子发射断层显像/计算机断层扫描(positron emission tomography/computed tomography,PET/CT)等影像学结果,将患者分为BRP组(n=40)和普通MM组(n=189)。
1.2 方法
根据患者的临床资料,如年龄、性别、M蛋白分型、血红蛋白(hemoglobin,Hb)、血小板计数、血尿素氮(blood urea nitrogen,BUN)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、肌酐(creatinine,Cr)、乳酸脱氢酶(lactate dehydrogenase,LDH)、尿酸(uric acid,UA)、血钙(calcium,Ca)、β2微球蛋白(β2-microglobulin,β2-MG)、轻链蛋白,以及骨标志物骨钙素(osteocalcin,OC)、β-胶原降解产物(β-collagen degradation product,β-CTX)、总1型前胶原氨基端延长肽(total procollagen type 1 N-terminal propeptide,TP1NP)等特征和指标以及影像学检查结果,如X线、CT、核磁共振成像、PET/CT等,按照Durie-Salmon(DS)分期法和国际分期体系(International Staging System,ISS)分期法进行分期。
1.3 统计学分析
采用SPSS 22.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验,多因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 BRP组和普通MM组患者的基本临床特征
229例MM患者中,BRP患者40例,发病年龄为42~82岁,中位发病年龄为63.5岁;普通MM患者189例,发病年龄为35~84岁,中位发病年龄为61.5岁。BRP组和普通MM组患者的性别和免疫分型比较,差异均无统计学意义(P>0.05);BRP组和普通MM组患者的DS分期和ISS分期比较,差异均有统计学意义(P<0.05)(表1)。
2.2 MM患者发生BRP影响因素的单因素分析
普通MM组和BRP组患者的Hb、OC、TP1NP、LDH、Ca、磷、β2-MG水平比较,差异均无统计学意义(P>0.05);普通MM组和BRP组患者的β-CTX、ESR、BUN、Cr、UA比较,差异均有统计学意义(P<0.05)。(表2)
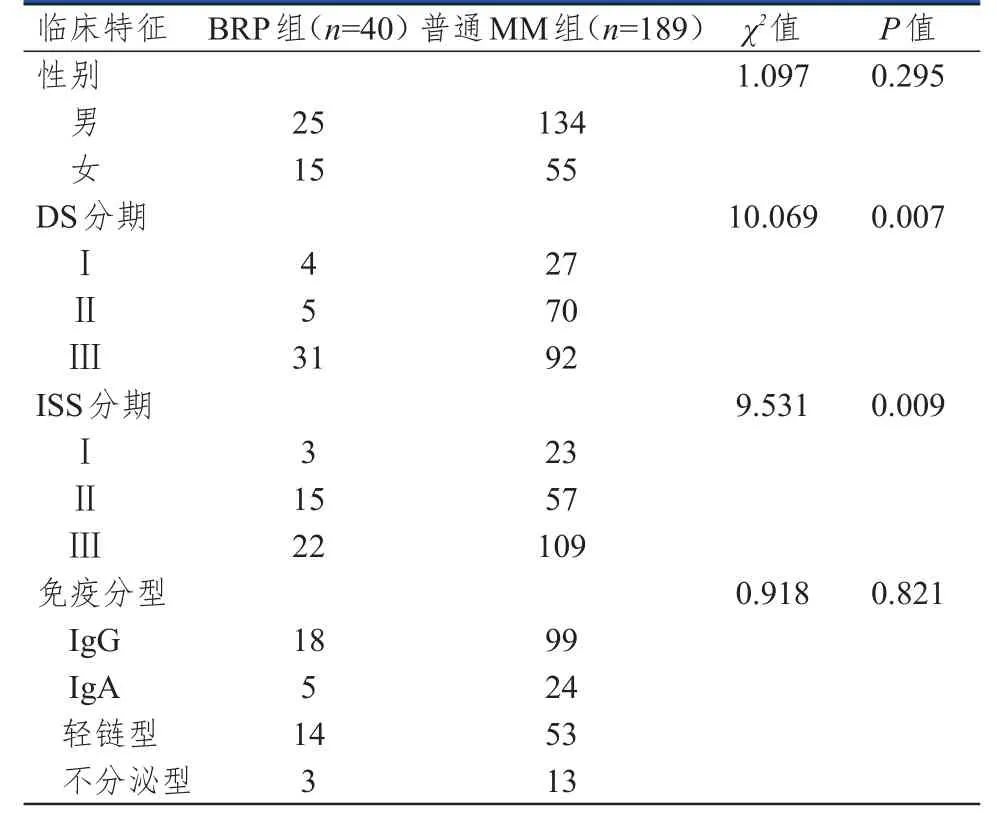
表1 BRP组和普通MM组患者基本临床特征的比较
2.3 MM患者发生BRP影响因素的多因素分析
多因素分析结果显示,β-CTX升高是BRP发生的独立保护因素(OR=0.050,P=0.041)。(表3)
2.4 BRP患者的主要临床症状
首诊时BRP患者多表现为骨相关症状:骨痛、活动不便、麻木38例,体检发现溶骨性病变1例,上腹部疼痛不适1例。并发症:椎管狭窄、脊椎受压、骨折19例,周围神经病1例,通过活检确诊心脏淀粉样变1例。BRP多发生于脊椎,部分患者表现为多脊段分布;其次为肋骨、骨盆,表现为骨内突破性伴骨皮质破坏以及骨旁软组织肿块两种类型。BRP患者的髓外浸润部位:胸椎13例(32.5%),腰骶椎13例(32.5%),颈椎7例(17.5%),肋骨4例(10.0%),骨盆2例(5.0%),四肢骨1例(2.5%)。
2.5 影像学检查
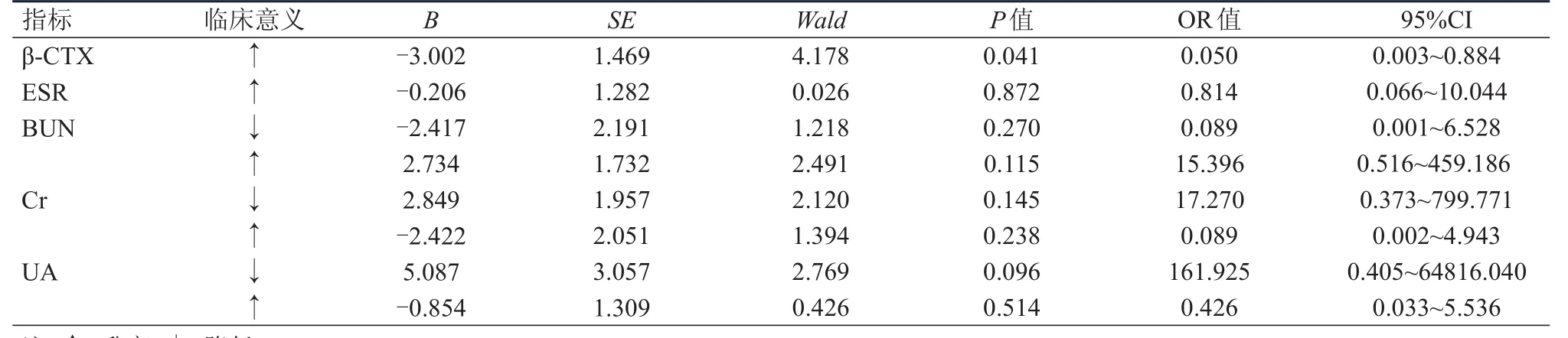
表3 MM患者发生BRP影响因素的多因素Logistic分析(n=229)
40例BRP患者入院及治疗过程中常规X线检查均未发现BRP表现,40例患者均行局部CT或核磁共振成像(平扫+增强扫描),发现BRP均为软组织影(图1)。3例患者在发现BRP同时期行PET/CT检查,其中2例患者可通过该检查发现BRP,1例患者未发现。
3 讨论
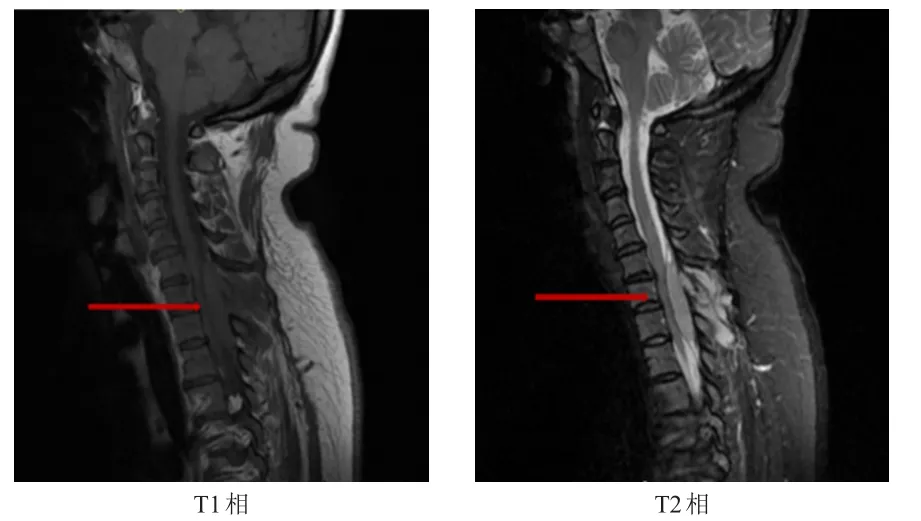
图1 BRP患者的核磁共振成像
目前在MM患者中,初诊时即发现EMM的患者占7%~18%[4-5],而在MM发生发展过程中发现继发性EMM的患者占6%~20%[6]。研究显示,MM患者中EMM的发病率可增至30%左右[7-8]。陈海飞等[9]报道,免疫分型为IgG的患者出现EMM最多,占40%。本研究结果表明,BRP患者的免疫分型以IgG为主,占45%(18/40)。近年来BRP作为EMM的新分类得到了关注,但目前尚无系统的研究报道。影响MM预后的因素较多,Kyle等[10]回顾性分析了1027例MM患者的临床特征,结果发现Hb、血小板、血浆白蛋白、Cr水平为患者预后的影响因素。本研究结果发现,普通MM组和BRP组患者的ESR、BUN、Cr、UA比较,差异均有统计学意义(P<0.05),提示上述指标可能与BRP的发生有关。但多因素分析结果显示,上述指标均不是BRP发生的独立影响因素。
研究报道,BRP多发生于中轴骨(肋骨、脊椎骨、颅骨、胸骨和骨盆)[2],本研究结果与之相符。本研究采用了骨标志物作为临床特征的评价指标。OC是骨基质中最重要的一种特异性非胶原蛋白,在骨合成过程中由成骨细胞合成,成骨过程依赖维生素K,同时维生素D3促进OC的产生[11-12]。OC占骨非胶原成分的15%,裂解后1/3是大的片段N端骨钙素,主要功能是维持骨的正常矿化,被认为是成骨的标志之一[13]。Ⅰ型胶原的含量占骨有机成分的90%以上,Ⅰ型胶原是由成骨细胞以Ⅰ型前胶原肽的形式合成,在前胶原肽转化为胶原的过程中被特异性蛋白酶切割为Ⅰ型前胶原氨基端延长肽(procollagen type 1 amino-terminal propeptide,PINP)和Ⅰ型前胶原羧基端延长肽(procollagen type 1 carboxy-terminal propeptide,PICP)。PINP反映Ⅰ性胶原的沉积情况,可以反映成骨细胞的活性,也是成骨的标志一。本研究中检测的是血液中所有PINP的形式,也称为TP1NP。在正常的骨转化中,Ⅰ型胶原被破骨细胞降解,释放Ⅰ型胶原羧基端肽分子和Ⅰ型胶原氨基端肽分子,其中羧基端肽的α-天冬氨酸转变成β-CTX,是骨破坏吸收的指标。本研究结果显示,β-CTX升高是MM患者发生BRP的独立保护因素(OR=0.050,P=0.041)。目前骨标志物在MM中已有相关研究,文献指出β-CTX在MM的发病初期和进展期均对预后有指导意义[14]。本研究回顾性分析40例BRP患者的影像学检查结果,BRP均表现为软组织瘤、无钙化,对比MM以溶骨为主要表现,代表破骨的β-CTX减少提示BRP发生的概率增加,而合并髓外浸润的MM患者预后较差[15]。
MM是依赖于肿瘤微环境的恶性肿瘤,多种因素可通过调节微环境从而达到改变MM细胞增殖、迁移和生存的作用,进而影响MM细胞的增殖和骨髓中恶性浆细胞的归巢[16]。这些因素包括可溶性因子如白细胞介素-6、肝细胞生长因子,血管内皮生长因子、肿瘤坏死因子及细胞基质衍生因子-1α(stromal derived factor-1α,SDF-1α)等与骨髓瘤细胞的黏附。骨髓内皮细胞分泌SDF-1α,作为趋化因子受体 4(chemokine receptor 4,CXCR4)的配体[17],通过刺激骨髓瘤的趋化作用,从而有利于MM细胞黏附到骨髓基质间。同时MM细胞和骨髓内皮细胞之间的相互作用使许多促进血管增生的细胞因子上调,甚至骨髓细胞也可以产生血管内皮生长因子,从而进一步刺激骨髓微环境的血管生成和骨髓瘤髓外进展。从分子生物学角度来讲,p53和FAK等基因不仅影响骨髓微环境中蛋白质的改变,也可通过改变肿瘤微环境,从而在髓外疾病的发病机制中起关键作用[18-19]。近年来有研究表明,骨骼是一个具有重要免疫调节功能的器官,破骨细胞除吸收骨基质外,还具有重要的免疫调节功能[20]。An等[21]提出,MM细胞可能利用破骨细胞对于T淋巴细胞的反馈机制抑制T淋巴细胞的功能,从而进行免疫逃逸,进而产生髓外转移。
对于EMD及PCL等与骨存在明显解剖距离的EMM,目前仍考虑以血运途径转移为主。目前有多个中心通过二代测序技术在MM患者血液中检测到MM细胞[22-23],并通过相同的方法证明骨髓MM细胞和血液MM细胞具有异质性和克隆衍化。北京大学第三医院血液科前期研究中检测并分析EMM和MM的患者循环浆细胞,提示伴EMM的MM患者的循环浆细胞阳性率明显高于不伴EMM的患者(88.9%vs 25.0%,P<0.01)[24]。研究表明,BRP表现为骨内或骨旁的软组织瘤,与骨SP有所区别[25]。
综上所述,β-CTX升高可作为MM患者发生BRP的独立保护因素。BRP与EMD、PCL的发病机制存在差异,BRP的产生与局部骨的破坏相关,直接浸润生长或突破骨皮质为其生长方式。继续研究肿瘤微环境及破骨细胞、成骨细胞的活性,可能会对进一步解释BRP的发生机制提供帮助。
