CTU联合CTA在后腹腔镜阻断副肾动脉的小肾癌肾部分切除术中的应用△
2019-04-28王振潮宋殿宾徐辉李俊鹏王海龙梁宗英
王振潮,宋殿宾#,徐辉,李俊鹏,王海龙,梁宗英
承德医学院附属医院1泌尿外科,2胸外科,河北承德067000
肾癌是一种常见的泌尿系统恶性肿瘤。目前临床上将肿瘤直径小于4 cm的肾细胞癌称为小肾癌。随着医学影像学技术的飞速发展,小肾癌的检出率日益增高。通过后腹腔镜行肾部分切除手术已成为小肾癌的首选治疗方法[1]。在后腹腔镜肾癌手术过程中,肾动脉的变异较常见,且发生率较高,其中,副肾动脉是与临床有密切关系的血管变异,直接决定手术方式和手术相关并发症发生的发生率[2]。术前对副肾动脉变异的了解对于术中肾动脉的处理及肿瘤的切除极为重要。计算机体层摄影血管造影(computed tomography angiography,CTA)和计算机体层摄影尿路造影(computed tomography urography,CTU)可以从不同的方向和角度清晰地显示肾脏血管、肾孟、输尿管的全貌,为手术的顺利实施及患者术后的快速康复提供有力的保障[3]。本研究选择40例存在副肾动脉的小肾癌患者作为研究对象,探讨CTA联合CTU检查在后腹腔镜阻断副肾动脉的小肾癌肾部分切除术中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2018年1月于承德医学院附属医院泌尿外科收治的40例小肾癌患者。纳入标准:①肾肿瘤为单发,且经术后病理学检查证实为肾细胞癌;②未合并其他部位原发性肿瘤;③术前经CTA证实均存在副肾动脉。排除标准:①肿瘤直径>4 cm;②术前经CTA证实肿瘤多发或无副肾动脉。根据治疗方法的不同将40例小肾癌患者分为试验组和对照组,每组20例,试验组患者术前行CTA联合CTU检查,对照组患者术前行单纯CTA检查。试验组中,男12例,女8例;年龄为49~69岁,平均年龄为(60.3±7.2)岁;左肾肿瘤13例,右肾肿瘤7例;肿瘤直径为1.7~3.3 cm,平均肿瘤直径为(2.4±0.7)cm。对照组中,男11例,女9例;年龄为51~79岁,平均年龄为(64.3±6.9)岁;左肾肿瘤12例,右肾肿瘤8例;肿瘤直径为1.8~3.4 cm,平均肿瘤直径为(2.7±0.5)cm。两组患者的性别、年龄、发病部位和肿瘤平均直径比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 扫描方法
扫描前,患者空腹12 h以上,进行碘过敏试验并显示过敏试验阴性,全部患者签署CT增强扫描检查知情同意书。扫描前30 min,患者空腹饮纯净水600 ml左右并通过训练控制呼吸。试验组:静脉注入碘帕醇0.3 ml/kg,注射速度为1.5~4.0 ml/s,注射药物后5 min进行跟踪扫描。采用64层螺旋CT以肾门为中心行CTA检查经肘前静脉借助高压注射器快速团注80~100 ml非离子型对比剂碘普罗胺。流率控制在2.5 ml/s。对比剂注射后30~45 s实施扫描,采用64层螺旋CT以肾门为中心行CTU检查。对照组:以肾门为中心行单纯CTA检查。扫描完成后,所有容积资料传至AW4.5工作站进行CT扫描重建。
1.3 手术方法和评价指标
所有患者均通过后腹腔镜行肾部分切除术。手术方式:沿腋后线肋弓下皮肤做一切口(A点),钝性分离皮下组织,建立后腹膜腔;于腋前线肋弓下置入戳卡(B点);于腋中线髂骨翼上缘2 cm处放置10 mm的戳卡(C点)。在Gerota筋膜下游离肾脏,暴露肿瘤及周围组织。根据术前CTA、CTU检查结果和术中实际情况采取最佳的手术方案。阻断副肾动脉后,距肿瘤边缘0.5 cm处行肿瘤切除,阻断时间在30 min内,均留置肾周引流管。记录并比较两组患者手术相关指标(手术时间、术中热缺血时间、术后住院时间、术中出血量)、术后漏尿的发生率和肾小球滤过率(glomerular filtration rate,GFR)。
1.4 统计学方法
采用SPSS 21.0软件对-数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 手术相关指标的比较
40例患者均经手术证实副肾动脉的解剖结构、肿瘤位置、肿瘤大小及肿瘤与周边组织的关系与术前CTA和CTU结果显示一致。试验组患者的手术时间、术中热缺血时间和术后住院时间均明显短于对照组患者,试验组患者的术中出血量明显少于对照组患者,差异均有统计学意义(P<0.01)(表1)。试验组患者术后漏尿的发生率5%(1/20),低于对照组患者的35%(7/20),差异有统计学意义(χ2=3.906,P<0.05)。
2.2 术前与术后GFR的比较
术前,试验组与对照组患者的GFR比较,差异无统计学意义(P>0.05);术后1个月,试验组患者的GFR明显高于对照组患者,差异有统计学意义(P<0.01)。试验组患者术前与术后1个月的GFR比较,差异无统计学意义(P>0.05);术后1个月,对照组患者的GFR明显低于本组术前,差异有统计学意义(t=9.238,P<0.01)。(表2)
表1 两组小肾癌患者手术相关指标的比较(±s)

表1 两组小肾癌患者手术相关指标的比较(±s)
组别试验组(n=20)对照组(n=20)t值P值78.4±5.3 134.1±9.2 23.867 0.000 14.6±2.5 31.2±7.2 10.587 0.000 85.8±12.1 163.2±14.2 18.346 0.000 6.2±0.5 13.6±2.1 15.798 0.000手术时间(min)术中热缺血时间(min)术中出血量(ml)术后住院时间(d)
3 讨论
表2 两组小肾癌患者GFR的比较(ml/min,±s)
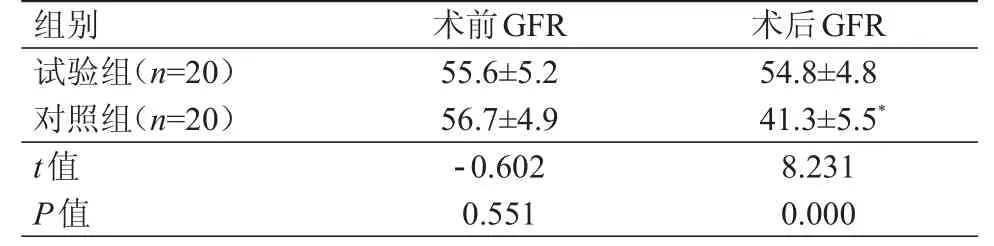
表2 两组小肾癌患者GFR的比较(ml/min,±s)
注:*与本组术前比较,P<0.01
组别试验组(n=20)对照组(n=20)t值P值55.6±5.2 56.7±4.9-0.602 0.551 54.8±4.8 41.3±5.5*8.231 0.000术前GFR 术后GFR
肾动脉由腹主动脉发出经肾门入肾,左右各1支[4]。肾动脉的异常变异主要包括肾动脉提前分支和副肾动脉两大类,其中,副肾动脉的发生率高于提前分支[5]。若术前忽视副肾动脉变异的存在,则术中可能对肾动脉造成损伤,使术中肾组织切除过多,从而导致肾功能不全;同时,肾动脉的损伤可能会造成术中大出血,对手术的顺利实施以及术后的快速康复造成极大的影响。随着计算机和医学影像学技术的飞速发展,肿瘤直径小于4 cm的小肾癌的检出率逐渐升高[6]。实践证实,后腹腔镜肾部分切除术治疗小肾癌具有创伤小、恢复快等优势,这些突出的优势已经使其逐渐取代传统的根治性肾切除术,但是,后腹腔镜肾部分切除术对于医师对解剖知识的掌握和手术技术具有更高的要求,而术前对肿瘤血管、肿瘤大小、肿瘤位置及肾脏血管的解剖变异情况等具体信息进行充分的了解尤其重要[7]。
现代医学影像学造影技术CTU和CTA具有扫描快、效率高、图像清晰等特点,能够大大提高诊断效能[8-10]。CTA联合CTU检查能够提前发现肾肾脏血管的异常解剖结构,明确肿瘤的位置、大小及与周边组织的关系,使术者在术前熟悉肾肾脏血管的走行和变异情况,为手术的顺利实施、手术安全性的提高以及术中损伤的减少提供有力的保障[11]。本研究显示,40例患者通过手术证实副肾动脉的异常与术前CTA显示的完全一致。CTA联合CTU检查能够充分显示异常肾脏血管的走行,肿瘤与周围血管、集合系统的毗邻关系。本研究中,试验组患者的手术时间、术中热缺血时间和术后住院时间均明显短于对照组患者,术中出血量明显少于对照组患者,术后漏尿的发生率低于对照组患者(P<0.05),说明CTA联合CTU检查能够减少术中损伤,降低手术风险,提高手术成功率,有利于患者术后康复。CTA联合CTU检查还可以使术者术前充分了解肾脏血管,降低术中损伤变异血管的概率,减少出血的发生,同时保障手术视野清晰,避免损伤周围组织及脏器,降低了术中中转开腹的概率。本研究还发现,试验组患者手术前后的GFR比较,差异无统计学意义(P>0.05),但是,对照组患者的GFR明显低于本组术前(P<0.01),这说明术前CTA联合CTU检查对后腹腔镜肾部分切除手术治疗小肾癌过程中减少肾功能的损伤有明显的优势。术前CTU联合CTA检查能够对患者肾脏的解剖结构进行充分了解,在手术中发挥着重要的作用,大大提高了手术的成功率。
综上所述,CTA联合CTU检查能够清晰显示肾脏血管的起源、走行及变异情况,肿瘤与肾脏血管系统、集合系统的关系以及肿瘤的载瘤动脉,能够指导术者术中快速地处理肾脏血管,提高手术的安全性。术前CTA联合CTU检查在后腹腔镜小肾癌肾部分切除术中尽可能地保护肾功能以及提高手术安全性方面具有重要的临床意义。
