川蔓藻对两种常见浮游藻类的化感作用
2019-04-28卢学强韩晓昕毛海燕
张 欣,卢学强*,王 兰,韩晓昕,毛海燕
川蔓藻对两种常见浮游藻类的化感作用
张 欣1,2,3,卢学强1,2,3*,王 兰1,2,韩晓昕1,2,毛海燕4
(1.南开大学环境科学与工程学院,天津 300350;2.南开大学天津市跨介质复合污染环境治理技术重点实验室,天津 300350;3.南开大学天津市环境生物地球化学循环调控技术国际联合研究中心,天津 300350;4.厦门海石生态环境股份有限公司,福建 厦门 361023)
选取沉水植物川蔓藻与浮游藻类普通小球藻、铜绿微囊藻为研究对象,测定在川蔓藻共培养胁迫下2种藻单独存在和按1:1(:)混合情况下的光密度、叶绿素a、最大光化学量子产量、相对电子传递速率、可溶性糖、丙二醛以及超氧化物歧化酶活性的变化.结果表明:在川蔓藻存在的条件下,普通小球藻、铜绿微囊藻和二者混合藻的生长被快速强烈抑制,抑制率在第6d时达到最大值,分别为80.95%、94.18%和94.01%.3个处理组的光密度值、叶绿素a、可溶性糖及最大光化学量子产量等指标均低于对照组,且随时间呈明显的下降趋势,说明其光合能力逐渐减弱.而丙二醛和超氧化物歧化酶指标在0~6d却高于对照组,表明可能发生了浮游藻类膜质过氧化过程.
川蔓藻;普通小球藻;铜绿微囊藻;化感作用
水华爆发严重影响着水质安全,会引发严重的饮用水供给危机[1-2].夏季水华浮游植物优势种主要为蓝藻和绿藻[3-5].铜绿微囊藻()是形成水华的一种典型的有毒蓝藻[6],会释放蓝藻毒素和异味物质,不仅会对水生生物包括鱼类、水生无脊椎动物、沉水植物、挺水植物、细菌等造成一定的伤害,还会通过向水环境中释放化感物质威胁到人类的健康[7].普通小球藻()是引起水华的具有代表性的一种绿藻,是北方滨海河流的优势种类[8].前期研究表明,一些沉水植物会对浮游藻类产生特异性的化感抑制作用[9-10].不同种类的浮游藻类之间也会存在竞争,铜绿微囊藻对小球藻、四尾珊藻等藻类都存在化感抑制作用[11-12].川蔓藻()是一种可在高盐度水域生长的沉水植物[13-14],同时,川蔓藻对普通小球藻还有明显的化感抑制作用[8],因而川蔓藻往往是滨海高盐环境水生态修复或水生态系统重建的必不可少的重要物种[15].水华中一般同时存在蓝藻和绿藻.然而,川蔓藻对蓝藻以及蓝藻和绿藻同时存在下的化感抑制作用以及可能的作用机理研究还相对较少.由于影响植物生长的因素较多[16],本实验在人工气候箱内进行,分别研究了川蔓藻共培养对铜绿微囊藻(蓝藻)、普通小球藻(绿藻)以及两个藻种共存时的化感作用以及可能的作用机理.
1 材料与方法
1.1 材料
实验所用普通小球藻(FACHB-8)、铜绿微囊藻(FACHB-524)购自中国科学院水生生物研究所淡水藻种库.实验所用川蔓藻购自江苏省兴化市龙马水生植物培育有限公司.实验开始前,川蔓藻用无菌蒸馏水清洗3次,去除附着的沉积物和无脊椎动物,然后在实验室内用装有BG11培养基的10L半透明塑料箱悬浮培养7d,每天换1次水,以适应实验室环境.普通小球藻与铜绿微囊藻置于人工气候箱中,光周期12h(L明):12h(D暗),温度(25±2)℃,相对湿度70%,光照强度(6000±200)Lux,用BG11培养基扩大培养,培养基盐度为2‰.每天摇动两次,等待其长到对数生长期且藻类浓度大约至5.5×105cells/mL[17].
1.2 实验方法
实验设为3组,分别是A组:川蔓藻+普通小球藻;B组:川蔓藻+铜绿微囊藻;C组:川蔓藻+普通小球藻和铜绿微囊藻(2种藻按1:1(:)比例配置,简称混合藻).每组实验又分别设置对照组(CK)和处理组(TR),川蔓藻(整株)与浮游藻类共同放置于1L锥形瓶中,川蔓藻所占培养基的比例为2%(/).每组实验设置3个平行.各实验组组成如表1所示.
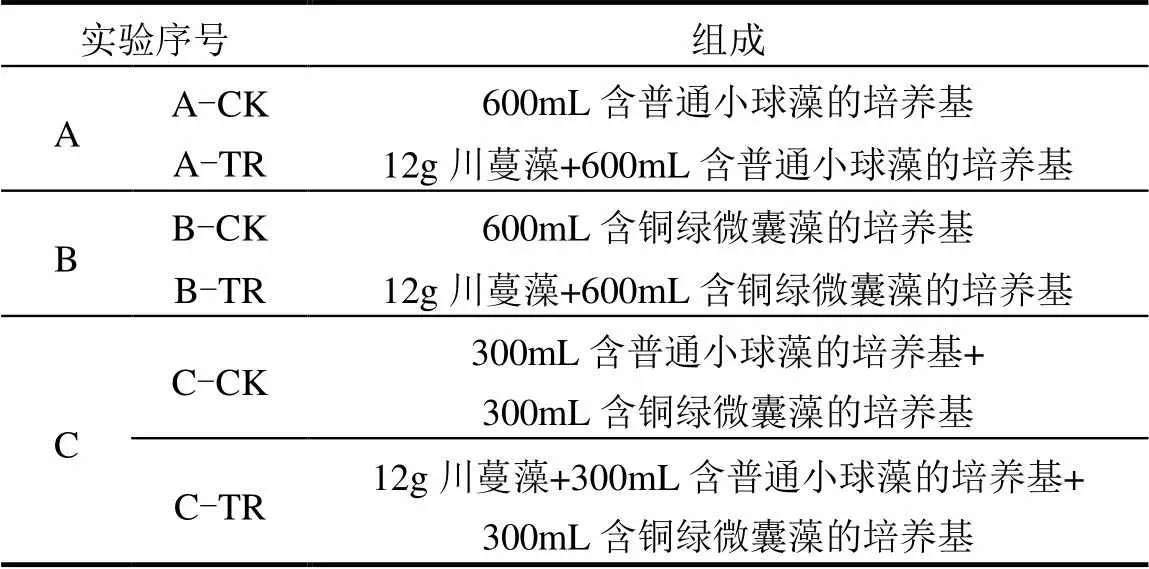
表1 实验组设计
实验在人工气候箱中进行,条件设置与浮游藻类扩大培养阶段一致,连续培养14d.分别在第0,2, 4,6,8,10,12,14d时定时取样30mL测定藻液的各项生理指标.每次取样后向培养瓶中补加30mL的BG11培养基,避免因营养成分缺失对浮游藻类的生长产生影响.
1.3 指标测定及计算
各项生理指标测定方法如表2所示.
光密度值(OD560)代表浮游藻类的生物量,用紫外可见分光光度计560nm处测定吸光度表示.藻类抑制率公式[18]:
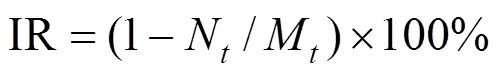
式中:IR为抑制率;N为处理组第d藻细胞OD560值;M为对照组第d藻细胞OD560值.
根据逻辑斯缔方程d/d=(1-/),设定川蔓藻对藻类的效应作用为E,则藻类在川蔓藻共培养作用下的增长模型[19]为:
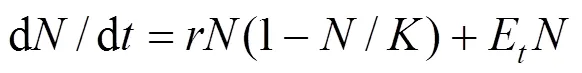
式中:为增长率;为种群大小(光密度);为环境容纳量或负荷量;E为川蔓藻对藻类的化感作用系数.
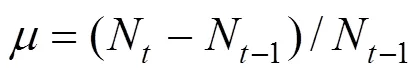
式中:为比增长率.
e表示每一天处理组的与对照组的的差值,E以实验期间所有e的平均数表示[20].
叶绿素含量(Chl-a)是光合速率测定中不可缺少的指标,在光合系统能量的获取和传递中起着重要作用[21].一旦Chl-a的合成被抑制,藻类细胞的繁殖也会被抑制[22].
最大光化学量子产量(v/m)代表浮游藻类光系统Ⅱ(PSⅡ)对激发光能的转换和耗散效率.相对电子传递速率(ETR)反映光合电子的传递速度,电子传递时刻发生在光系统Ⅰ与光系统Ⅱ的物质与能量转换之间,影响着碳水化合物和ATP的合成速率.每个样品取3.5mL放入样品池中暗反应15min后,用水样荧光仪测定v/m和ETR.
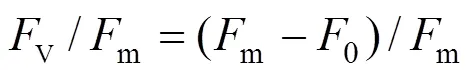
式中:v是暗适应后的最大荧光产量与最小荧光产量的差值;m是暗适应后的最大荧光产量;0是暗适应后的最小荧光产量;ETR值取光响应曲线中的最大值.
可溶性糖(SC)如葡萄糖、蔗糖等,不仅为浮游藻类的生长发育提供能量和代谢中间产物,而且具有信号功能,是浮游藻类生长发育和基因表达的重要调节因子[23].
丙二醛(MDA)是膜脂过氧化的最终产物,可与蛋白质、核酸反应,使纤维素分子间的桥键松弛,或抑制蛋白质的合成,因此可作为细胞及细胞内膜氧化损伤程度的一种重要生物标志物[23-24].

表2 生理指标测试方法
超氧化物歧化酶(SOD)是一种重要的抗氧化酶,能清除藻类细胞内的超氧阴离子自由基O-2,使其转化为H2O2,减少氧自由基对藻类产生的毒害作用.
1.4 数据处理
采用Origin 7.0软件进行数据处理和统计分析,用检验法方差分析检测平均数之间的差异(),以<0.05作为差异的显著性水平.
2 结果与讨论
2.1 川蔓藻对浮游藻类生长的抑制效果
如图1所示,3种情况下,川蔓藻对3种实验藻类都有明显抑制作用.这种抑制作用的发生迅速而强烈,并且存在于藻类的整个生长期.
A组:川蔓藻对普通小球藻的抑制率最高达到85.17%,化感系数平均为-0.189.在整个培养过程中处理组的普通小球藻始终没有出现对数生长期,培养期结束时藻类浓度相对于实验开始时还有所减少.结合之前的研究,培养基盐度为3‰川蔓藻种植密度为5g/L时,第4d抑制率为88.86%[8],而盐度在2‰~3‰之内不会影响川蔓藻和普通小球藻的生长[28-29].
B组:在0~4d对照组浓度在缓慢增加,而处理组在0~2d浓度抑制率为7.45%,在2~6d铜绿微囊藻浓度急剧下降,抑制效应显著(<0.05),培养液迅速变得清澈,抑制率在第6d时达到最大值94.18%.化感系数平均为-0.196.
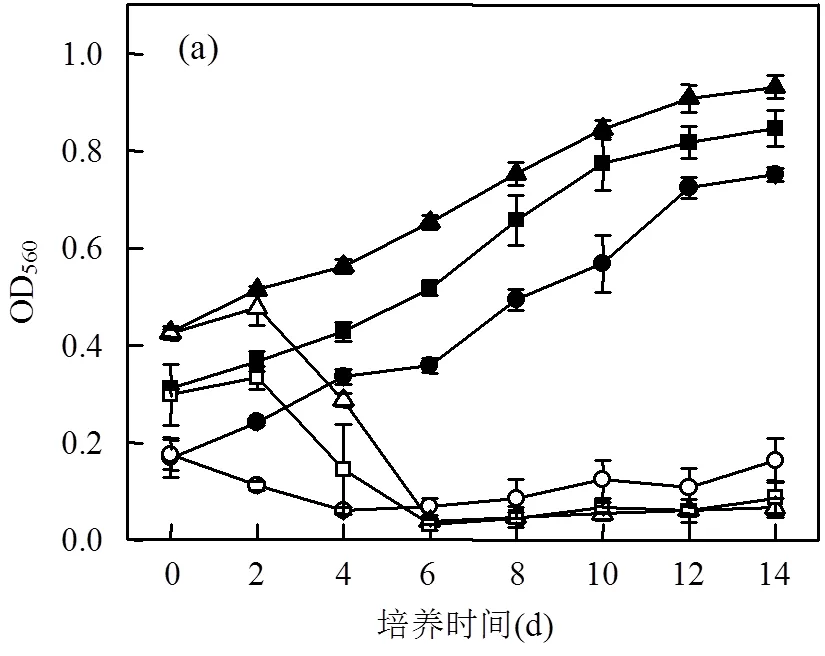
C组:混合藻的生长趋势与铜绿微囊藻类似,抑制率也在第6d时达到最大值94.01%,表明川蔓藻对两种藻类的抑制效果非常显著(<0.05),在培养后期,浮游藻类的数量也没有增加.
对比川蔓藻对普通小球藻和铜绿微囊藻的抑制率以及化感系数可知,川蔓藻对铜绿微囊藻的化感抑制作用强于普通小球藻.
2.2 川蔓藻对浮游藻类Chl-a的抑制效果
如图2所示,3种浮游藻类的处理组Chl-a含量均低于对照组.
A组:对照组Chl-a含量变化呈现了一个完整的“S”型曲线,而处理组在0~2dChl-a含量降低,说明川蔓藻已经抑制了Chl-a的合成;在2~8d也只出现了缓慢的上升趋势,说明此间处理组普通小球藻处于适应阶段;在8~14dChl-a含量,出现大幅增加,相较于对照组川蔓藻的存在使适应期从2d延缓至8d;在第8d之后普通小球藻Chl-a含量逐渐增加,此时普通小球藻的光密度值也有微小的增加(图1(a)),说明叶绿素含量的增加促进了普通小球藻的繁殖,化感抑制作用减弱,也证明了普通小球藻对川蔓藻所产生的化感物质具有一定的适应性.
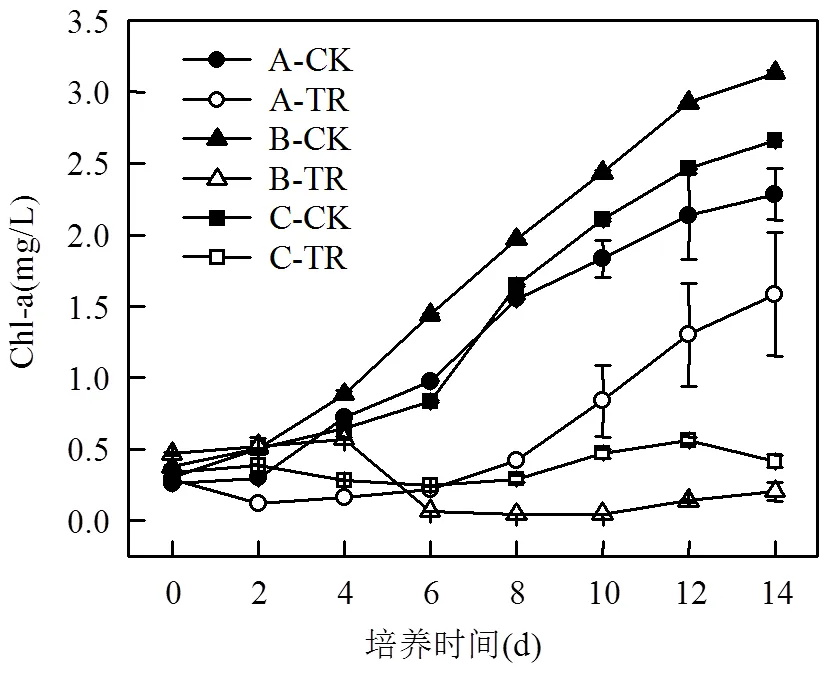
图2 川蔓藻共培养情况下浮游藻类Chl-a含量的变化
B组:对照组Chl-a含量在培养期间增加迅速,而处理组在0~4d几乎没有增加,在4~6d含量迅速下降,表明川蔓藻产生的化感物质对Chl-a有强抑制效应.Chl-a的减少使得铜绿微囊藻不但无法繁殖而且大量死亡,与图1(a)情况相吻合.在6~14dChl-a含量无明显回升,表明川蔓藻对铜绿微囊藻持续化感作用抑制了Chl-a的合成.
C组:处理组Chl-a含量在0~6d小幅度降低,在6~12d小幅度增加,对照组与处理组之间抑制作用差异显著(<0.05),后期的微小回升可能是由于部分普通小球藻出现抗性,从而有了少量的繁殖.
对比3组结果可知,川蔓藻对2种浮游藻类Chl-a的合成均产生了抑制,而铜绿微囊藻光合系统抵御川蔓藻化感抑制的能力小于普通小球藻.叶绿体在光照条件下可以在PSI的还原侧产生活性氧(ROS),ROS对胞内组分有较强的反应能力,可直接破坏Chl-a[30].川蔓藻可能导致浮游藻类细胞内ROS增加,从而降低Chl-a含量.
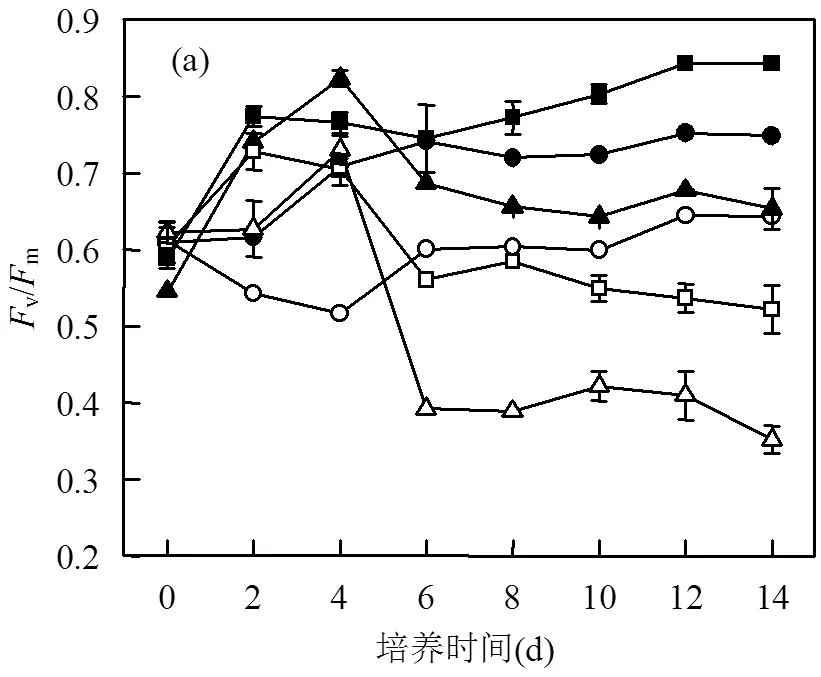
2.3 川蔓藻对浮游藻类Fv/Fm和ETR的抑制效果
v/m值比Chl-a在反应光合能力的变化上具有更高的灵敏度[31],从快速光曲线计算v/m和ETR的变化,如图3(a)所示,各处理组的v/m均低于对照组,说明川蔓藻显著影响了普通小球藻和铜绿微囊藻的PSⅡ的光合转化效率(<0.05).
值得注意的是,图3(b)中,所有处理组在0~2d的ETR在实验期间均高于对照组,峰值分别为52.83, 29.3,52.67μmol/(m2·s).第2d后,处理组中铜绿微囊藻ETR值持续保持降低,且低于对照组.而普通小球藻与混合藻ETR值达到峰值后再降低到一个近恒定值,且始终高于对照组.
浮游藻类细胞光合色素含量降低会减少光抑制效应,使光系统Ⅱ电子传递效率增加,提高光合系统的阳光-生物质能量转换效率[32-33].说明当浮游藻类的PSⅡ系统受到川蔓藻化感物质胁迫时,Chl-a含量降低,但可通过提高光生电子转移速率来维持光合系统的正常运转.最终普通小球藻的光合系统电子转移速率已达到新的平衡,然而铜绿微囊藻组ETR值在4~14d远小于对照组和普通小球藻组,说明铜绿微囊藻的这种抗胁迫作用较普通小球藻弱.
2.4 川蔓藻对浮游藻类SC和MDA的抑制效果
图4中,各处理组的SC含量均低于对照组,说明在川蔓藻所产生的化感物质的胁迫作用下,普通小球藻与铜绿微囊藻的SC合成受到了阻碍,抑制效果显著(<0.05).也从另一方面证实了浮游藻类叶绿素合成受阻,光合作用受到抑制,SC得不到及时的补充.
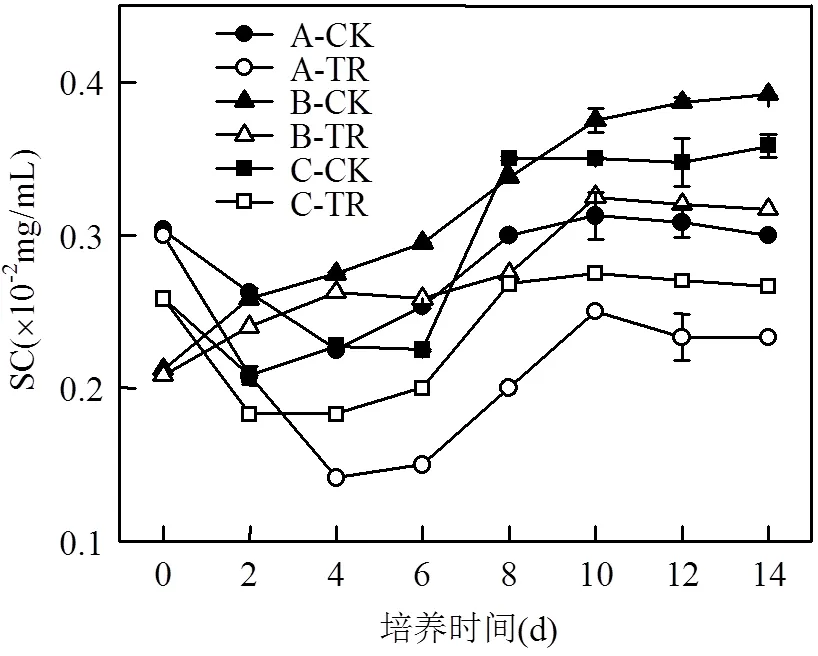
图4 川蔓藻共培养条件下浮游藻类SC含量的变化
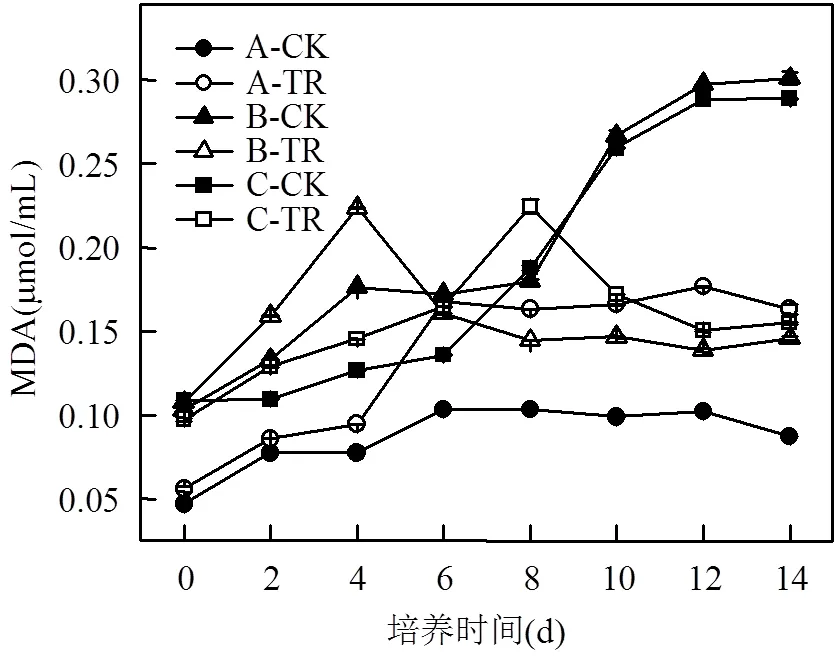
图5 川蔓藻共培养条件下浮游藻类MDA含量的变化
图5中,A组:处理组MDA含量随培养时间显著增加(<0.05),5d后,趋于稳定,MDA最大值为0.1766μmol/mL,超出对照组的2倍;B组:处理组在第4d达到最大值,然后在4~6d急剧减少并保持恒定,表明细胞膜受损促进了铜绿微囊藻的死亡;C组:处理组在0~8d内MDA浓度不断上升,并且高于对照组,说明藻细胞膜破裂程度不断加重,第8d之后,随着普通小球藻数量的稳定,而铜绿微囊藻大量死亡,MDA值也逐渐降低.
王卫红等[34]研究表明,川蔓藻浸提液会使普通小球藻内膜破裂,胞内蛋白核和淀粉核释放,进而使普通小球藻表面疏水性降低,导致藻细胞絮凝沉降死亡.藻类细胞膜是由不饱和磷脂组成的,这些磷脂容易受到ROS的影响[35].据此推测,处理组MDA的增加可能是因为川蔓藻释放的化感物质诱导浮游藻类产生过量ROS,使普通小球藻和铜绿微囊藻中膜脂过氧化,同时对细胞膜的不饱和酸造成伤害.
2.5 川蔓藻对浮游藻类SOD的抑制效果
环境胁迫可增加藻类ROS的产生,导致严重的细胞损伤或死亡.因此,维持适当的ROS水平非常重要[36].SOD作为氧化和抗氧化防御系统中重要的组成成分,其含量变化反映了藻类细胞所受到的环境压力的胁迫程度[37].
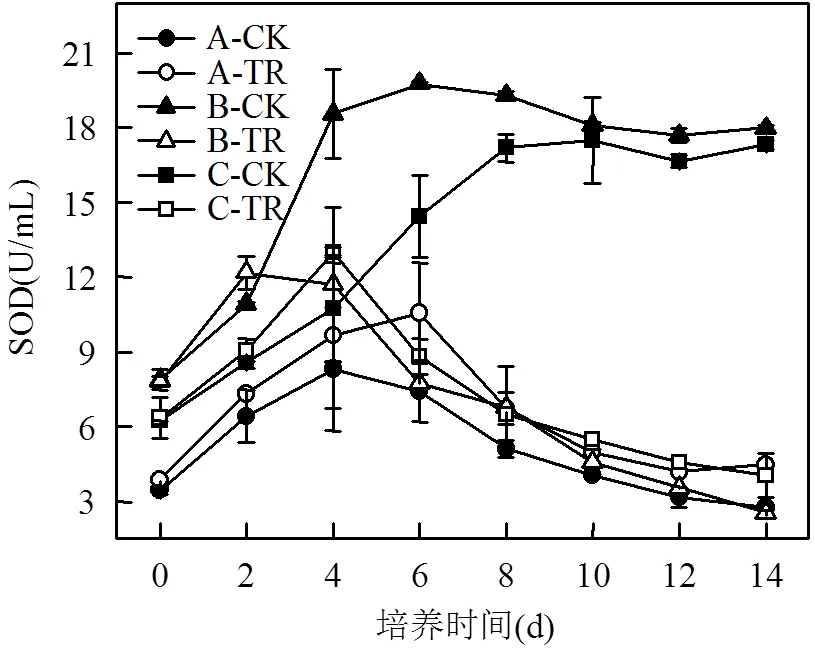
图6 川蔓藻共培养条件下浮游藻类SOD活性的变化
图6中,A组:对照组在0~4dSOD逐渐增加,在适应期内新环境会对普通小球藻造成一定的胁迫,而使活性氧自由基增加,进而促进SOD的产生.在第4d之后普通小球藻适应了新环境,不再需要过多的SOD,SOD含量逐渐减少并趋于稳定.与对照组相比,处理组产生了更多的SOD,两组的差值在第6d时达到顶峰,且处理组SOD含量始终高于对照组,说明川蔓藻的存在对普通小球藻造成了胁迫,并且这种胁迫一直存在.
B组:对照组在0~4d由于对新环境的不适应和浮游藻类的增殖使浮游藻类体内的SOD含量迅速增加,在4~6d增速减缓,铜绿微囊藻进入快速生长期,由图1(a)和图2可知,第6d之后尽管铜绿微囊藻仍处于快速生长期,但SOD的含量在逐渐减少,说明铜绿微囊藻已经不再受到环境的胁迫.
处理组中的SOD含量在第2d时多于对照组,说明铜绿微囊藻不仅受到了新环境的影响,还受到了川蔓藻所产生的化感物质所带来的胁迫.与图1(a)对比可知,铜绿微囊藻在2~6d数量迅速降至最低,只有不到6%的藻存活,而在此期间SOD浓度减少的趋势相对较平缓,说明SOD与铜绿微囊藻数量的比值很大,即每个铜绿微囊藻所产生的SOD仍很多,随着铜绿微囊藻的数量不断减少,SOD的产生也最终趋于平稳.
C组:总体上混合藻的SOD值变化与铜绿微囊藻组类似,但由于普通小球藻的存在,使得SOD变化趋势减缓,含量介于A、B组之间.实验前期处理组SOD含量均高于对照组,说明川蔓藻的存在确实对浮游藻类造成了胁迫,氧化抗氧化系统失去平衡.实验后期,铜绿微囊藻氧化抗氧化系统对新环境适应能力低于普通小球藻,使得对照组SOD含量无法减少,而处理组因为铜绿微囊藻数量减少以致SOD含量同样表现出降低趋势.
总体来看,在4~14d内,3种浮游藻类的处理组SC,MDA和SOD变化趋势均类似,而ETR值表现为普通小球藻处理组显著高于对照组,铜绿微囊藻处理组则低于对照组.可以推测,普通小球藻对川蔓藻化感物质的抗性来源于通过提高光生电子转移速率来维持光合系统的正常运转.
3 结论
3.1 川蔓藻对普通小球藻、铜绿微囊藻以及混合藻抑制率最大值分别为80.95%、94.18%和94.01%.川蔓藻对铜绿微囊藻的抑制作用强于普通小球藻.
3.2 共培养过程中,两种藻活性氧自由基浓度增加,破坏叶绿素,影响光合系统对光能的吸收转化,可溶性糖得不到补充.藻类氧化抗氧化系统失去平衡,生理代谢受到影响,细胞膜过氧化异常,造成细胞无法繁殖甚至死亡.
[1] 张 民,孔繁翔.巢湖富营养化的历程、空间分布与治理策略(1984-2013年) [J]. 湖泊科学, 2015,27(5):791-798. Zhang M, Kong F X. The process, spatial and temporal distributions and mitigation strategies of the eutrophication of Lake Chaohu (1984-2013) [J]. Journal of Lake Sciences, 2015,27(5):791-798.
[2] 李 宁.供水水源藻类控制技术研究 [J]. 绿色科技, 2016,(16): 100-102. Li N. Research on algae control technology of water supply source [J]. Journal of Green Science and Technology, 2016(16):100-102.
[3] Mostafa F, Helling C S. Impact of four pesticides on the growth and metabolic activities of two photosynthetic algae [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes. 2002,37(5):417-444.
[4] 洪桂云,马少雄,王 佳,等.高效铜绿微囊藻溶藻菌WJ6的分离鉴定及溶藻特性[J]. 中国环境科学, 2018,38(11):4269-4275. Hong G Y, Ma S X, Wang J, Zhang J. Isolation and identification of an efficient algicidal bacteria strain and algicidal characteristics on Microcystis aeruginosa [J]. China Environmental Science, 2018,38(11): 4269-4275.
[5] 张维昊,方 涛,徐小清.滇池水华蓝藻中藻毒素光降解的研究[J]. 中国环境科学, 2001,21(1):1-3. Zhang W H, Fang T, Xu X Q. Study on photodegradation of cyanobacterial toxin in blooms of Dianchi Lake [J]. China Environmental Science, 2001,21(1):1-3.
[6] Figueiredo D R, Azeiteiro U M, Esteves S M, et al. Microcystin- producing blooms--a serious global public health issue [J]. Ecotoxicology & Environmental Safety, 2004,59(2):151-163.
[7] Cirés S, Ballot A. A review of the phylogeny, ecology and toxin production of bloom-forming Aphanizomenon spp. and related species within the Nostocales (cyanobacteria) [J]. Harmful Algae, 2016,54:21- 43.
[8] 王卫红,季 民,王苗苗,等.川蔓藻在再生水体中对普通小球藻的化感作用[J]. 湖泊科学, 2007,19(3):321-325. Wang W H, Ji M, Wang M M, et al. Allelopathy ofofin reclaimed wastewater. [J]. Journal of Lake Sciences, 2007,19(3):321-325.
[9] Mohamed Z A. Macrophytes-Cyanobacteria allelopathic interactions and their implications for water resources management − a review [J]. Limnologica - Ecology and Management of Inland Waters, 2017,63: 43-45.
[10] 高云霓,董 静,何 燕,等.基于化感物质释放特性的沉水植物抑藻作用模式研究进展[J]. 水生生物学报, 2016,40(6):1287-1294. Gao Y N, Dong J, He Y, et al. Research advances on the modes of actions for allelopathic algal inhibition by submerged macrophytes based on the release characteristics of allelochemicals [J]. Acta Hydrobiologica Sinica, 2016,40(6):1287-1294.
[11] Wang L, Zi J, Xu R, et al. Allelopathic effects of Microcystis aeruginosa on green algae and a diatom: Evidence from exudates addition and co-culturing [J]. Harmful Algae, 2017,61:56-62.
[12] 薛凌展,黄种持,林 泽,等.铜绿微囊藻和普通小球藻在不同pH下生长特性及竞争参数计算[J]. 福建农业学报, 2010,25(2):142-148.Xue L Z, Huang Z C, Lin Z, et al. Growth and competitiveness ofandat varying pH [J]. Fujian Journal of Agricultural Sciences, 2010,25(2):142-148.
[13] Geddes M C, Deckker P D, Williams W D, et al. On the chemistry and biota of some saline lakes in Western Australia [J]. Springer Netherlands, 1981,1:13-15.
[14] Strazisar T, Koch M S, Madden C J, et al. Salinity effects onL. seed germination and seedling survival at the Everglades- Florida Bay ecotone [J]. Journal of Experimental Marine Biology & Ecology, 2013,445(445):129-139.
[15] 王卫红.川蔓藻对滨海景观再生水河道水质富营养化的控制机制研究[D]. 天津:天津大学环境科学与工程学院, 2006. Wang W H. Inhibition of eutrophication of reclaimed wastewater by Ruppia maritima in coastal scenic watercourse [D]. Tianjin: College of environmental science and engineering, Tianjin university, 2006.
[16] Allen J L, Ten-Hage L, Leflaive J. Regulation of fatty acid production and release in benthic algae: Could parallel allelopathy be explained with plant defence theories? [J]. Microbial Ecology, 2018,75(3):609- 621.
[17] Zuo S, Zhou S, Ye L, et al. Synergistic and antagonistic interactions among five allelochemicals with antialgal effects on bloom-forming[J]. Ecological Engineering, 2016,97:486-492.
[18] 吴 程,常学秀,吴 锋,等.高等水生植物对集胞藻(sp.)的化感作用研究[J]. 云南大学学报:自然科学版, 2008,30(5):535- 540. Wu C, Chang X X, Wu F, et al. Studies on allelopathy of aquatic macrophytes on Synahocystis sp [J]. Journal of Yunnan University, 2008,30(5):535-540.
[19] 陈德辉,刘永定,宋立荣.蓖齿眼子菜对栅藻和微囊藻的他感作用及其参数[J]. 水生生物学报, 2004,28(2):163-168. Chen D H, Liu Y D, Chen L R. The allelopathy of macrophyte potamogeton pectinatus L on chlorophyta () and cyanobacteria () and calculation of allelopathic parameter [J]. Acta Hydrobiologica Sinica, 2004,28(2):163-168.
[20] 陈德辉,刘永定,袁峻峰,等.微囊藻和栅藻共培养实验及其竞争参数的计算[J]. 生态学报, 1999,19(6):908-913. Chen D H, Liu Y D, Yuan J F, et al. Experiments of mixed culture and calculation of competitive parameters between Microcystis () and Scenedesmus () [J]. Acta Ecologica Sinica, 1999,19(6):908-913.
[21] Zhang C, Yi Y L, Hao K, et al. Algicidal activity of Salvia miltiorrhiza Bung on Microcystis aeruginosa-Towards identification of algicidal substance and determination of inhibition mechanism [J]. Chemosphere. 2013;93(6):997-1004.
[22] Ni L, Jie X, Wang P, et al. Effect of linoleic acid sustained-release microspheres on Microcystis aeruginosa antioxidant enzymes activity and microcystins production and release [J]. Chemosphere, 2015, 121:110-116.
[23] 李明军,刘 萍.植物生理学实验技术[M]. 北京:科学出版社, 2007:15-18. Li M J, Liu P. Experimental techniques of plant physiology [M]. Beijing: Science Press, 2007:15-18.
[24] Shao J, Xu Y, Wang Z, et al. Elucidating the toxicity targets of β- ionone on photosynthetic system of Microcystis aeruginosa NIES-843 () [J]. Aquatic Toxicology, 201,104(1/2):48.
[25] 郝再彬.植物生理实验[M]. 哈尔滨:哈尔滨工业大学出版社, 2006:30-50. Hao Z B. Plant physiology experiments [M]. Harbin: Harbin Institute of Technology Press, 2006:30-50.
[26] Qian H, Xu J, Lu T, et al. Responses of unicellular alga Chlorella pyrenoidosa to allelochemical linoleic acid [J]. Science of the Total Environment, 2018,625:1415-1422.
[27] 徐 东,赵 建,黄汉昌,等.改良的黄嘌呤氧化酶法测定动植物组织中SOD比活力[J]. 食品科学, 2011,32(6):237-241. Xu D, Zhao J, Huang H C, et al. Determination of SOD specific activity in animal and plant tissues by improved xanthine oxidase method [J]. Food Science, 2011,32(6):237-241.
[28] 张 奇,曹英昆,邢泽宇,等.pH、盐度对小球藻生长量和溶氧量的影响[J]. 湖北农业科学, 2018,57(11):83-86. Zhang Q, Cao Y K, Xin Z Y, et al. Effects of pH and salinity on growth and dissolution of Chlorella vlgaris [J]. Hubei Agricultural Sciences, 2018,57(11):83-86.
[29] 王卫红,季 民,薛玉伟.川蔓藻和蓖齿眼子菜对再生水中盐度的响应机制[J]. 天津大学学报, 2007,(7):804-810. Wang W H, Ji M, Xue Y W. Response mechanism of Ruppia Maritima and Potamogeton Pectinatus to salinity in reclaimed wastewater [J]. Journal of Tianjin University, 2007,(7):804-810.
[30] Eullaffroy P, Vernet G. The F684/F735chlorophyll fluorescence ratio: a potential tool for rapid detection and determination of herbicide phytotoxicity in algae [J]. Water Research, 2003,37(9):1983-1989.
[31] Wang R, Hua M, Yu Y, et al. Evaluating the effects of allelochemical ferulic acid onby pulse-amplitude-modulated (PAM) fluorometry and flow cytometry [J]. Chemosphere, 2016,147: 264-271.
[32] 周振翔,李志康,陈 颖,等.叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响[J]. 中国农业科学, 2016,49(19):3709-3720. Zhou Z X, Li Z K, Chen Y, et al. Effects of reduced chlorophyll content on photoinhibition and photosynthetic electron transport in rice leaves [J]. Scientia Agricultura Sinica, 2016,49(19):3709-3720.
[33] Nakajima Y, Itayama T. Analysis of photosynthetic productivity of microalgal mass cultures [J]. Journal of Applied Phycology, 2003, 15(6):497-505.
[34] 王卫红,季 民,张 楠,等.川蔓藻水浸提液的克藻效应与机理[J]. 天津大学学报, 2006,(12):1417-1421. Wang W H, Ji M, Zhang N, Wang M M. Allelopathy and mechanism of extracts from Ruppia maritima on Chlorella Vulgaris [J]. Journal of Tianjin University, 2006(12):1417-1421.
[35] Wang C, Wang X, Wang P, et al. Effects of iron on growth, antioxidant enzyme activity, bound extracellular polymeric substances and microcystin production of Microcystis aeruginosa FACHB-905 [J]. Ecotoxicology and Environmental Safety, 2016,132:231-239.
[36] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction [J]. Annual Review of Plant Biology, 2004, 55(x):373-399.
[37] Guo Y, Liu Y, Zeng G, et al. A restoration-promoting integrated floating bed and its experimental performance in eutrophication remediation [J]. Journal of Environmental Sciences, 2014,26(5):1090- 1098.
Allelopathic effect ofonand
ZHANG Xin1,2,3, LU Xue-qiang1,2,3*, WANG Lan1,2, HAN Xiao-xin1,2, MAO Hai-yan4
(1.College of Environmental Science and Engineering, Nankai University, Tianjin 300350, China;2.Tianjin Key Laboratory of Environmental Technology for Complex Trans-Media Pollution, Nankai University, Tianjin 300350, China;3.Tianjin International Joint Research Center for Environmental Biogeochemical Technology, Nankai University, Tianjin 300350, China;4.Xiamen Ocean Rock Ecology & Environment Co., Ltd, Xiamen 361023, China)., 2019,39(4):1589~1595
One submerged macrophyte () and two algae (and) were selected to test the allelopathic effect of submerged macrophyte on algae. The parameters including optical density, chlorophyll a, maximum photochemical quantum yield, relative electron transport rate, soluble sugar, malondialdehyde, and superoxide dismutase activity were measured for three co-culture treatments of+,+, and+ mixture ofand(:=1:1). The growth of,and mixed algae were rapidly and greatly inhibited with the presence of. The inhibition rates in the three treatments reached the maximums on the 6th day, which were 80.95%, 94.18% and 94.01%, respectively. The values of optical density, chlorophyll a, soluble sugar and maximum photochemical quantum yield for the three treatments were lower than those for the corresponding controls, and showed a significantly downward trend with time, indicating that the photosynthetic capacity of the treatments became weakening gradually. However, the values of malondialdehyde and superoxide dismutase of the treatments were higher than those of the corresponding controls for the first six days, indicating the possible occurrence of the membrane peroxidation of the algae.
;;;allelopathic effect
X524
A
1000-6923(2019)04-1589-07
2018-09-21
水体污染控制与治理科技重大专项(2018ZX07110-007);天津市科技计划项目(18PTZWHZ00110)
*责任作者, 教授, Luxq@nankai.edu.cn
张 欣(1995-),女,山西长治人,南开大学硕士研究生,主要从事水生态修复原理与技术研究.
