不同碳源对Delftia tsuruhatensis HT01脱氮性能的影响
2019-04-28金翠萍
金翠萍,向 斯,郭 溪,程 凯*
不同碳源对HT01脱氮性能的影响
金翠萍1,向 斯2,郭 溪2,程 凯1*
(1.湖北工业大学资源与环境工程学院,河湖生态修复及藻类利用湖北省重点实验室,湖北 武汉 430068;2.武汉凯诺金环境生物科技有限公司,湖北 武汉 430068)
以一株异养氨氧化菌HT01为研究对象,比较了以十二烷基硫酸钠(SDS)、甘蔗糖蜜、丁二酸钠、乙酸钠、蔗糖、葡萄糖、果糖或柠檬酸钠等为唯一碳源时的生长情况及对TOC、NH4+-N、TN的去除率,并通过两轮中试测试了该菌对皮革污水的处理效果.结果表明:HT01在异养条件下能够生成NO2--N,并可以在利用SDS(去除率为34%)的同时去除NH4+-N和TN(去除率分别为74%和14%);丁二酸钠和乙酸钠分别有利于实现最快的生长速度和最高的TOC去除率(71%),而果糖则有利于实现最高的NH4+-N和TN去除率(分别为98%和29%). HT01能够在皮革污水中生长,第2轮中试对COD,NH4+-N和TN的去除率分别达到38%,49%和22%.
HT01;十二烷基硫酸钠;异养氨氧化;皮革污水
传统生物脱氮技术首先需要在好氧条件下经自养硝化菌将NH4+-N氧化为NO2--N或NO3--N,再于厌缺氧条件下经异养反硝化菌还原生成含氮气体[1].而异养氨氧化-好氧反硝化菌则突破了上述理论限制,该类微生物可以在异养好氧条件下同时实现氨氧化和反硝化,并同步去除有机物[2-5],因此能够极大简化微生物脱氮工艺,具有重要的应用价值.考虑到异养氨化-好氧反硝化菌的异养生长特性,碳源种类对这类微生物的脱氮效果有着显著影响[6-12].
以十二烷基硫酸钠(SDS)为代表的阴离子表面活性剂,是工业及生活洗涤剂的核心成分,由于其具有高起泡性及低氧化电位,会通过影响污水处理过程中微生物的活性而降低污水处理效率[13-15],甚至会降低受纳水体的溶解氧(DO)量乃至毒害水生生物[13-15].微生物降解SDS具有特异性高、成本低和副作用少的优点,国外虽已报道了多株以假单胞菌为主的SDS降解菌[16-19],但目前国内对于SDS降解菌的报道还非常罕见[20-21],能够同步去除SDS、NH4+-N与总氮(TN)的菌种更是尚未见诸报道.
戴尔福特菌(sp.)广泛分布于自然界,在地表水、土壤、污水中均有分布,并具有降解多种环境污染物的能力,有关其去除TN能力的研究较多[22-29],也有零星报道指出部分该属菌株能够异养氨氧化[30-31],而对这类菌降解(利用)SDS的能力知之甚少,对不同碳源影响戴尔福特菌异养氨氧化-好氧反硝化能力的研究也较少.为此,本文探索了一株戴尔福特菌对SDS的去除能力,还研究了不同碳源对该菌株脱氮能力的影响并进行了皮革污水处理的中试,为应用戴尔福特菌进行污水处理提供参考.
1 材料与方法
1.1 培养基
基础培养基:MgSO4×7H2O 0.05g,K2HPO41g, NaCl 2g,FeSO4×7H2O 0.4g,NaHCO31.5g,CaCl2×2H2O 0.5g;微量元素溶液1mL;加纯水至1L[32].微量元素溶液:CuSO4×/5H2O 0.075g, ZnSO4×7H2O 0.3g, CoCl2×6H2O 0.375g,MnCl2×2H2O 0.3g,EDTA 0.5g, NaMoO4×2H2O 0.22g, H3BO40.014g;加纯水至1L.SDS碳源培养基:在基础培养基中添加0.4g/L NH4Cl作为唯一氮源,再添加2g/L SDS作为唯一碳源.常规碳源培养基:在基础培养基中添加0.4g/L NH4Cl作为唯一氮源,再分别添加2g/L蔗糖、葡萄糖、果糖、柠檬酸钠、丁二酸钠、甘蔗糖蜜或乙酸钠作为唯一碳源.
1.2 接种菌液的制备
HT01[33]分离于垃圾渗滤液污水处理系统.为制备接种液,先将该菌种接种于添加了0.4g/L NH4Cl和2g/L乙酸钠的基础培养基中,于27℃,190r/min振荡培养至对数期,再将菌悬液于6000r/min离心10min,弃上清液,用基础培养基离心洗涤3次,并用基础培养基重悬菌体,于27℃, 190r/min振荡饥饿处理1d后,作为接种菌液.
1.3 不同碳源对生长及脱氮性能的影响
按5%的接种比例,将接种菌液分别接种至120mL不同碳源的培养基中,以此作为实验组,相应的不接种菌液的培养基作为对照组.实验组与对照组均设置3个平行,并置于27℃,190r/min振荡培养箱中培养.
每隔8h取样,测量菌悬液的吸光值OD600(以指示其生长情况)、TN和TOC.另将菌悬液6000r/min离心10min,取上清液用0.22μm针头过滤器过滤,测定透过液中NH4+-N、NO2--N及NO3--N含量.
NH4+-N含量采用水杨酸法[34], NO2--N和NO3--N的测量分别采用N-(1-萘基)-乙二胺光度法和硫酸肼还原法[34]. TN和TOC含量采用德国Elementar vario TOC/TN测定仪完成.
1.4 菌株SDS降解转录激活酶基因系统发育树
根据HT01的全基因组测序结果,发现该菌具有SDS降解转录激活酶基因[35],将测序结果在NCBI中进行Blastn序列比对[https:// blast.ncbi.nlm.nih.gov/Blast.cgi],并采用Neighbor- Joining法(Mega 6)构建了该基因的系统发育树.
1.5 菌株处理皮革污水中试
采用的皮革污水由于盐度较高(约20000mg/L)而不适于自养氨氧化菌的生长,实验期间污水的COD与NH4+-N含量的波动范围分别为4350~ 5355, 687~768mg/L.实验分2轮进行,第1轮实验中,实验组为向1t污水中接种3.5L以乙酸钠为唯一碳源的对数期HT01菌液,同时向污水中加入1.4kg乙酸钠,并在通气培养至第3,4, 5,6d时各补加1.4kg乙酸钠,继续培养至第7d.对照组为未加入菌液(但按照与实验组相同的剂量补加了乙酸钠),空白组则既不加菌液,也不加乙酸钠.试验期间的水温为21~23℃,DO为3.22~5.59mg/L,pH值为7.8~8.0.
为模拟污水序批处理的效果,又开展了第2轮试验:取第2轮培养至第7d的实验组污水0.5t,加入0.5t未经处理的污水,同时加入1.4kg乙酸钠,并在培养至第2d时补加乙酸钠1.4kg,继续培养至第3d.对照组与空白组的设置及试验过程中的水温、DO及pH值的变化均与第1轮试验相同.
1.6 统计分析
采用Origin7.5作图,图中的误差线均用SD表示.统计分析采用SPSS17.0,显著水平以< 0.05计.
2 结果分析
2.1 以SDS为唯一碳源时的生长与脱氮性能
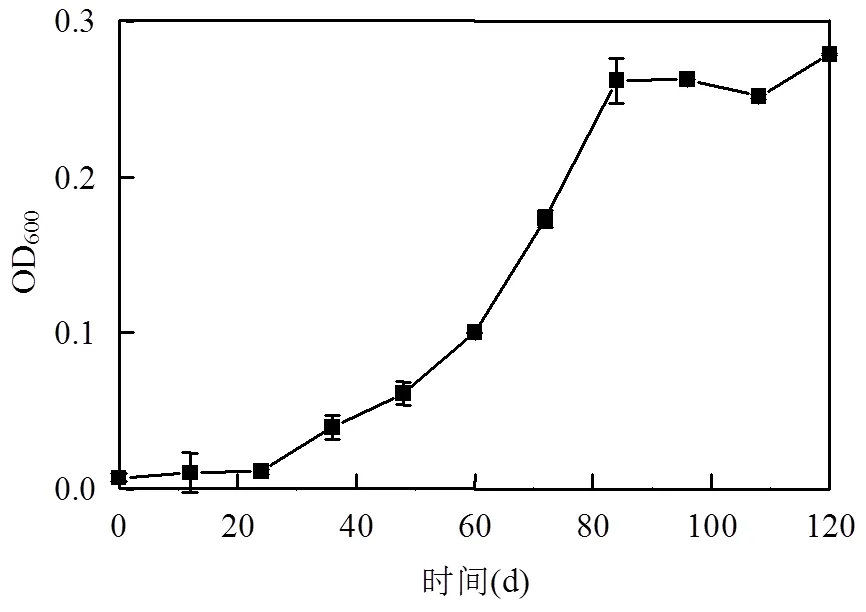
图1 SDS为碳源的培养基中的生长曲线
HT01能够在以SDS为唯一碳源的培养基中生长,其对数生长期从24h开始,至84h达到稳定期时(图1),其最大OD600接近0.3,TOC去除率达到33.94%,说明细菌具有利用SDS生长并去除SDS的能力.与此同时,NH4+-N和TN的去除率分别达到了73.73%和13.95%,说明该菌能够同时利用SDS并高效脱氮和去除TN.
HT01菌株的SDS降解转录激活酶基因的系统发育树如图2所示.可见HT01菌株的SDS降解转录激活酶基因与其它的同类基因的同源性较高,而与其它菌种的同类基因的差异较大.

图2 HT01菌株SDS降解转录激活酶基因的系统发育树
2.2 菌株在常规碳源中的生长及碳源利用情况
HT01在7种常规碳源中的生长量(图3)均明显高于以SDS为唯一碳源时生长量,但该菌株在这7种常规碳源中的生长曲线仍明显不同:以丁二酸钠为唯一碳源时,接种8h后即表现出了明显生长,16h时就达到稳定期,OD600最大为0.81;而以乙酸钠或柠檬酸钠为唯一碳源时,8h起进入对数期,至24h进入稳定期,OD600最大值分别为0.89, 0.75;当以蔗糖、果糖和甘蔗糖蜜为唯一碳源时,虽然晚至24h时才进入对数期,但却具有最大的生物量,其OD600最大分别能达到1.21,1.08和1.13;而当以葡萄糖为唯一碳源时,延迟期长至48h,最大生物量时的OD600也达到了0.95.
HT01在利用7种常规碳源生长的过程中,培养基中的TOC浓度也明显下降(图4),至稳定期时,以蔗糖、葡萄糖、果糖、柠檬酸钠、丁二酸钠、甘蔗糖蜜或乙酸钠为唯一碳源时的TOC去除率分别为54.87%(64h),59.77%(80h),62.49%(64h), 47.29% (32h),26.49%(24h),38.34%(48h),70.92%(32h).特别是,以乙酸钠为唯一碳源时的TOC去除率显著高于其它碳源(<0.05),说明碳源种类明显影响了TOC去除率.此外,以蔗糖、果糖或甘蔗糖蜜为唯一碳源时的TOC去除率也较高,此现象与这3种碳源条件下该菌的生物量(以OD600计)较大的结果是吻合的.

图3 不同常规碳源中的生长曲线
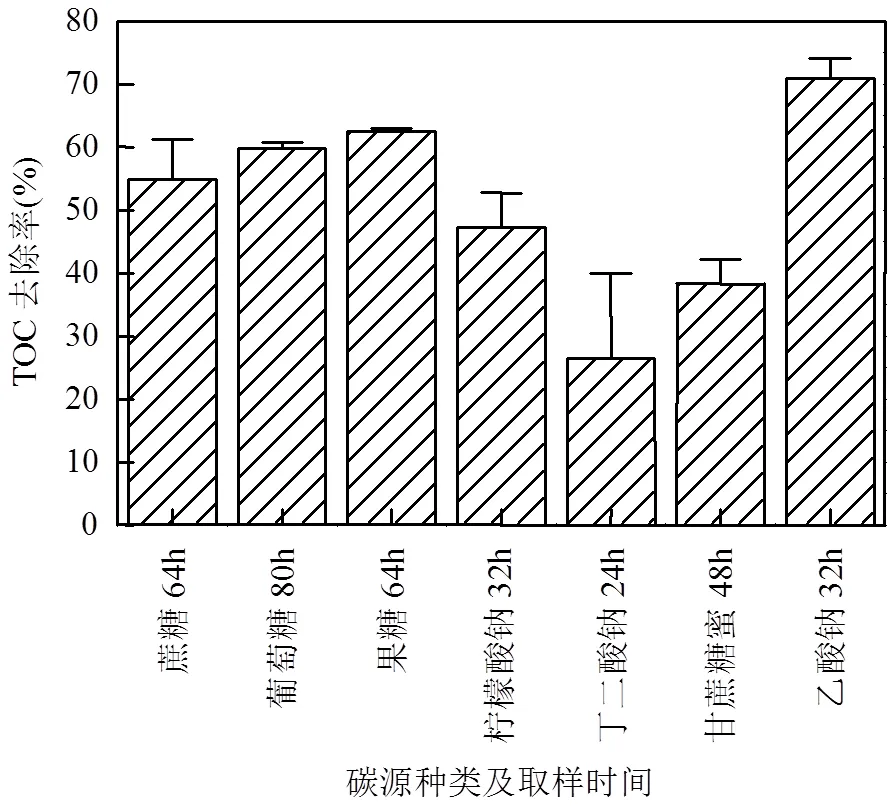
图4 不同常规碳源条件下的TOC去除率
此外,为了验证该菌的异养氨氧化性能,选取以乙酸钠为唯一碳源时的组别,测量了24h时(生物量峰值)的NO3--N与NO2--N含量.结果发现, NO3--N含量无法检出,而NO2--N含量则达到(64±33)μg/L,考虑到培养基中的本底NO2--N含量低于3μg/L(N-(1-萘基)-乙二胺光度法检测下限),说明HT01能够异养氨氧化生成NO2--N.
2.3 菌株在常规碳源中的脱氮性能
随着细菌的生长,HT01也表现出明显的脱氨和脱总氮性能.由图5可见,当达到稳定期时:以果糖为唯一碳源时的NH4+-N去除率最高,达到了97.79%,相应的TN去除率也达到了28.58%;以葡萄糖为碳源时, NH4+-N去除率也高达89.62%,但TN去除率仅为10.19%;以蔗糖为碳源时, NH4+- N和TN的去除率分别为75.25%和22.19%;以乙酸钠为唯一碳源时的NH4+-N去除率虽然高达70%,但其TN去除率却仅为约10%;以柠檬酸钠、丁二酸钠或甘蔗糖蜜为唯一碳源时,NH4+-N去除率约为60%,且以丁二酸钠为碳源时的TN去除率较高达到28.54%,而在以柠檬酸钠为碳源时则完全不能去除TN.进一步统计分析表明,NH4+-N的去除率与测量时的培养时长显著正相关(<0.05,2=0.67),而与对数期时长无显著相关性(>0.05),说明培养时长是影响NH4+-N去除率的主要因素.而TN去除率与培养时长及对数期时长等均无显著相关(>0.05),说明该菌的反硝化脱氮性能与生长的关系较弱.

图5 不同常规碳源条件下的NH4+-N和TN去除率
2.4 皮革污水处理结果
由图6可见,接种HT01并补充碳源(乙酸钠)后,污水中NH4+-N和COD的去除率均显著高于对照组与空白组(<0.05),至第1轮试验结束时(第7d),试验组的NH4+-N和COD去除率分别达到47%和79%,而对照组的去除率则分别为28%和49%,空白组的去除率更是仅为15%和36%,说明HT01明显促进了皮革污水中NH4+-N与COD的同步去除.
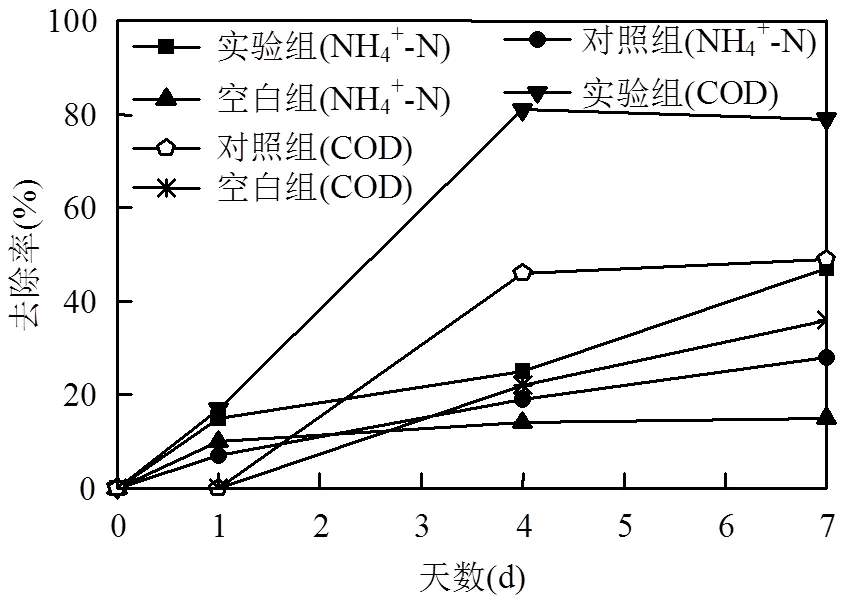
图6 第1轮中试的NH4+-N和COD去除率
与第1轮试验的结果类似,第2轮试验中(图7),试验组的NH4+-N和COD的去除率也显著高于对照组与空白组(<0.05).

图7 第2轮中试的NH4+-N和COD去除率
对比2轮污水处理中试,第2轮中试至第3d时,试验组的NH4+-N去除率即达到了49%,甚至高于第1轮中试时第7d时的NH4+-N去除率(47%).由于第1轮中试时HT01的接种量仅为0.35%,而第2轮中试的换水率为50%,说明HT01能够在第1轮的试验中持续生长,并积累了更多的生物量,所以在第2轮试验中才表现出了更快的脱氮速度.此外,2轮中试终点时,试验组的TN去除率(平均为22%)也明显高于对照组和空白组(平均为11%),也说明该菌在本次中试中能够去除皮革污水中的部分TN.
3 讨论
目前国内关于SDS降解菌的分离报道较少[20-21],国外虽分离得到了较多的SDS降解菌[36],但这些菌多属于sp.和sp.,仅Yilmaz等[14]从地表水体中筛选出一株具有降解SDS能力的,但目前尚未有降解去除SDS的报道.SDS降解转录激活酶基因的进化分析表明,尽管Genbank中的部分菌的某些基因与本菌的SDS降解转录激活酶基因同源性极高,但这些基因却并未被注释为SDS降解转录激活酶基因,这些菌的SDS降解活性也均未见诸报道,说明菌的SDS降解活性很可能被低估了.考虑到多来源于污水[24-28],具有较强的耐污性能,因此其在污水处理中的应用潜力也更大.此外,Paulo等[13]分离出的2株sp.能够以NO3--N为唯一氮源,实现同步去除SDS和反硝化,而本研究则首次发现HT01能够以NH4+-N为唯一氮源,实现同步去除SDS、NH4+-N和TN,为污水中SDS的降解及脱氮提供了新的思路.
有关异养氨氧化性能的研究报道较少,不同碳源对去除NH4+-N和TN影响的研究屈指可数,仅刘晶晶等[22]比较了柠檬酸三钠、乙酸钠和琥珀酸钠对好氧反硝化性能的影响,发现柠檬酸三钠为最优的反硝化碳源.此外,王欢等[25,27]研究发现sp. WXZ-1以柠檬酸三钠为碳源时的NH4+-N去除率为55%,略低于HT01在柠檬酸钠中的NH4+-N去除率(59.43%).匡燕[31]等定性描述了对葡萄糖、碳源、蔗糖等碳源有利用能力,但没有细致研究菌株在不同碳源中的生长特点.Li等[28]仅以丁二酸钠为碳源对HS-043开展了好氧反硝化性能研究.崔文娟等[37]仅以酵母粉作为sp. NS2和NS5硝化过程中的碳源,最大生物量OD600均在0.45左右,明显低于本研究中HT01在各种常规碳源中的生物量.此外,类似于[31]和WXZ-15[25]的异养氨氧化过程,HT01也能在以乙酸钠为碳源时积累少量的NO2--N,既证明了HT01具有异养氨氧化能力,也说明该菌异养氨氧化的产物可以被好氧反硝化所迅速消耗[38].
本研究发现,HT01能利用多种形式的碳源,但不同碳源对该菌的生长及脱氮性能影响较大,综合考虑到实际污水处理的成本与耗时,如仅以去除NH4+-N为目标,应选择乙酸钠作为碳源,但如以去除TN为目标,则应以蔗糖(或果糖)作为碳源.因此在本次处理皮革污水的中试研究中,以NH4+-N为主要目标污染物,补加乙酸钠作为碳源,不但能够有效去除NH4+-N,而且(通过第2轮序批式中试)证明该菌能够适应高盐度的皮革污水并能够积累生物量,说明在实际应用该菌种处理皮革污水时,初期只需少量接种,即可在皮革污水中自行增殖,再通过污泥回流等方式即可使生物量不断积累,从而达到增效的目的.此外,HT01分离于垃圾渗沥液,考虑到垃圾渗沥液具有高盐、高氨、高COD的特征[39-41]与皮革污水[42-44]高度相似,很可能是该菌能够适应并有效处理皮革污水的主要原因.
4 结论
4.1HT01能够通过异养氨氧化积累少量的NO2--N,还能够同步去除SDS、NH4+-N及TN.
4.2 碳源种类明显影响HT01的生长与脱氮能力,以丁二酸钠为碳源时的生长速度最快,以乙酸钠为碳源时的TOC去除率最高,以果糖为碳源时的NH4+-N和TN去除率最高.
4.3HT01能够适应高盐皮革污水,并有效去除其COD、NH4+-N及TN.
[1] 叶剑锋.废水生物脱氮处理新技术[M]. 北京:化学工业出版社, 2006:10-12. Ye J F. New technology for biological denitrification of wastewater [M]. Beijing: Chemical Industry Press: 2006:10-12.
[2] 乔 森,刘雪洁,周集体.异养硝化-好氧反硝化在生物脱氮方面的研究进展[J]. 安全与环境学报, 2014,14(2):128-135.Qiao S, Liu X J, Zhou J T. Research progress of heterotrophic nitrification-aerobic denitrification in biological denitrification [J]. Journal of Safety and Environment, 2014,14(2):128-135.
[3] 林 燕,孔海南,王茸影,等.异养硝化作用的主要特点及其研究动向[J]. 环境科学, 2008,29(11):3291-3296.Lin Y, Kong H N, Wang R Y, et al. Characteristic and prospects of heterotrophic nitrification [J]. Environmental science, 2008,29(11): 3291-3296.
[4] 苟 莎,黄 钧.异养硝化细菌脱氮特性及研究进展[J]. 微生物学通报, 2009,36(2):255-260.Gou S, Huang J. Advances in denitrification characteristics of heterotrophic nitrification bacteria [J]. Microbiology, 2009,36(2):255- 260.
[5] Kim J K, Park K J, Cho K S, et al. Aerobic nitrification-denitrification by heterotrophicstrains [J]. Bioresource Technology, 2005, 96(17):1897-1906.
[6] 邹艳艳,张 宇,李明智,等.一株异养硝化-好氧反硝化细菌的分离鉴定及脱氮活性研究[J]. 中国环境科学, 2016,36(3):887-893.Zou Y Y, Zhang Y, Li M Z, et al. Isolation and identification of a heterotrophic nitrification-aerobic denitrification bacterium and its denitrification ability [J]. China Environmental Science, 2016,36(3): 887-893.
[7] 王骁静,于德爽,李 津,等.海洋异养硝化-好氧反硝化菌y6同步脱氮除碳特性[J]. 中国环境科学, 2017,37(2):686-695.Wang X J, Yu D S, LI J, et al. Separation identification and the characteristics research of simultaneous removal of nitrogen and carbon about Marine heterotrophic nitrification and aerobic denitrification strain y6 [J]. China Environmental Science, 2017,37(2):686-695.
[8] Duan J M, Fang H D, Su B, et al. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater [J]. Bioresource Technology, 2015,179(3):421-428.
[9] 张树松,樊月婷,孙兴滨,等.菌株SL-205的反硝化特性 [J]. 中国环境科学, 2017,37(9):3532-3539.Zhang S S, Fan Y T, Sun X B, et al. Denitrification performance of the bacteriumSL-205 [J]. China Environmental Science, 2017,37(9):3532-3539.
[10] Lei Y, Wang Y Q, Liu H J, et al. A novel heterotrophic nitrifying and aerobic denitrifying bacterium,DN-7, can remove high-strength ammonium [J]. Applied Microbiology Biotechnology, 2016,100(9):4219-4229.
[11] Yang L, Ren Y X, Zhao S Q, et al. Isolation and characterization of three heterotrophic nitrifying-aerobic denitrifying bacteria from a sequencing batch reactor [J]. Annals of Microbiology, 2016,66(2):737-747.
[12] Chen Q, Ni J R. Ammonium removal bysp. LAD9capable of heterotrophic nitrification-aerobic denitrification [J]. Journal of Bioscience and Bioengineering, 2012,113(5):619-623.
[13] Paulo A M S, Plugge C M, García-encina P A, et al. Anaerobic degradation of sodium dodecyl sulfate (SDS) by denitrifying bacteria [J]. International Biodeterioration and Biodegradation, 2013,84(5):14-20.
[14] Yilmaz F, Icgen B. Characterization of SDS-degradingand in situmonitoring of its temporal succession in SDS- contaminated surface waters [J]. Environmental Science & Pollution Research International, 2014,21(12):7413-7424.
[15] 郑琰晶,陈 琳,陈燕平,等.十二烷基硫酸钠对水生生物的急性毒性影响[J]. 农业环境科学学报, 2006,25(增刊):496-498.Zheng Y J, Chen L, Chen Y P, et al. Acute toxicity of sodium dodecyl sulfate (SDS) on selected aquatic organisms [J]. Journal of Agro- Envionment Science, 2006,25(Supplements):496-498.
[16] Furmanczyk E M, Kaminski M A, Spolnik G, et al. Isolation and characterization ofspp. strains that efficiently decompose sodium dodecyl sulfate [J]. Frontiers in Microbiology, 2017,8:1-16.
[17] John E M, Rebello S, Asok A K, et al.S5, a novel nonpathogenic isolate for sodium dodecyl sulfate degradation [J]. Environmental Chemistry Letters, 2015,13(1):117-123.
[18] Rahman M F, Rusnam M, Gusmanizar N, et al. Molybdate-reducing and SDS-degradingsp. strain Neni-13 [J]. Nova Biotechnologica et Chimica, 2016,15(2):166-181.
[19] Masdor N. Isolation and characterization of a molybdenum-reducing and SDS-degradingstrain Aft-7and its bioremediation application in the environment [J]. Biodiversitas, 2015,16(2):238-246.
[20] 关向杰,杨海君,黄水娥,等.一株耐铬不动杆菌对十二烷基硫酸钠的降解特性[J]. 环境工程学报, 2014,8(5):2117-2123.Guan X J, Yang H J, Huang S E, et al. Degradation characteristics of sodium dodecyl sulfate by a chromium resistantStrain [J]. Chinese Journal of Environmental Engineering, 2014,8(5):2117- 2123.
[21] 颜丙花,杨海君,罗 琳,等.十二烷基硫酸钠降解菌的分离鉴定及其降解能力[J]. 化工环保, 2011,31(2):110-113.Yan B H, Yang H J, Luo L, et al. Isolation, identification of SDS- degrading strain and its degrading capability [J]. Environmental Protection of Chemical Industry, 2011,31(2):110-113.
[22] 刘晶晶,汪 苹.一株好氧反硝化菌的反硝化性能研究[J]. 北京工商大学学报(自然科学版), 2008,26(4):5-8.Liu J J, Wang P. Study on denitrification characteristic of an aerobic denitrifier [J]. Journal of Beijing Technology and Business University (Natural Science Edition), 2008,26(4):8-11.
[23] 叶杰旭,林彤晖,骆煜昊,等.1株氯苯高效降解菌的分离鉴定及降解特性[J]. 环境科学, 2017,38(2):802-808.Ye J X, Lin T H, Luo Y H, et al. Isolation and identification of a chlorobenzene-degrading bacterium and its degradation characteristic [J]. Environmental Science, 2017,38(2):802-808.
[24] 金德才,吴学玲,梁任星,等.一株DMP降解菌的分离鉴定及其降解特性[J]. 微生物学通报, 2009,36(9):1318-1323.Jin D C, Wu X L, Liang R X, et al. Isolation, identification and degradation characteristics of a DMP-degrading strain [J]. Microbiology, 2009,36(9):1318-1323.
[25] 王 欢,汪 苹,张海波.一株戴尔福特菌的异养硝化与好氧反硝化性能研究[J]. 北京工商大学学报(自然科学版), 2008,26(2):1-5.Wang H, Wang P, Zhang H B. Characteristics of heterotrophic nitrification and aerobic denitrification by[J]. Journal of Beijing Technology and Business University (Natural Science Edition), 2008,26(2):1-5.
[26] 王 娟,汪 苹,项慕飞,等.2株好氧反硝化菌还原能力测定及菌种鉴定[J]. 环境与健康杂志, 2008,25(6):525-529.Wang J, Wang P, Xiang M F, et al. Study on reducing capacity and identification of aerobic denitrifiers [J]. Journal of Environment and Health, 2008,25(6):525-529.
[27] 王 欢,汪 苹,刘晶晶.好氧反硝化菌的异养硝化性能研究[J]. 环境科学与技术, 2008,31(11):45-47.Wang H, Wang P, Liu J J. Characteristics of heterotrophic nitrification by aerobic denitrifiers [J]. Environmental Science & Technology, 2008,31(11):45-47.
[28] Li P, Liu D L, Liberat N, et al. High nitrogen removal from wastewater with several new aerobic bacteria isolated from diverse ecosys [J]. Journal of Environmental Sciences, 2006,18(3):525-529.
[29] 侯 颖,王 飞,李 静,等.sp.T3-6菌株及其粗酶液对2',6'-甲乙基-2-氯乙酰苯胺的降解[J]. 环境科学学报, 2014,34(6): 1396-1402.Hou Y, Wang F, Li J Q, et al. Degradation characteristics of 2',6'-methylethyl-2-chloroacetanilide by strainsp. T3-6 and its crude enzyme[J].Acta Scientiae Circumstantiae, 2014,34(6):6, 1396-1402.
[30] 陈香琪,李 科,张利平.异氧硝化-好氧反硝化菌株的筛选及初步鉴定[J]. 河南农业科学, 2014,43(3):59-64.Chen X Q, Li K, Zhang L P. Screening and identification of simultaneous nitrification and denitrification bacteria [J]. Journal of Henan Agricultural Sciences, 2014,43(3):59-64.
[31] 匡 燕,梁运祥.一株水体高效氨化菌的分离及特性研究[J]. 环境科学与技术, 2013,36(2):19-22.Kuang Y, Liang Y X. Isolation of an efficient ammonifying bacterium and study of its transformation properties [J]. Environmental Science & Technology, 2013,36(2):19-22.
[32] Joo H S, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification byno. 4 [J]. Journal of Bioscience & Bioengineering. 2005, 100(2):184-191.
[33] Jin C P, Cheng K.strain KHN-HT01 16S ribosomal RNA gene, partial sequence, GenBank: MG543680.1 [EB/OL]. https://www.ncbi.nlm.nih.gov/nuccore/MG543680.1/,2018- 12-01/2018-12-16.
[34] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:258-284.State Environmental Protection Administration. Monitoring Method of Water and Waste Water [M], 4th ed. Beijing: Chinese Environmental Science Press, 2002:258-284.
[35] Jin C P. Unverified:SDS degradation transcriptional activation protein-like gene, partial sequence, GenBank: MH393620.1 [EB/OL]. https://www.ncbi.nlm.nih.gov/nuccore/ MH393620, 2018-12-04/2018-12-16.
[36] 张若木,李泽琴,陈杨武,等.十二烷基硫酸钠微生物降解研究进展[J]. 再生资源与循化经济, 2016,9(1):34-40.Zhang R M, Li Z Q, Chen Y W, et al. Research advances on microbial degradation of sodium dodecyl sulfate [J]. Recyclable Resources and Cyclecar Economy, 2016,9(1):34-40.
[37] 崔文娟,董琳茜,孙珮石,等.硝化菌的分离及特性分析[J]. 环境工程学报, 2012,6(2):683-686.Cui W J, Dong Li Q, Sun P S, et al. Isolation and characterization of nitrifiers [J]. Chinese Journal of Environmental Engineering, 2012, 6(2):683-686.
[38] 何厚波,熊杨,周敬超.生活垃圾填埋场渗滤液的特点及处理技术[J]. 环境卫生工程, 2002,10(4):159-163.He H B, Xiong Y, Zhou J C. The characteristic and treatment technology of municipal solid waste landfill leachate [J]. Environmental Sanitation Engineering, 2002,10(4):159-163.
[39] 董春松,樊耀波,李 刚,等.我国垃圾渗滤液的特点和处理技术探讨[J]. 中国给水排水, 2005,21(12):27-31.Dong C S, Fan Y B, Li G, et al. Characteristics of domestic refuse landfill leachate and discussion on treatment technology [J]. China Water & Wastewater, 2005,21(12):27-31.
[40] 陈 雷,贺 磊,吴立群,等.垃圾渗滤液的处理现状及发展方向[J]. 环境工程, 2016,34(增刊):295-298.Chen L, He L, Wu L Q, et al. Status of landfill leachate treatment and its development direction [J]. Environmental Engineering, 2016, 34(Supplements):295-298.
[41] 张培玉,曲 洋,于德爽,等.菌株qy37的异养硝化/好氧反硝化机制比较及氨氮加速降解特性研究[J]. 环境科学, 2010,31(8):1819-1826.Zhang P Y, Qu Y, Yu D S, et al. Comparison of heterotrophic nitrification and aerobic denitrification system by strain qy37 and its accelerating removal characteristic of NH4+-N [J]. Environmental Science, 2010,31(8):1819-1826.
[42] 王 欣,黄瑞敏,陈克复.制革废水氨氮处理的研究进展[J]. 皮革化工, 2004,21(2):9-13.Wang X, Huang R M, Chen K F. Advances in ammonium removal of tannery wastewater [J]. Leather Chemicals, 2004,21(2):9-13.
[43] 冯景伟,孙亚兵,郑 正,等.制革废水处理技术研究进展[J]. 环境科学与技术, 2008,31(6):73-77.Feng J W, Sun Y B, Zheng Z, et al. Recent advances of technology for treatment of tannery wastewater [J]. Environmental Science & Technology, 2008,31(6):73-77.
[44] 游伟民.皮革废水治理技术的研究进展[J]. 皮革与化工, 2009, 26(2):16-20.You W M. Research progress in techniques of tannery wastewater treatment [J]. Leather and Chemicals, 2009,26(2):16-20.
The influence of different carbon sources on the nitrogen removal characters of aHT01.
JIN Cui-ping1, XIANG Si2, GUO Xi2, CHENG Kai1*
(1.Hubei Key Laboratory of Ecological Restoration for River-Lakes and Algal Utilization, College of Resources and Environmental Engineering, Hubei University of Technology, Wuhan 430068, China;2.Wu Han Cyano-King Enviromental Technology, Wuhan 430068, China)., 2019,39(4):1478~1484
The growth and the removal efficiency of TOC, NH4+-N and TN of a heterotrophic ammonia oxidizerHT01 were studied when SDS, cane molasses, sodium succinate, sodium acetate, sucrose, glucose, fructose or sodium citrate was used as sole carbon source. Furthermore, two rounds of the pilot-scale test were performed using leather sewage. The results indicated that NO2--N was produced in heterotrophic condition by HT01 and NH4+-N, TN and SDS were removed simultaneously at the removal efficiency of 74%, 14% and 34%, respectively. Moreover, the highest growth rate and the highest removal efficiency of TOC (71%) were observed when sodium succinate and sodium was used as sole carbon source, respectively. While the highest removal efficiency of NH4+-N (98%) and TN (29%) were observed when fructose was used as sole carbon source. The growth of HT01 was observed in leather sewage, and the removal efficiency of COD, NH4+-N and TN was 38%, 49% and 22%, respectively, in the second round of pilot-scale test.
HT01;sodium dodecyl sulfate(SDS);heterotrophic ammonia oxidation;leather sewage
X172
A
1000-6923(2019)04-1478-07
2018-09-13
国家科技重大专项(2017ZX07602002)
*责任作者, 教授, chengkaicn@163.com
金翠萍(1992-),女,山东滨州人,湖北工业大学硕士研究生,主要从事污水微生物法脱氮研究.发表论文1篇.
