后肾腺瘤的CT表现
2019-04-28罗是是王振平陈集敏陈峰李建军
罗是是,王振平*,陈集敏,陈峰,李建军
海南省人民医院放射科,海南海口 570311;2.海南省人民医院病理科,海南海口 570311; *通讯作者 王振平wang_zp2013@163.com
后肾腺瘤(metanephric adenoma,MA)是一种少见的肾脏良性肿瘤,临床及影像学检查易误诊为肾癌而行肾脏根治切除术[1]。影像学检查可为术前诊断提供依据,对治疗方案的选择及患者的预后均有重要意义。目前关于MA的影像学表现报道较少,且多为个案报道[2]。本研究回顾性分析6例经手术病理证实的MA的CT、临床及病理特征,以提高对本病的认识。
1.3 病理检查 6例患者均行手术治疗,其中2例行肾部分切除术,4例行肾根治性切除术。手术标本采用10%福尔马林溶液固定,常规石蜡切片,行HE染色及免疫组化检查。
1 资料与方法
1.1 研究对象 收集2006年2月-2016年3月海南省人民医院经手术病理证实的6例MA患者的临床、影像及病理资料,其中男4例,女2例;年龄42~78岁,平均(55.8±12.2)岁。临床表现:血尿2例,腰背部疼痛 2例,2例无症状,于体检时超声发现肾脏占位病变。伴发病:2例女性患者均伴有子宫肌瘤,其中1例伴发右侧卵巢囊性畸胎瘤;2例伴红细胞增多症。
1.2 仪器与方法 采用Toshiba Aquilion 64排CT机或Philips Brilliance iCT 256层螺旋CT机检查。扫描参数:管电压120 kV,管电流250 mAs,扫描层厚及间隔均为 5 mm。增强扫描使用非离子型对比剂碘普罗胺(300 mgI/ml),剂量 1.5~2.0 ml/kg,以3.0 ml/s注射;增强扫描采用三期扫描,延迟时间为皮质期30 s,实质期70 s,分泌期180 s。
CT血管成像(CTA)检查:采用256层螺旋CT,扫描参数:管电压120 kV,管电流250 mAs,采集层厚128×0.625 mm,对比剂及剂量同CT增强扫描,以5.0 ml/s注射;采用对比剂跟踪触发技术,触发阈值为180 Hu。将薄层图像输入EBW工作站进行重建。
2 结果
2.1 CT表现 6例MA患者均为单发,其中右肾3例,左肾3例;肿瘤位于肾上极2例,肾下极4例;1例位于肾轮廓内,5例凸向肾轮廓外;5例病灶呈圆形或椭圆形(图1、2),1例呈分叶状(图3);肿块长径3.0~10.4 cm,平均5.5 cm。CT平扫为软组织密度肿块,2例呈等密度(图1A),3例呈稍低密度(图2A),1例呈稍高密度(图3A);平扫CT值18~49 Hu,平均34.7 Hu;1例病灶边缘见点状钙化灶(图1A)。4例行CT增强扫描,肾皮质期轻至中度强化(图1B),实质期及分泌期呈延迟强化(图1C、图3B);2例增强扫描肾皮质期肿瘤大部分区域呈囊性,无明显强化,边缘部分可见斑片或结节状轻度强化(图2B),实质期和分泌期实性部分亦呈延迟强化(图2C)。3例行CTA检查,均未显示明确肿瘤供血血管,病灶周围可见受压移位小血管影(图1D)。
2.2 病理表现 肉眼见肿瘤切面呈灰白色或灰黄色,质中等,1例肿瘤边缘见少许钙化,2例肿瘤伴坏死囊变。镜下见瘤细胞形态单一,核小而一致,染色质细腻,无核仁或核仁不明显,呈腺泡状排列,低倍镜下呈分枝状和鹿角状小管结构(图3C)。1例合并局灶透明细胞癌,肾周组织未见浸润。免疫组化:6例波形蛋白(+)(图3D)、细胞角蛋白(+),3例 WT-1(+)、CD57(+),1 例 CD56(+),6 例角蛋白-7 及上皮膜抗原(-)。
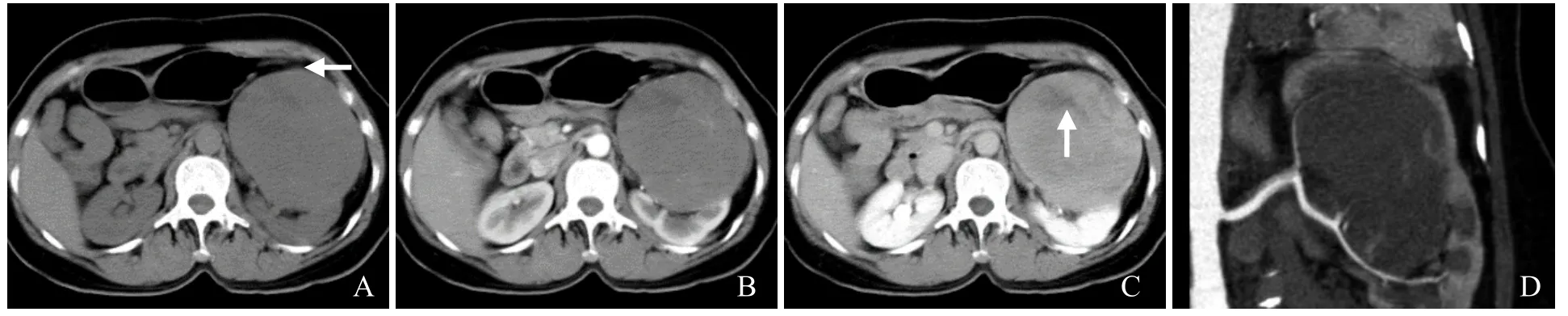
图1 女,53岁,左肾MA。CT平扫示左肾等密度肿块,密度不均匀,边界清楚,前部见点状钙化灶(箭,A);增强扫描皮质期呈不均匀轻度强化(B);增强扫描实质期呈延迟强化,坏死区无增强(箭,C);CTA最大密度投影图显示肿块未见明显供血动脉,其周围见受压移位侧小血管(D)
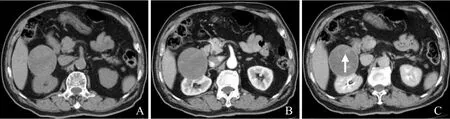
图2 男,78岁,右肾上极MA伴局灶透明细胞癌。CT平扫示右肾上极稍低密度肿块,边界清楚(A);增强扫描后各期病灶大部分无强化,呈囊性改变(B);病灶前中部实质期和分泌期见少量片絮状轻度强化影(箭),呈延迟强化(C)
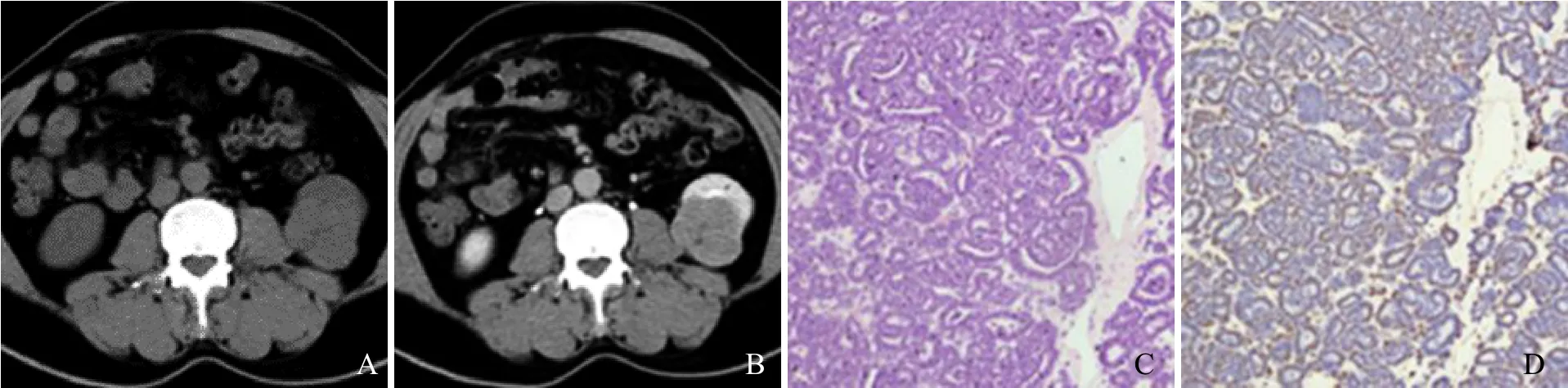
图3 男,51岁,左肾下极MA。CT平扫示左肾下极分叶状稍高密度肿块,密度均匀,边界清楚(A);增强扫描后病灶呈均匀轻至中度强化(B);镜下肿瘤细胞以腺泡状排列方式为主,瘤细胞大小较一致,体积小,胞质少,核呈圆形或椭圆形,未见核仁及核分裂(HE,×200,C);肿瘤细胞免疫组化检测示波形蛋白(+)(×200,D)
3 讨论
MA是一种罕见的原发性肾良性肿瘤,约占成人原发肾肿瘤的0.2%[1],由Brisigotti等[3]于1992年命名为后肾腺瘤。MA好发于肾皮质,其组织学来源尚不清楚,2016年WHO肾肿瘤病理组织学分型将MA、后肾腺纤维瘤和后肾间质瘤统称为后肾肿瘤大类,其生物学行为均为良性。MA可发生于任何年龄,既往研究报道其好发于50~60岁人群,以女性多见[1,4]。本组患者发病年龄与文献报道一致,但以男性居多,可能与本组病例数较少有关。MA多数于体检时偶然发现,史玉书等[5]报道少数MA患者以肉眼血尿、发热、腹部包块或腹痛就诊。约10%的MA患者合并红细胞增多症,Yoshioka等[6]推测可能与MA细胞产生并分泌促红细胞生成素有关。本组6例MA患者中,2例伴有红细胞增多症。大部分MA由于术前误诊为肾癌而行肾脏根治切除术;本组6例患者术前均误诊为肾癌,其中2例行肾部分切除术,4例行肾根治性切除术。术后随访均未见肿瘤复发及转移。杨志远等[4]报道MA可合并肾乳头状癌,本组中1例MA伴发透明细胞癌,提示MA可能具有恶性分化潜能。
MA常为单侧、单发病变,偶尔可见双侧发病[7]。肿瘤位于肾脏皮质,边界清晰,常突出于肾表面,肉眼观察切面呈灰白色或灰黄色,质地中等,肿瘤较大时易发生出血和坏死;镜下瘤细胞形态单一,核小而一致,染色质细腻,无核仁或核仁不明显,无明显异型性,呈腺泡状排列,约19%的肿瘤内有钙化或砂砾体[1]。MA病灶直径大小差异较大,为0.3~20.0 cm[4],本组肿瘤病灶直径3.0~10.4 cm,平均5.5 cm。
MA的影像学表现无明显特异性,其CT表现包括:①肿瘤呈圆形或椭圆形,偶尔可呈分叶状,肿瘤较大时凸出肾脏轮廓外生长,本组中5例凸向肾轮廓外。②CT平扫趋于呈等密度,边界清楚,多数密度均匀,肿瘤坏死或出血时密度不均匀,少数病例可伴钙化[4],本组中仅1例伴有点状钙化。③增强扫描动脉期肿瘤呈轻度强化,坏死囊变区无强化,实质部分呈渐进性延迟强化[2,4-5]。本组6例CT增强扫描均呈渐进性强化,其中2例可见明显囊变,实质部分较小,但仍表现为延迟强化特征。④肿瘤血管:CTA显示MA肿块无明显的供血血管,肿块周围可见受压的细小侧支循环血管[4-5],本组中3例行肾脏CTA检查均未见明确肿瘤供血血管。
MA的临床与CT表现缺乏特异性,与肾乳头状癌、肾嫌色细胞癌等乏血供肾癌鉴别困难,术前常被误诊[1]。肾乳头状癌、肾嫌色细胞癌的CT表现不同于常见的肾透明细胞癌典型“快进快出”的强化特征,增强扫描后呈轻或中度强化,强化程度低于肾实质[8-9],与MA鉴别较困难,确诊主要依靠病理检查。MA还需与嗜酸细胞腺瘤鉴别,病灶中央强化的星状瘢痕是诊断嗜酸性腺瘤典型且较为特异性的征象,但其显示率仅约为 33%~55%[10],术前仅凭中央星状瘢痕与 MA和肾癌鉴别较困难。孔晓静等[9]研究认为,CT动态增强实质期肿瘤-肾皮质强化指数有助于鉴别诊断肾嫌色细胞癌与嗜酸细胞瘤,其是否能应用于MA的鉴别诊断鲜有报道,有待进一步研究证实。
总之,MA是临床罕见的肾脏良性肿瘤,影像诊断较为困难。CT检查发现单侧肾脏较大肿瘤、肿块边缘光整、肿物生长缓慢、平扫接近等密度、增强扫描表现为轻度延迟强化等特征,尤其伴有红细胞增多症时,要考虑MA的可能。
