前列腺癌扩散加权成像、动态对比增强MRI参数与Ki-67蛋白表达的相关性
2019-04-28张家伟赵莹莹黄婷李鹏蔡磊陈志强
张家伟,赵莹莹,黄婷,李鹏,蔡磊,陈志强*
1.宁夏医科大学临床医学院,宁夏银川 750004;2.宁夏医科大学总医院放射科,宁夏银川 750004; *通讯作者 陈志强zhiqiang_chen99@163.com
前列腺癌是男性常见的恶性肿瘤,在我国发病率呈逐年升高趋势,早期明确诊断有利于提高患者的远期生存率[1]。近年,随着MRI新技术在前列腺疾病中的广泛应用,前列腺多参数磁共振成像(multiparametric magnetic resonance imaging,mpMRI)已被公认为诊断前列腺癌的最佳影像学检查方法,其包括T2WI、扩散加权成像(DWI)、动态对比增强 MRI(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)[2]。Ki-67是反映肿瘤增殖状态的常用标志物,目前关于前列腺癌影像参数与 Ki-67之间的关系鲜有报道。本研究拟回顾性研究前列腺疾病患者DWI、DCE-MRI特征与Ki-67的相关性。
1 资料与方法
1.1 研究对象 收集宁夏医科大学总医院放射科2014年1月—2017年8月行常规序列T2WI、DWI、DCE-MRI检查,并经病理检查证实为前列腺疾病的93例患者,包括前列腺癌,前列腺增生和(或)慢性前列腺炎。纳入标准:①行mpMRI扫描均无禁忌证(如幽闭恐惧症);②临床可疑前列腺癌,血清前列腺特异性抗原(prostate specific antigen,PSA)不同程度升高和(或)直肠指检触及质地较硬的结节样肿块;③术前4周内进行DWI、DCE-MRI检查;④均有完整的影像学和病理资料;⑤MRI检查前均未行穿刺活检及接受任何治疗。患者年龄50~88岁,平均68.9岁;前列腺癌47例,非前列腺癌[前列腺增生和(或)慢性前列腺炎]46例;Ki-67阴性41例,Ki-67低表达(+)41例,Ki-67高表达(++)~(+++)11例。
1.2 仪器与方法 采用GE Signa Excite HD 3.0T MRI仪,接受线圈为心脏相控线圈,嘱患者尽量保持平静呼吸。常规扫描序列包括前列腺、精囊腺范围的T1WI、T2WI、压脂T2WI、DWI、DCE-MRI序列。DWI采用单次激发EPI序列,扫描参数:b值为800 s/mm2,层厚3 mm,层间距0 mm,TR 2000 ms,TE 56.3 ms,视野36 cm×32.4 cm,矩阵128×128,扫描时间64 s。DCE-MRI扫描参数:TR 2.7 ms,TE 1.2 ms,层厚3.0 mm,扫描层数660层,矩阵272×160,视野40 cm×36 cm,连续扫描55期,扫描时间183 s,单次时相扫描时间约3.34 s。
1.3 图像分析 由 2位经验丰富的放射科诊断医师采用盲法对所有患者mpMRI最可疑为前列腺癌的病灶进行结果判读,结论不一致时协商达成一致。采用GE ADW 4.3工作站Functool2软件后处理,在DCEMRI、DWI扫描病灶最显著的位置选取感兴趣区(ROI),ROI需完全置于病灶,并尽量避开囊变、坏死、出血等部位,大小约30~35 mm2,随机测量3次,取平均值。ADC值测量结果通过DWI高信号及ADC图低信号位置绘制ROI后自动生成,DCE-MRI绘制时间-信号强度(TIC)曲线,并根据公式(1)、(2)计算最大强化程度(SImax)、最快强化率(Rmax),达峰时间(Tmax)为曲线开始强化至强化峰值所需时间。
1.4 免疫组化检查 所有标本均采用二分步法进行检测,石蜡包埋,切片厚度约4 μm,经脱蜡等一系列过程,所选标本行病理穿刺的部位应与 MRI图像选择的ROI尽可能一致,实验步骤严格按照试剂盒说明书进行相关操作。
Ki-67主要定植于细胞核,经免疫组化染色后出现黄色、棕黄色、棕褐色颗粒为Ki-67阳性,反之为阴性或未表达。Ki-67分级标准[3]:①阴性(-):阳性细胞数<5%;②弱阳性(+):阳性细胞数5%~25%;③阳性(++):阳性细胞数26%~50%;④强阳性(+++):阳性细胞数>50%。根据分级标准将Ki-67分为阴性组(-)、低表达组(+)、高表达组(++)~(+++)。
1.5 统计学方法 采用SPSS 22.0软件,计量资料以±s表示,组间两两比较先检验方差齐性,方差齐时采用独立样本t检验,方差不齐时采用独立样本Kruskal-WallisH检验,前列腺癌DWI、DCE-MRI参数与Ki-67的相关性采用Kendall’s tau-b等级相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 Ki-67阴性组、Ki-67低表达组及Ki-67高表达组前列腺疾病患者的病理结果见表1及图1。
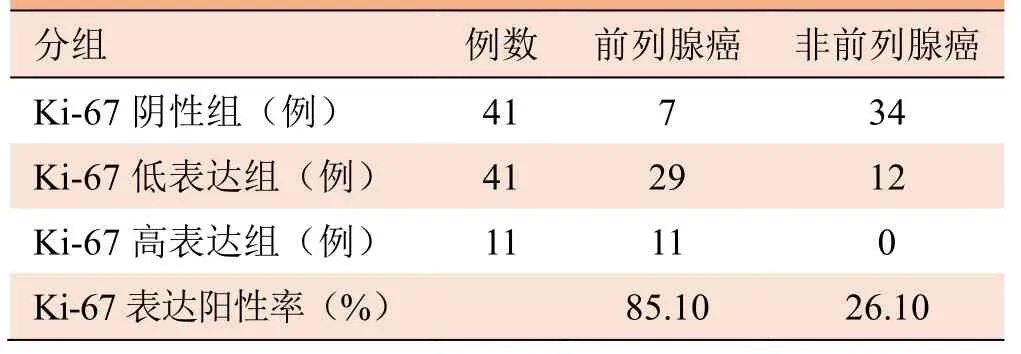
表1 不同Ki-67表达组前列腺疾病患者的病理结果
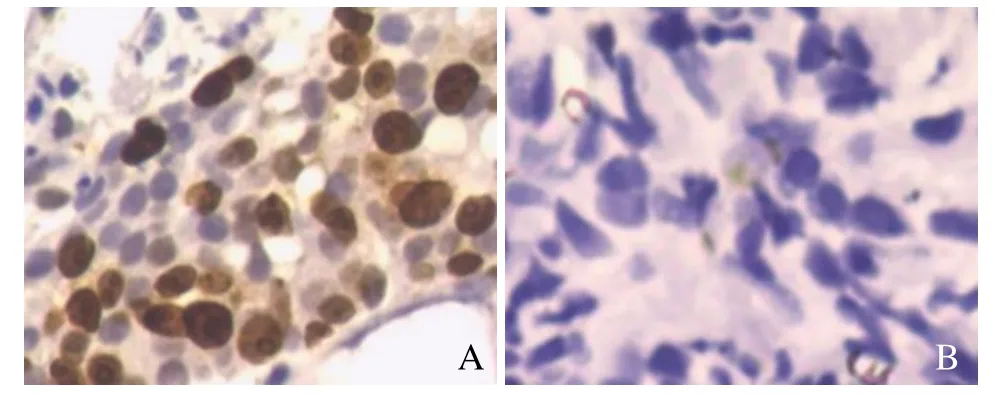
图1 A.男,65岁,前列腺癌。免疫组化示Ki-67呈阳性表达(×200),细胞核经免疫组化染色后出现黄色、棕黄色、棕褐色颗粒,PSA为100 ng/ml;Gleason:5+4=9。B.男,57岁,良性前列腺增生伴慢性前列腺炎。免疫组化示Ki-67呈阴性表达(×200),细胞核经免疫组化染色后未出现黄色、棕黄色、棕褐色颗粒,PSA为20.34 ng/ml
2.2 前列腺癌组与非前列腺癌组及 Ki-67不同表达组间影像参数比较 前列腺癌组与非前列腺癌组及Ki-67阴性组、Ki-67低表达组、Ki-67高表达组ADC值、Tmax、SImax、Rmax见表2及图2,组间两两比较,前列腺癌组与非前列腺癌组之间及Ki-67阴性组与Ki-67低表达组、Ki-67高表达组差异均有统计学意义(P<0.05),但Ki-67低表达组与高表达组差异无统计学意义(P>0.05)。
2.3 前列腺良、恶性疾病各影像参数与Ki-67的相关性 ADC值、Tmax与Ki-67均呈负相关(r=-0.50、-0.37,P<0.01),SImax、Rmax与Ki-67均呈正相关(r=0.29、0.36,P<0.01)。见图3。
表2 前列腺癌组与非前列腺癌组及Ki-67不同表达组影像参数比较( ±s)
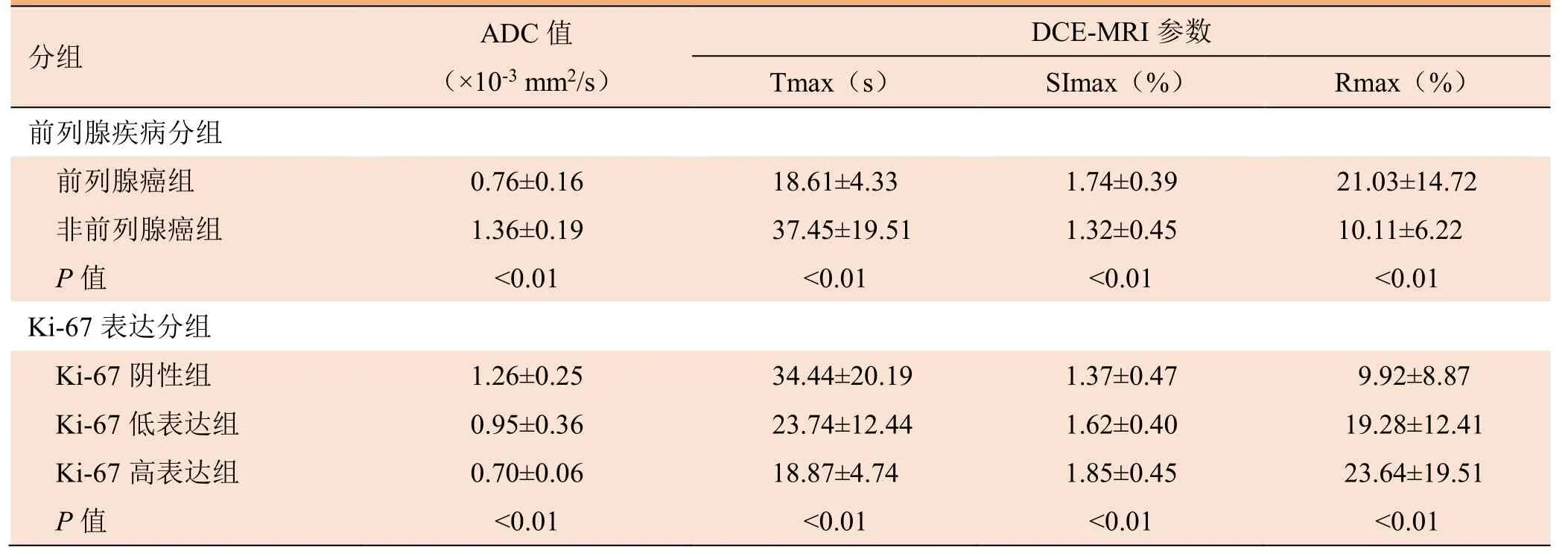
表2 前列腺癌组与非前列腺癌组及Ki-67不同表达组影像参数比较( ±s)
?
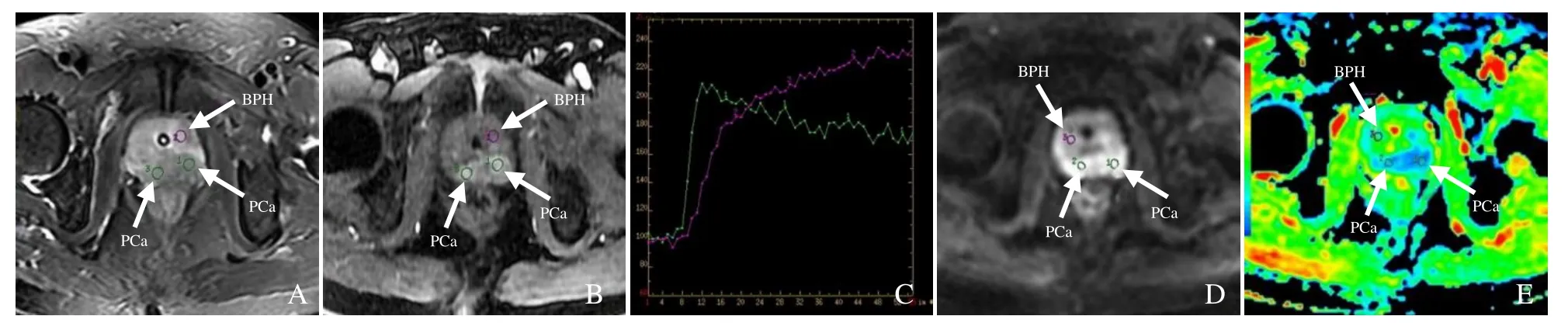
图2 男,79岁,前列腺癌。抑脂T2WI示双侧外周带呈均匀低信号(箭,A);DCE-MRI示癌区早期呈明显强化(箭,B);TIC曲线示癌区(绿色线)呈Ⅰ型曲线,非癌区(紫色线)呈Ⅲ型曲线(C);DWI示癌区呈明显高信号(箭,D);ADC图示癌区呈明显低信号(箭),癌区ADC值(0.66×10-3 mm2/s)较非癌区ADC值(1.21×10-3 mm2/s)明显减低(E)

图3 Ki-67与前列腺良、恶性疾病影像参数的相关性。A、B、C、D分别为ADC值、Tmax、SImax、Rmax与Ki-67之间的相关性
3 讨论
随着医学影像技术的发展,mpMRI在前列腺癌的诊断和治疗中已得到广泛应用,不仅可以指导初始和重复活检部位的选择,还可以减少活检假阴性结果[4]。本研究显示,mpMRI参数可作为预测肿瘤增殖能力的影像学指标。
3.1 前列腺癌 mpMRI特征及 Ki-67蛋白表达情况DWI通过测量ADC值的大小反映活体组织内水分子扩散状态(自由度和方向性),后者能间接反映组织微观结构的变化[5-6]。前列腺癌主要发生于外周带,较少发生于中央移行带,其T2WI上表现为病变部位均匀性低信号、边界模糊不清。由于正常前列腺组织被肿瘤组织(肿瘤细胞和间质)取代,间质成分越多,肿瘤组织质地越硬且实,细胞间隙明显变窄,水分子扩散越容易受限,使得DWI图上病灶呈显著高信号,ADC图上呈显著低信号,ADC值降低。良性前列腺增生T2WI上显示病变主要位于中央腺体区,其内可见多发大小不等的类圆形有假包膜的结节样病灶,边界清晰。T2WI上显示良性前列腺增生可呈低信号、高信号及混杂高低信号;DWI根据增生的成分不同与T2WI表现相似。慢性前列腺炎T2WI主要表现为外周带弥漫性低信号,DWI图呈弥漫性稍高信号,ADC图显示为稍低信号,由于大部分良性前列腺疾病水分子扩散未明显受限,使得ADC值较高,但仍存在部分重叠现象。Anwar等[7]研究认为前列腺癌的ADC值为(0.57±0.08)~(0.94±0.25)×10-3mm2/s,较低的ADC值代表分化差的前列腺癌,较高的ADC值代表分化好的前列腺癌,即前列腺癌的ADC值与肿瘤分化成反比。孙静等[8]、李鹏等[9]的研究也证实了这一结论。
DCE-MRI是以液体流动效应为基准反映组织灌注情况(包括定性、半定量、定量)的测量方法[10],可以了解恶性组织信号强度、肿瘤微血管生成程度、血管渗透性增加情况;恶性肿瘤处的造影剂堆积与肿瘤血管生成和渗漏的微血管系统有关,通常癌变部位增强早期即会迅速强化,达峰值后造影剂迅速清除,强化程度显著下降[8]。本研究结果显示,由于肿瘤组织包括实质(肿瘤细胞)和间质(主要包括血管和结缔组织)两部分,基于间质内富含大量的血管成分,肿瘤细胞的血运非常丰富,对肿瘤细胞起营养和支持作用,使得肿瘤细胞短时间内异常增殖;因而前列腺癌的DCE-MRI表现为达峰时间更短,强化程度早期更显著,强化速度更快,峰值更高,与Scialpi等[11]的研究结论一致。
Ki-67是在细胞核内检测到且能够反映恶性肿瘤增殖率的常用生物学标志物,其在维持细胞增殖活性方面的能力较为稳定。Ki-67位于除静息细胞(G0期)以外所有细胞周期(G1、S、G2、有丝分裂期)的活性阶段。本研究证实,Ki-67在前列腺癌组织中呈高表达,在良性前列腺疾病中以低表达或不表达为主,而前列腺癌组与非前列腺癌组Ki-67阳性率分别为85.1%、26.1%,提示Ki-67对前列腺癌患者具有潜在的预测及预后评估价值,与既往研究结果一致[12-14]。
3.2 DWI、DCE-MRI参数与Ki-67的相关性 目前关于前列腺癌的ADC值、DCE-MRI半定量参数与预后因素(尤其 Ki-67)的相关性研究较少。本研究结果显示,Ki-67阴性组、Ki-67低表达组、Ki-67高表达组的DWI、DCE-MRI各参数组间两两比较,Ki-67阴性组与 Ki-67阳性组差异均有统计学意义(P<0.05);但Ki-67低表达组与Ki-67高表达组差异无统计学意义(P>0.05),可能与既往研究关于Ki-67表达的截断值尚无统一定论有关,还可能与本组Ki-67高表达组样本量偏小有关,需进一步研究证实。本研究结果显示,ADC值、Tmax与Ki-67均呈负相关(r=-0.50、-0.37,P<0.01);而SImax、Rmax与Ki-67均呈正相关(r=0.29、0.36,P<0.01);Kim等[15]研究发现,在乳腺癌中ADC值与Ki-67的相关性最强。Calvar等[16]研究发现脑肿瘤ADC值与Ki-67呈负相关。Szabó等[17]研究表明,乳腺癌 TIC曲线类型与Ki-67具有相关性,尤其Ⅲ型曲线(流出型曲线,提示恶性病变)。可能由于肿瘤组织微循环灌注水平与肿瘤细胞增殖活性之间有一定的相互作用,肿瘤细胞增殖能力越强,越容易促使微血管生成,肿瘤异型性越显著,微循环灌注能力越强;同时,随着肿瘤微血管的增加,微循环的灌注能力增加又可以促进肿瘤的快速增殖,使得肿瘤细胞异常活跃,从而引起肿瘤组织的Tmax明显缩短,SImax、Rmax明显增高,提示mpMRI参数可以作为预测Ki-67表达水平的影像学指标。
总之,前列腺癌DWI、DCE-MRI各参数与Ki-67均具有相关性。DWI、DCE-MRI参数可以无创性地评估前列腺癌的生物学特性,可以作为预测肿瘤恶性程度的影像生物学指标。
