小鼠内耳发育过程中Evi-1基因的表达
2019-04-28陈佩佩李雯左娜吴成胡梦茹刘少峰
陈佩佩 李雯 左娜 吴成 胡梦茹 刘少峰*
1皖南医学院弋矶山医院耳鼻喉头颈外科
2上海复旦大学附属眼耳鼻喉头颈科医院
哺乳动物Corti器的感觉毛细胞常会因疾病、年龄以及一些损伤因素缺失从而导致耳聋[1],然而,不同于鸟类及一些低等动物内耳毛细胞损伤后有再生能力[2-5],哺乳动物Corti器官上终末分化的毛细胞一旦丢失无法再生或被替换[6,7]。内耳的发育是一个多基因参与调控的复杂的过程,其中从耳基板到毛细胞分化过程更是有着复杂的基因通路调控[8]。关于这一现象,目前已经证实多种基因在这一过程中有重要作用[9],如Sox2基因,是内耳发育过程中所必须的[10]。但仍有更多新的基因需要进一步研究与探索。
Evi-1,又 称 Mecom、PRDM3,PRDM3 属 于PRDM(PRDI-BF1 and RIZ homology domain containing)蛋白质家族中的一员,该基因家族的特征在于N-末端PR结构域和C-末端锌指结构域[11],并且该家族可以通过调节JNK和TGFβ等信号,参与调控细胞的增殖、分化及组织器官的发育[12],目前已经证实PRDM家族可以控制癌症中的细胞增殖[13,14],其中Prdm16控制小鼠骨骼肌和棕色脂肪之间的转换[15],而hamlet决定果蝇中的神经元类别[16]。目前已经证明Evi-1可以通过其DNA结合域-1结合Smad3蛋白从而参与调控制TGF-β信号通路[17],并且在先前的研究也发现EVi-1蛋白可以于多种蛋白相互作用,参与基因表达调控及信号转导。但是Evi-1基因在小鼠内耳发育过程中是否表达,在什么位置表达以及在什么时间段表达,目前尚未有相关的报道。目前已知Sox2是干细胞的通用标记物,广泛表达于各种器官的胚胎和祖细胞以及发育和成熟的神经系统中,其在耳基板中明显表达,是内耳发育过程中是前感觉区的早期标记物[18,19]。因此,本研究采用免疫荧光共标记技术,对Sox2及Evi-1进行共染色,观察Evi-1基因在小鼠内耳发育过程中的表达情况,为进一步研究其功能提供依据。
1 材料与方法
1.1 实验动物的获取
挑选耳廓反应灵敏、适龄(8-10周)的C57BL/6小鼠以雌:雄=2:1的比例作为种鼠交配(由复旦大学附属眼耳鼻喉医院实验动物中心提供并具有合格证),于下午5点左右将雌雄鼠合笼,次日8点发现孕栓之日为胚胎第0.5天(E0.5)。
1.2 胎鼠内耳的处理
分别选取E9.5至E18.5的孕鼠各2只,实验动物统一在上午8点处死,从而来获取E9.5至E18.5时期每阶段各6只胎鼠。以甲苯噻嗪-氯胺酮背部皮下注射麻醉孕鼠后,迅速剖腹,取出胚胎,放入预冷的4%的多聚甲醛中(4%PFA),对小于E15.5天的胎鼠直接断头后留取胎头,对E15.5后的胎鼠直接分离内耳;随后将上述样本放入4度冰箱静置2h后,PBS冲洗3遍,随后移入到15%的蔗糖溶液中,在4度冰箱放置约3-6h,待样本沉底后,更换30%的蔗糖放置于4度过夜;于次日将样本浸入OCT包埋剂中(optimal cutting temperature compound)包埋4h,显微镜下将小于E15天胎头平行切片摆放,切片时平行于口-耳切片;大于E15的内耳平行于蜗轴摆放,切片时平行于蜗轴切片;放入-20度冰箱冷冻。随后将样本垂直立于冰冻切片托盘上,OCT固定,片厚10uM,沿图A横线所示方向进行连续切片,冰冻切片保存于-20度冰箱中备用,多余的标本及冰冻切片放入-80度箱保存备用。
1.3 实验设备及材料
Leica DMR显微镜(荧光/白光),Leica CM3050S 冷冻切片机 (Leica Microsystems,瑞士),鼠源性抗Evi-1单克隆抗体(Santa sc-130025),羊源性Sox2单克隆抗(Santa sc-17320)Alexa Fluorenc抗兔(1:400,invitrigen 1834794);Adobe Photoshop图像处理软件。
1.4 免疫组织化学染色步骤
将载有标本的冰冻切片常温干燥1h后,使用磷酸盐缓冲液(phosphate-buffered saline,PBS)浸泡10min,洗去OCT,98度水浴锅进行高温抗原修复15-20min,随后使用1%的PBST配置的10%的胎牛血清在37度孵育1h后移入4度冰箱过夜;次日配置抗EVI-1小鼠单克隆抗体(1:300)以及抗Sox2山羊单克隆抗体(1:800)一抗,37度孵育1h后,移入4度冰箱过夜后PBS冲洗3遍,每次5min;二抗使用抗小鼠Alexa Fluor 488和Cy3-conjµgated Affini-Pure donkey Anti-Goat IgG(H+L),室温孵育2h(避光)后,PBS冲洗三遍,每遍5min,然后使用DAPI(1:1000)染细胞核,室温10min;最后使用封片甘油和指甲油封片。(-20度冰箱避光保存)。PBS代替抗Evi-1小鼠单克隆抗体作为阴性对照,免疫组化无阳性显色。(图1 B、C)
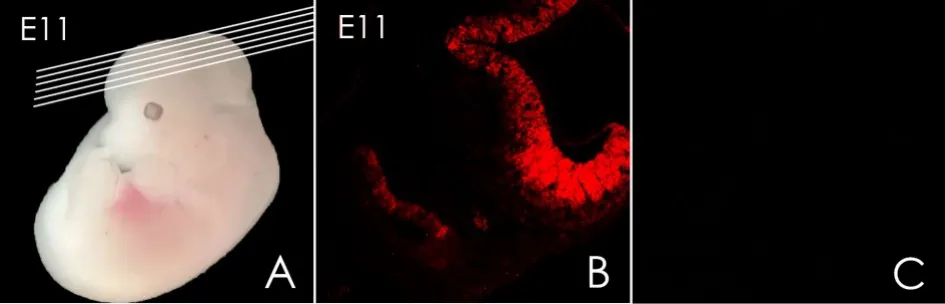
图1 冰冻切片方向及阴性对照。A:沿横线所示进行连续冰冻切片;B:红色标记Sox2的表达;C:E11时期,以PBS代替Evi-1抗小鼠单克隆抗体作为阴性对照,免疫组化无阳性显色Fig.1 The direction of frozen sections and negative controlA:Serial sections along the horizontal line;B:Sox2 in B are labeledinred;C:NopositiveareawasdetectedwhenPBSinstead ofEvi-1anti-mousemonoclonalantibodyasanegativecontrol.
2 结果
胎鼠冰冻切片方向按照图1A横线所示进行连续切片。小鼠内耳在E9.5天时,耳基板开始内陷并逐渐封闭形成听泡,此时可观察到Sox2于听囊背外侧及腹内侧均有表达(图2A),但尚未在听囊及其周围间充质观察到Evi-1蛋白的表达(图2B)。E10.5时期听泡继续发育,腹侧突出逐渐形成耳蜗始基及前庭始基,此时检测到Sox2在听囊的侧面及耳蜗囊表达(图3A);同时可在耳蜗囊(CS)、前庭囊(VS)以及面神经节周围发现Evi-1蛋白的表达(图3B),其中背侧表达较腹侧明显,但在感觉上皮中仍未观察到Evi-1的表达(图3E);E11.5时期,前庭始基与耳蜗始基区分已经很明显,耳蜗始基继续向腹侧扩大,并且在前庭始基上已经可以区分内淋巴囊和管始基逐渐发育形成上、后半规管。E11.5时期,Sox2主要表达于前感觉区(图4D),并且可在内耳中整个感觉上皮的周围间充质见到Evi-1显著表达(图4E),但此时Evi-1仍然局限表达于感觉上皮周围的间充质中,仍未在这一时期的感觉上皮中观察到Evi-1的表达(图4E);在E12.5时期,听泡进一步发育变长,侧面开始形成外半规管,腹侧内耳开始出现椭圆囊,Sox2表达主要分布于腹内侧的感觉上皮层(图5D),Evi-1在内耳周围间充质中仍明显表达,同时,在感觉上皮内的耳蜗及前庭部分均观察到了evi-1的表达(图5E)。但随着内耳继续发育到,感觉上皮以及耳周间充质中的Evi-1表达开始逐渐减弱直至完全消失,E13.5时期时,内耳中已经无法观察到明显的Evi-1的表达,并且内耳周围间充质中的部分区域的Evi-1的表达开始逐渐减弱消失(图6B),到E15.5时期时Evi-1在内耳及耳周间充质中的表达已经完全消失,此后均未在内耳及其周围间充质中观察到Evi-1的表达(图7B、E)。
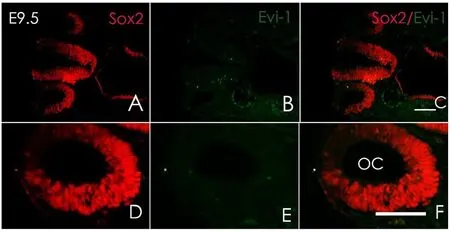
图2 E9.5时期,Evi-1及Sox2的表达。A-C:低倍数下观察到的Sox2与Evi-1在内耳中的表达分布:D:Sox2于听囊背外侧及腹内侧表达;E:尚未在内耳中观察到明显的Evi-1的表达;F:为图D和图E的叠加;(红色:Sox2;绿色:Evi-1)OC:听泡。标尺为50μmFig.2 A:The expression of Sox2 and Evi-1 at E9.5.A-C:The expression of Sox2 and Evi-1 in inner ear at low-power field:D:The expression of Sox2 has detected in dorsolateral and ventromedial of otic vesicle at E9.5;E:There was no obvious expression of Evi-1 in inner ear at this stage;F:Fig F is the stack of D and E;(Red:Sox2 Green:Evi-1)OC:otocyst.Scale bar:50μm

图3 E10.5时期,Evi-1及Sox2的表达。A-C:低倍数下Sox2与Evi-1在内耳中的表达分布;D:Sox2在听囊的侧面及耳蜗囊表达;E:Evi-1在耳蜗始基及前庭始基背侧开始出现表达,并且在面神经节周围出现明显表达,F:为图D和图E的叠加;(红色:Sox2;绿色:Evi-1)VS:前庭囊,CS:耳蜗囊。标尺为50μmFig.3 The expression of Sox2 and Evi-1 at E10.5.A-C:The expression of Sox2 and Evi-1 in inner ear at low-power field;D:The expression of Sox2 was observed in dorsolateral of otic vesicle and cochlear capsule.E:The expression of Evi-1 has arose in the dorsal of cochlear and vestibular primordium at E10.5.(Red:Sox2;Green:Evi-1)VS:vestibular sacs,CS:cochlear capsule.Scale bar:50μm
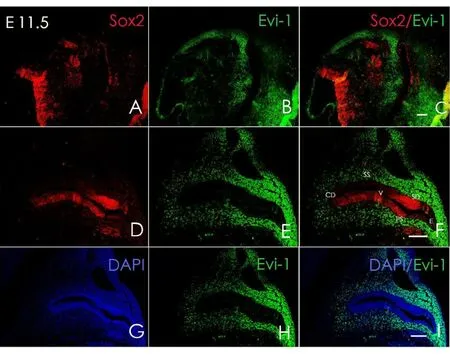
图4 E11.5时期,Evi-1及Sox2的表达。A-C:低倍数下观察到的Sox2与Evi-1在内耳中的表达分布;D:Sox2表达主要分布于前感觉区;E:E11.5时期,Evi-1在内耳感觉上皮区周围的间充质中均明显表达;F:为图D和图E的叠加;H-J:细胞核由DAPI标记;(红色:Sox2;绿色:Evi-1;蓝色:DAPI)CD:蜗管,SS:上半规管,PS:后半规管 E:淋巴管 V:前庭部分。标尺为50μmFig.4 The expression of Sox2 and Evi-1 at E11.5.A-C:The expression of Sox2 and Evi-1 in inner ear at low-power field;D:Sox2 was mainly expressed in prosensory domain;E:The expression of Evi-1 has clearly observed in mesenchyme around the Sensory epithelium in inner ear;F:Fig F is the stack of D and E;H-J:Nuclei are labeled with DAPI;(Red:Sox2;Green:Evi-1;Blue:DAPI);CD:cochlear duct,SS:superior semicircular canal,PS:posterior semicircular canal E:lymphatic V:vestibular.Scale:50μm
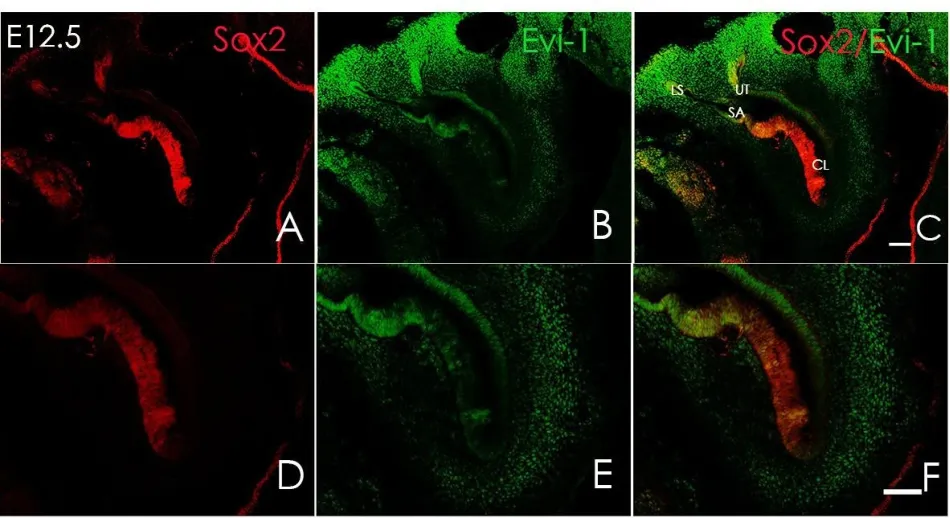
图5 E12.5时期,Evi-1及Sox2的表达。A-C:低倍数下观察到的Sox2和Evi-1的表达分布;D:Sox2表达主要分布于腹内侧的感觉上皮层;E:Evi-1在内耳周围间充质中及感觉上皮中明显表达;CL:耳蜗,LS:外半规管,UT:椭圆囊,SA:球囊标尺为50μmFig.5 A-C:At E12.5,the expression of Sox2 and Evi-1 in inner ear at low-power field;D :Sox2 was mainly expressed in sensory epithelium at ventromedial of inner ear;E:Evi-1 was strongly observed not only in periotic mesenchyme but also in sensory epithelium at E12.5;F:Fig F is the stack of D and E;CL:cochlea,LS:lateral semicircular canal,UT:utricle,SA:saccule.Scale:50μm
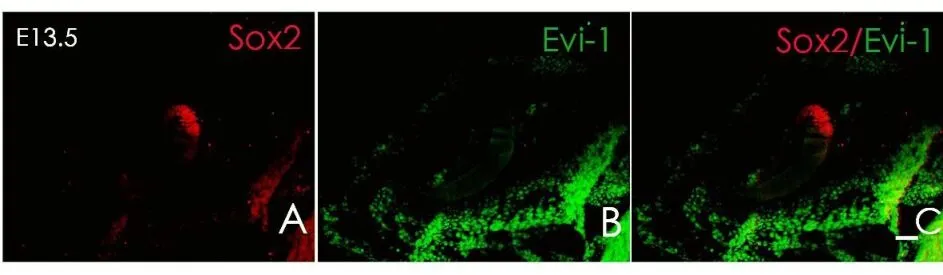
图6 E13.5时期,Evi-1及Sox2的表达。A:E13.5时期,Sox2的表达;B:Evi-1在内耳及其周围间充质中的表达逐渐减弱甚至消失;C:为图A和图B的叠加;(红色:Sox2;绿色:Evi-1)Fig.6 The expression of Sox2 and Evi-1 at E13.5.A:The express of Sox2 at E13.5;B:The expression of Evi-1 gene in inner ear and it's surrounding mesenchyme has gradually weakened and even disappeared since E13.5;F:Fig F is the stack of D and E.(Red:Sox2;Green:Evi-1)Scale:50μm
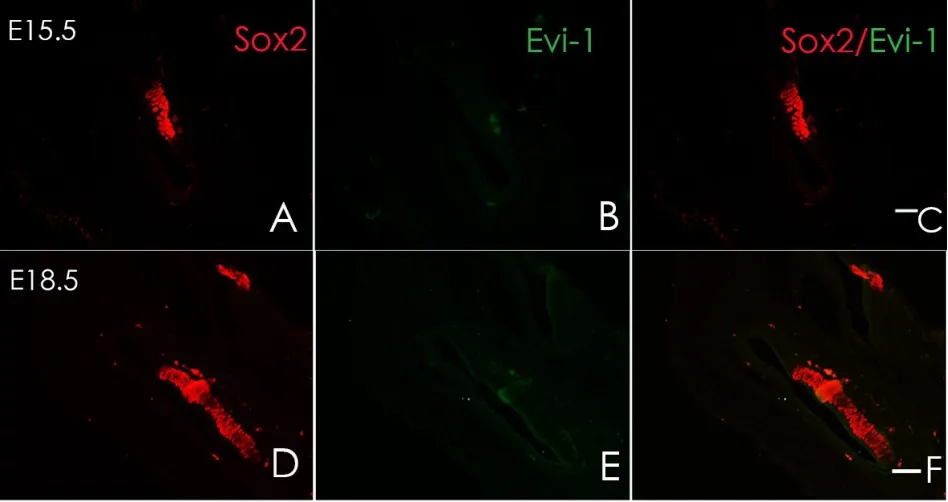
图7 E15.5及E18.5时期,Evi-1及Sox2的表达。A-F:E15.5时期,Evi-1表达完全消失,其随后的发展阶段,也未在内耳及其周围间充质中观察到Evi-1的表达。标尺为50μmFig.7 The expression of Sox2 and Evi-1 at E13.5 and E18.5.A-F:The expression of Evi-1 has disappear completely since E15.5.Scale:50μm
3 讨论
目前已经发现Evi-1在果蝇stage13时期开始在脊索表达,到stage21时期逐渐局限在端脑、中脑、脑室层、感觉器官听泡周围的间充质[20,21],但Evi-1在内耳中的表达作用目前尚无相关详细报道,本研究发现在内耳的发育过程中,Evi-1在E10.5-E14.5的内耳周围的间充质中呈一过性表达,E14.5时期后内耳中Evi-1的表达逐渐减弱至消失。E9时,听板内陷形成听泡,E10.5时期开始形成耳蜗始基和前庭始基,此时,毛细胞和支持细胞的祖先仍在分裂,发育至E13.5,约85%将来分化为耳蜗毛细胞的感觉细胞退出细胞周期停止分裂,但此时还未发现毛细胞分化[9]。目前也已经证实E12至E13小鼠耳蜗感觉细胞以增殖为主,E14至E15感觉细胞分化逐渐占优势[22]。这些均表明小鼠E13.5以前是耳蜗毛细胞发育的关键节点。Evi-1在耳周间充质的表达时间段于内耳中毛细胞发育的关键时期一致,因此,我们猜测其可能在感觉细胞的增殖分化及毛细胞的发育成熟存在一定的关系。
上皮和间充质组织相互之间的诱导信号在许多系统的组织器官的发育过程中具有重要作用,目前已经证明耳周间充质的众多信号分子[23-26]及调控基因在内耳的早期发育及内耳感觉前体细胞增殖分化为毛细胞的过程中具有重要作用[27-30]。White等人将分离的耳蜗支持细胞与E13.5时期小鼠前庭区域的间充质共培养后,发现支持细胞转分化为毛细胞[31,32]。Annikoji及刘少锋等人均发现在E12.5时,耳周间充质对感觉上皮形态发生及毛细胞的发育形成具有明显促进作用[26]。这些均表明在E12.5这个阶段与耳蜗感觉上皮相邻的耳周间充质内可能含有某种物质或某种调控或诱导信号,可以促进感觉前体细胞增值以及毛细胞发育。因此,我们猜测Evi-1可能在感觉上皮的分化发育以及毛细胞的发育成熟存在一定的相关性。
本研究利用免疫组织化学技术观察Evi-1基因在小鼠内耳发育过程中表达的时空变化规律,为进一步研究Evi-1与支持细胞的增殖及毛细胞分化成熟的关系提供依据。
