裸花紫珠治疗烧烫伤模型大鼠活性部位的筛选及其作用机制研究
2019-04-27罗喻超刘辰鹏黄明浩张俊清姚瑰玮
罗喻超,刘辰鹏,黄明浩,张 仲,张俊清,姚瑰玮
海南医学院药学院,海口 571119
裸花紫珠CallicarpanudifloraHook.et Arn.为马鞭草科紫珠属植物,主要分布于我国广东、广西和海南等地[1]。作为海南大宗性地道药材,也是海南黎族药之一,主要分布于海南白沙、五指山和琼中等地。裸花紫珠可全年采收,取地上干燥部分,去除杂质,有抗菌止血、消炎解毒、散瘀消肿、祛风祛湿之功效,主治化脓性炎症、急性传染性肝炎、呼吸道及消化道出血、创伤出血等症,外用治疗烧、烫伤及外伤出血等,现代研究表明,裸花紫珠主要含有黄酮、鞣质、萜类和酚类等成分[2-4]。
目前对裸花紫珠的研究主要以止血为主,针对裸花紫珠治疗烧烫伤的功效及其活性部位与作用机制方面的研究较少[5]。裸花紫珠提取物可抗感染、促进上皮生长和加快创面愈合这对裸花紫珠治疗烧烫伤的研究提供了基础和方向。本文以正丁醇、乙酸乙酯、石油醚及水层萃取裸花紫珠流浸膏的不同活性部位,并以大鼠烫伤面积大小、伤口性状,如颜色、软硬程度、血清中TGF-β1和VEGF浓度等为指标,探究裸花紫珠治疗烧烫伤的活性部位及作用机制,为进一步研究提供依据。
1 实验材料
1.1 药材与试剂
裸花紫珠药材采自海南省白沙县,经海南医学院药学院田建平教授鉴定为马鞭草科紫珠属马草科裸花紫珠(Callicarpanudiflora)的地上部分。正丁醇、乙酸乙酯、石油醚均为国产试剂,购买于广州化学试剂厂;硫化钠(苏州康硕化工有限公司);苯扎溴铵(山东利尔康医疗科技股份有限公司);水合氯醛(上海贝合化工有限公司),所有试剂均为分析纯,水为超纯水。京万红烫伤膏(SSD)(昆明圣火药业有限公司);4%多聚甲醛通用型组织固定液(Bio sharp);大鼠血管内皮生长因子(VEGF)ELISA检测试剂盒、大鼠转化生长因子β1(TGF-β1)ELISA检测试剂盒由苏州卡尔文生物科技有限公司提供。
1.2 实验动物
清洁级SD大鼠,雄性,体重180~200 g,由广东省医学实验动物中心提供(许可证号:SCXK(粤)2013-0002,质量合格证号:No.44007200039675)。
1.3 仪器
RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);SO9001型电子天平(北京赛多利斯仪器系统有限公司);均浆机(天津津立仪器设备科技发展有限公司);高速离心机(深圳市科力易翔仪器设备有限公司);集热式磁力搅拌器(上海拜澜仪器设备有限公司);Spectra Max 190全波长酶标仪(美国Molecular Devices)。
2 材料与方法
2.1 药物的制备
称取裸花紫珠药材粉碎成粗粉,加入纯净水浸泡2 h,加热回流提取3次,加水量分别为药材质量的12、10、10倍。每次提取1 h后过滤,合并3次滤液,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105 °C干燥24 h,迅速转移至干燥器中冷却0.5 h,所得浸膏即为裸花紫珠水提取物,平均浸膏得率为20.0%[6]。
取裸花紫珠水提取物浸膏,加适量水溶解,根据溶剂提取法按1∶1比例分别用石油醚、乙酸乙酯和正丁醇萃取两次,超声15 min后离心,取上层,得到石油醚部位,乙酸乙酯部位,正丁醇部位3个样。各萃取部位加热减压回收溶剂,浓缩至流浸膏状。剩余水层部分亦浓缩至流浸膏状。以上部位分别记为裸花紫珠石油醚部位、乙酸乙酯部位、正丁醇部位、水层部位,以裸花紫珠原药材质量计算,得率依次为6.0%、3.5%、2.3%、8.2%,加上前述水提取物共5个提取部位,分别用卡波姆以35∶1混合均匀,得到稠度适宜的药膏一同进行抗烫伤药效学研究。
2.2 药效学实验
2.2.1 烫伤造模与治疗
将SD大鼠背部的毛用剃须刀剃除约16 cm2(约4 cm×4 cm),剩余的短毛用6%的硫化钠溶液浸润一分钟左右,用棉球除去,再用清水冲洗干净。造模采用Walker[5]和Stevenson[6]的方法,进行适当的微调。即先用水合氯醛腹腔注射300 mg/kg麻醉SD大鼠,然后用90 °C热水在大鼠背部脱毛处烫10 s,伤口大小约为7.5 cm2(3 cm×2.5 cm)。烫伤后,所有大鼠随机分为7组,每组10只,分别为模型组、裸花紫珠水提取物组、裸花紫珠流浸膏水层组、裸花紫珠石油醚部位组、裸花紫珠乙酸乙酯部位组、裸花紫珠正丁醇部位组、京万红烫伤软膏剂实验组(SSD)。在造模24 h后,各组在伤口处分别均匀涂抹0.3 g对应药膏,模型组涂抹等质量卡波姆。每日给药一次,给药后用医用纱布包裹伤口,持续4周,各组大鼠分笼单独饲养,防止互相撕咬伤口。在大鼠给药后用医用纱布包裹伤口,以隔离药膏气味,减少实验误差。
2.2.2 伤口愈合率
每日同一时间给药,观察伤口并记录伤口的颜色、软硬程度、分泌与肿胀情况。在烫伤后第1、5、8、12、15、18、21天,将大鼠固定于带长度刻度的网格板上,拍照。再用Image J软件处理,按照片中网格板刻度调整图片对应实际大小一致,计算伤口的面积。在测量大鼠伤口面积时容易产生误差,通过采用测量板及去极值等方法,减少实验误差。
计算愈合后剩余伤口百分率公式为:
某日剩余伤口百分率=某日的伤口面积/最初的伤口面积×100%[7]
2.2.3 样本的采集与处理
在烫伤后第2、7、14和21天对大鼠进行眼眶后取血,取约2 mL血液,静置20 min后,以3 000 rpm离心5 min,取上层血清,保存血清于-80 °C冰箱中备用。在第21天,以10%水合氯醛腹腔注射(0.3 mL/100 g)麻醉老鼠后,将伤口剥离深至肌层,之后脱颈处死大鼠。取部分伤口组织,用4%多聚甲醛固定液固定、石蜡切片、切片用HE染色。染色后观察创伤表皮中汗腺、炎细胞浸润、纤维组织增生、组织变性坏死和钙化等。
2.2.4 大鼠血清中 TGF-β1和VEGF含量测定
采用酶联免疫法(Elisa)测定大鼠血清中TGF-β1和VEGF含量。依照ELISA试剂盒的说明书进行操作,Spectra Max 190全波长酶标仪测定检测板各孔吸光度,计算对应的细胞因子浓度。
2.3 数据处理

3 结果与分析
3.1 宏观观测结果
将调整刻度一致后的各组大鼠不同时间伤口照片排列到一起,可直观观察各组大鼠伤口恢复情况。
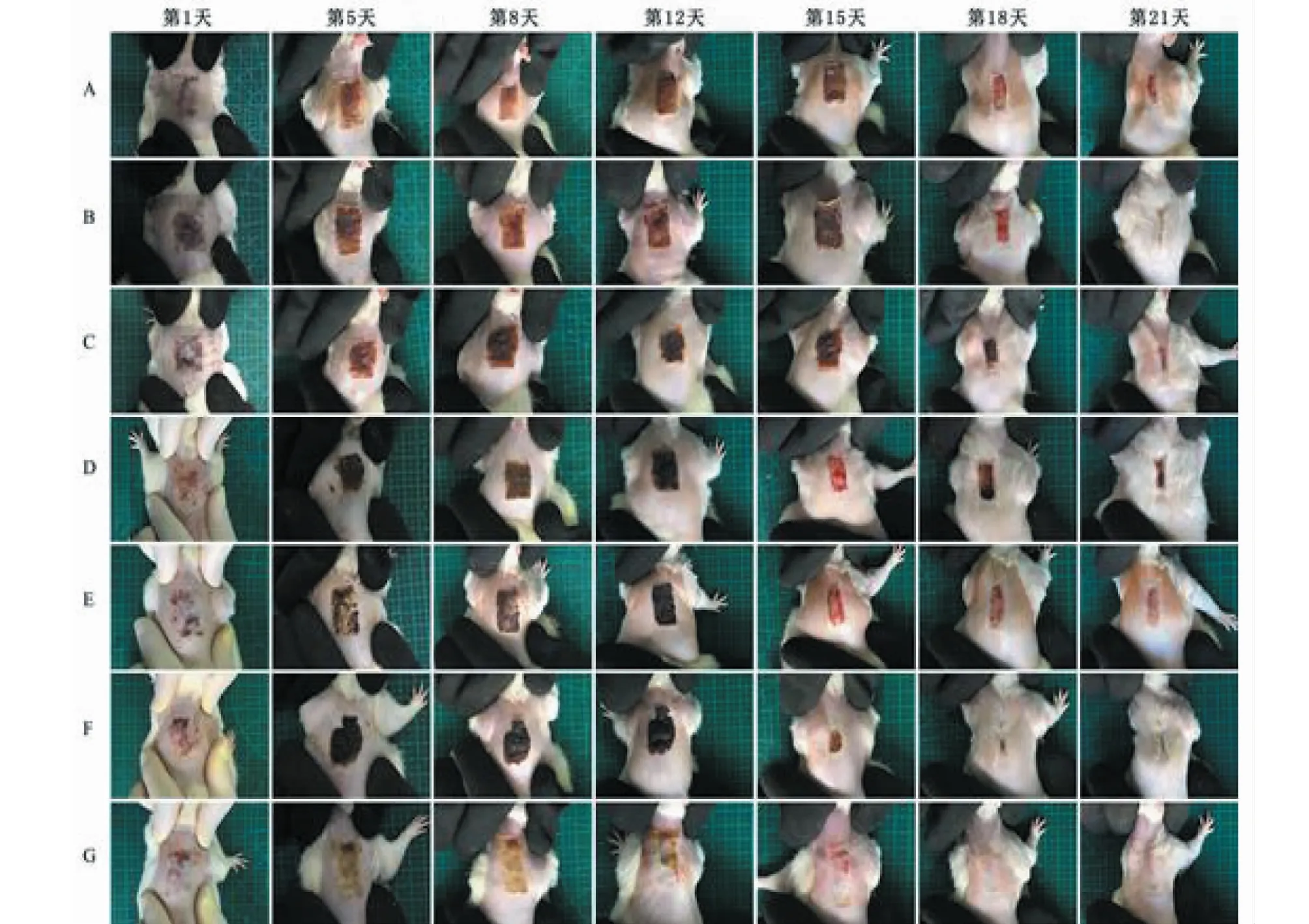
图1 伤口的总体观测Fig.1 General observation of the wound注:A.模型组 B.石油醚 C.乙酸乙酯 D.正丁醇 E.水提取物组 F.水层组 G.SSD组。Note:A.Model group B.Petroleum ether group C.Ethyl acetate group D.Butanol group E.Water extract group F.Water layer group G.SSD group.
结果见图1,从第1天到第12天,SSD组药膏与伤口较好的黏合,伤口比较湿润、变软,伤口痂皮较薄,有少许组织液渗出;水层跟模型组伤口有较多组织液渗出,炎症现象较明显;由于裸花紫珠浸膏本身的颜色,水提取物组及水层组的伤疤颜色较深;石油醚组与正丁醇组的伤疤表现为干燥、厚实,呈深棕色。每组的伤疤处都有一定的出血和分泌物流出。
第15天后,各组的伤口均不同程度的好转,出血及组织液渗出现象消失,正丁醇组、石油醚组与水提取物组的伤疤较其它各组明显要薄。第18天,正丁醇组、与石油醚组与水提取物组的伤口愈合程度明显高于其它各组,其中水提取物组与石油醚组的伤口愈合程度最高。
第21天,水提取物组与石油醚组的愈合程度最好,伤口已基本愈合,皮肤弹性好且高度与正常皮肤无异,创伤处表皮光滑,颜色也接近于正常皮肤。
3.2 组织病理学切片检查
如图2所示,模型组可见包含有炎症细胞的大面积溃疡形成,在真皮层中有轻度的炎症和中度的出血,表皮有严重的剥落和结痂,这都表明伤口未完成愈合。

图2 各组大鼠伤口病理切片图(HE染色)Fig.2 Pathologic sections of wound (HE staining) in each group of rats注:A.模型组 B.石油醚组 C.乙酸乙酯组 D.正丁醇组 E.水提取物组 F.水层组 G.SSD组(图ACEG 200×,图BDF 100×)。Note:A.Model group B.Petroleum ether group C.Ethyl acetate group D.Butanol group E.Water extract group F.Water layer group G.SSD group (Figure ACEG 200 x,Figure BDF 100 x).
水层组大鼠病理切片可见包含有炎症细胞的大面积溃疡形成,在真皮层中有轻度的炎症和轻度的出血,表皮有剥落和结痂,与模型组的结果相似。SSD组与水提取物组大鼠病理切片中,可见表皮有轻度的增生,真皮层完整,真皮内有大量汗腺生成,成纤维细胞产生较多胶原纤维,同时成纤维细胞数量减少、胞核变细长,变为纤维细胞,表明伤口已基本愈合,与模型组形成鲜明的对比。石油醚组与正丁醇组大鼠病理切片中,可见与SSD组和水提取物组结果相似,表明伤口已基本愈合。乙酸乙酯组大鼠病理切片可见表皮大部分坏死组织脱落,表皮爬行于创缘表面,有较多成纤维细胞及毛细血管的生成,真皮层中有轻度的炎症细胞浸润。治疗效果稍好于模型组,但依然没有完全愈合。综上,组织病理学检查的结果与总体观测的结果基本吻合。
3.3 伤口面积的测量
如表1所示,前8天中各组的剩余伤口百分率基本在同一水平。但在12天之后,水提取物组剩余伤口百分率最小,石油醚组与正丁醇组次之,且均与模型组有较大差异;石油醚组剩余伤口百分率与乙酸乙酯和水层组有较大差异;而乙酸乙酯组与水层组均与模型组剩余伤口百分率相近;第15天起和第21天时,水提取物组与石油醚组的剩余伤口百分率要显著低于模型组(P<0.05),其中水提取物组的最低。
3.4 血清中TGF-β1和VEGF浓度变化分析
采用ELISA法测定各组大鼠不同时间点血清中TGF-β1、VEGF浓度,结果见表2。第21天时,可见石油醚组与水提取物组的TGF-β1水平低于模型组,有显著性差异;第7天时,石油醚组的VEGF水平高于模型组,有显著性的差异。
4 结论
烫伤的愈合可分为三个有重叠的阶段,依次为炎症期、组织增生重塑期和成熟期[8]。石油醚组的VEGF浓度在早期出现了明显的上调。进入组织增生重塑期后,水提取物组伤口愈合最好,石油醚组和正丁醇组次之,裸花紫珠促进伤口愈合的功效在这一阶段开始体现。在最后组织增生的成熟期,水提取物组的表皮和真皮恢复得最好,伤疤最小,石油醚组次之。在第21天时,TGF-β1的表达水平最低。表明裸花紫珠可能是通过TGF-β1信号通路来减少疤痕的形成。

表1 不同恢复时间各组剩余伤口百分率变化
注:n=7,与模型组比较,*P<0.05;**P<0.01。
Note:n=7,Compare with control,*P< 0.05;**P< 0.01.

表2 血清中TGF-β1、VEGF的浓度变化
注:n=7,与模型组比较,*P<0.05;**P<0.01。
Note:n=7,Compare with control,*P< 0.05;**P<0.01.
在TGF-β因子家族中,有很多因子与组织的形成和修复有关[9]。而在血管再生、胶原合成、细胞外基质的沉积和皮肤瘢痕的形成等伤口愈合的一系列过程中,TGF-β1是一个十分重要的因子[10]。TGF-β1作为一个促进伤口愈合的因子过度的表达会造成伤口的过度愈合,进而增加疤痕的形成。因此,在伤口愈合的后期,低浓度的TGF-β1可以减少疤痕的形成。血管内皮生长因子(VEGF)是在皮肤中最有效的促血管生成的生长因子之一,其表达水平的高低可以影响皮肤修复的速度和质量[11]。VEGF有助于伤口挛缩,VEGF表达不足会导致伤口愈合异常,但高水平的VEGF可以加剧瘢痕组织的形成[12,13]。
综上所述,在大鼠深二度烫伤模型中,裸花紫珠流浸膏水提取物治疗效果最好,石油醚层与正丁醇组次之,石油醚层组与正丁醇层组相较与乙酸乙酯组、水层组的治疗烫伤效果更强,初步猜测裸花紫珠治疗烧烫伤的活性部位在石油醚层或正丁醇层中;裸花紫株水提取物组相较于SSD都表现出更强的促进伤口愈合的功效,并能减少伤疤的形成。这些功效的作用机制可能是由于在早期裸花紫珠使VEGF上调,有助于伤口挛缩,在后期下调了TGF-β1使得伤疤形成的减少。裸花紫珠治疗烧烫伤具体活性成分还需要做进一步的验证和探究。
