奶牛源金黄色葡萄球菌新疆分离株生物被膜、肠毒素基因与毒力的检测及其相关性分析
2019-04-27伍晔晖孟庆玲蔡扩军王登峰才学鹏
伍晔晖,孟庆玲,乔 军*,李 静,蔡扩军,王登峰,才学鹏
(1.石河子大学动物科技学院, 新疆 石河子 832003; 2. 乌鲁木齐市动物疾病控制与诊断中心,新疆 乌鲁木齐 830063;3. 新疆畜牧科学院兽医研究所,新疆 乌鲁木齐 830000; 4. 中国农业科学院兰州兽医研究所,甘肃 兰州 730046)
【研究意义】金黄色葡萄球菌(Staphylococcusaureus)在兽医临床上可引发奶牛乳房炎及子宫内膜炎等多种疾病,严重危害奶牛养殖业的健康发展[1-2]。【前人研究进展】S.aureus侵染宿主后,可产生多种毒力因子并形成生物被膜(biofilm,BF),使宿主的免疫系统受到抑制,并导致细菌对抗生素的耐受性增强,造成持续性感染[3]。同时,牛乳中含有的S.aureus及其分泌的毒素可引起人的感染或严重的食物中毒,在细菌性食物中毒事件所占比例高达33 %~50 %[4-5]。【本研究切入点】研究发现,S.aureus产生的肠毒素是其重要的毒力因子,在其感染和定殖过程中发挥重要的作用。肠毒素是一种具有超抗原活性且高度耐热的外毒素,它是引发食物中毒及食源性疾病的主要毒力因子[7]。目前,已发现的肠毒素包括传统型肠毒素(sea~see)和新型肠毒素(seg~seu)。在传统型肠毒素中,sea和seb是引起食物中毒较常见的肠毒素[8]。此外,S.aureus形成的BF可抵抗化学药物和宿主防御系统,与细菌的耐药性和致病性密切相关。【拟解决的关键问题】本研究通过对164株S.aureus新疆分离株进行BF形成能力、肠毒素基因sea~seo分布及半数致死量(LD50)的检测,旨在了解奶牛源S.aureus肠毒素基因的分布特征和致病特性,为研究分析S.aureusBF形成能力与其毒力之间的相关性奠定基础。
1 材料与方法
1.1 受试菌株
在2015-2018年期间,从新疆部分地区奶牛场采集乳房炎牛乳(276份)和子宫内膜炎(110份)样品共计386份,先通过选择性分离培养基初步筛选,再进行生化试验鉴定,最后进行16SrRNA序列比对分析得到S.aureus临床分离株164株。
1.2 主要试剂
Baird-Parker培养基、甘露醇高盐琼脂、脑心浸出液肉汤(BHI)、胰蛋白胨大豆肉汤(TSB)均购自青岛高科园海博生物技术有限公司;科玛嘉金黄色葡萄球菌显色培养基购自CHRO Magar 公司;细菌基因组DNA提取试剂盒、DNA Marker 2000、pMD19-T载体均购自TaKaRa公司;结晶紫购自天津市北联精细化学品开发有限公司。
1.3 奶牛源S. aureus临床分离株生物被膜形成能力的测定
采用结晶紫半定量黏附实验(microtiter plate assay,MPA)进行奶牛源S.aureus临床分离株生物被膜形成能力的测定。用无菌接种环挑取单个菌落,接种于TSB培养基中,振荡过夜。将活化的菌液以1∶100的比例转接于TSB肉汤中继续培养,在OD600nm≈0.2时吸取菌液200 μl加入到96孔微孔板中,静置于37 ℃培养24 h,参照文献[9]用酶标仪测定其A570nm值。将测定结果转换成cut-out值:ODC=OD(阴性对照)+3×SD(阴性对照);待检孔OD值=OD平均-ODC。将菌株生物被膜形成能力分为4类:①OD≤ODC=无生物被膜产生(-,BF-);②ODC 将S.aureus流行株接种至无菌BHI培养液于37 ℃振荡过夜,取1.5 mL细菌培养液于无菌EP管内,12 000 r/min离心1 min,弃上清液,用细菌基因组DNA提取试剂盒提取菌株基因组DNA,通过 PCR 方法对sea~see和seg~seo等基因进行扩增,各基因引物序列及PCR反应体系参考文献[6]。引物由北京华大基因公司合成,肠毒素基因经PCR扩增后,用2 %琼脂糖凝胶电泳检测。 选择8株生物被膜形成能力不同的S.aureus分离菌株,菌株编号分别为:3、49(BF3+);A2、73(BF2+);A1、90(BF+);45、91 (BF-),将S.aureus流行株接种至20 mL无菌BHI培养液于37 ℃、180 r/min振荡培养12 h,根据生长曲线的A600nm适当调整菌液浓度,参照GB4789.2-2010进行活菌计数,计算实际感染菌量。 参照预试验结果将18~22 g昆明系小鼠随机分成8组,每组分为5个梯度,每个梯度5只,分别给不同组别小鼠腹腔注射500 μl CFU等差菌液,感染后每4 h观察1次小鼠精神状态及外观体况,连续7 d后统计各组小鼠的死亡情况,利用改良寇氏法计算不同BF形成强度菌株对昆明系小鼠的半数致死量(LD50)。计算公式:logLD50= [Xm-i(∑P-0.5)],其中Xm为最大剂量的对数;P为各组动物的死亡率(以小数表示);∑P为各组动物死亡率的总和(P1+P2+P3……);i为组间距(相邻两组对数剂量的差值)。 剖杀感染小鼠,观察其组织器官的病理变化;无菌取病死鼠的组织器官涂片、触片,革兰染色镜检,并以S.aureus特异性引物作PCR鉴定。试验结束时,扑杀试验组(BF3+、BF-)剩余小鼠,无菌条件下取试验组及对照组小鼠的肝、脾、肺、肾和小肠等组织器宫,将同组小鼠器官各取一小块置于1.5 mL灭菌EP管中用于测定组织器官的载菌量。取剩余组织块,用4 %甲醛溶液固定,制备组织切片,HE染色后观察病理组织学变化。 表1 164株金黄色葡萄球菌生物膜形成能力的测定 无菌取病死鼠的肝、脾、肺、肾和小肠等组织器官,用微量电子天平称量装有组织块的EP管重量m1,向管内加入200 μl生理盐水,用电子组织匀浆器充分研磨后进行10倍梯度稀释,称量空EP管重量m2,将各浓度组织匀浆液吸取200 μl接种于甘露醇高盐琼脂,37 ℃孵育48 h,记培养基表面菌落数为n,载菌量=n/(m2-m1)。 采用MPA 试验对164株S.aureus流行株进行BF形成能力进行检测分析,OD570nm检测证实BF-菌株有23株(13.6 %),形成BF阳性菌株有141株(83.4 %);其中BF+菌株有69株(40.8 %), BF2+菌株有38株(22.5 %),BF3+菌株有34株(20.1 %,表1) 。 不同分离株肠毒素检测结果(图1)显示,在164株S.aureus中检测到肠毒素基因(sea~seu)流行率为96.3 %,其中以新型肠毒素seg基因检出率最高为81.1 %,sek和sej基因检出率分别为76.8 %和57.3 %;传统型肠毒素基因(sea~see)的检出率为62.8 %,其中see基因检出率最高(57.3 %);传统肠毒素和新型肠毒素分别以sed(8.5 %)和sel基因(20.7 %)检出率最低。从不同BF形成能力菌株所携带肠毒素基因情况的结果显示(图2),浮游菌BF形成能力与肠毒素检出率之间无明显相关性。 图A中:M.DNA Marker 2000; 1. sea基因(287 bp) 2. seb基因(213 bp); 3. sec:基因(454 bp); 4. sed基因(152 bp) 5. see基因(293 bp)。图B中:M.DNA Marker 2000; 1. seg基因(287 bp) ;2. seh基因(213 bp);3. sei基因(454 bp);4. sek基因(293 bp);5. sej基因(152 bp);6. sel基因(383 bp);7.sem基因(379 bp);8. sen基因(282bp);9. seo基因(214 bp)图1 S. aureus检测肠毒素基因检测结果Fig.1 Detection of enterotoxin genes in S. aureus isolate 图2 S. aureus肠毒素基因在不同BF形成能力菌株中阳性分布结果Fig.2 Positive distribution results of S. aureus enterotoxin gene in different BF forming strains BF形成能力不同的4组菌株 (BF3+:3、49; BF2+:A1、90; BF+:A2、73;BF-:45、91),BF3+菌株与BF+菌株、BF-菌株之间毒力均差异显著(P<0.05),BF3+菌株LD50值大,提示BF3+菌株毒力较弱(图3)。 病鼠各组织器官出现广泛病变,肝脏淤血、肿大;脾脏肿大、坏死,在表面和切面上可见多个大小不等的坏死灶;肺淤血、肿大,表面有脓肿;肾脏肿大、色淡;胃粘膜表面出现脓性溃疡灶;肠系膜及浆膜小血管扩张、充血并伴有炎性渗出。对照组小鼠肉眼未见异常病变(图4)。 剖检死亡小鼠,取小鼠肝脏及肾脏的匀浆液接种于Baird-Parker平板上,均能分离出S.aureus,菌落周围有浑浊带;以特异性引物16SrRNA进行PCR检测结果均为阳性。肝脏:肝细胞发生颗粒变性、水泡变性,肝小叶界限不清,中央静脉扩张、肝汇管区小静脉淤血;脾脏:淤血,红、白髓界限不清,红髓有多量的红细胞渗出,脾小体减少且萎缩;肺脏:淤血,肺间质血管周围水肿和出血,浆细胞和淋巴细胞浸润;肾脏:肾小球扩张,肾小管上皮细胞变性,间质血管扩张,浆细胞和淋巴细胞浸润。小肠:肠黏膜脱落,肠腺细胞水肿,肠腔内有蓝染网状物,黏膜层的部分肠腺内有多量大小不一红染圆形颗粒物(图5)。 图3 BF形成能力不同S. aureus的LD50Fig.3 Biofilm-formation ability of different S. aureus LD50 in Kunming mice BF-菌株对小鼠肝、脾、肺、肾和小肠的组织器官的侵袭力强于BF3+菌株(P<0.05);载菌量最大的脏器为肾脏(3.73±2.36~3.50±1.84),肝脏载菌量较低(1.15±0.21~0.99±0.23,表2)。 BF是细菌为了适应应激环境而形成的一种具有特殊结构的细菌聚集膜状物[10]。与浮游状态相比,生物被膜状态下同种细菌对抗生素的耐受性可提高100~1000倍,且可抵抗宿主对其的吞噬作用[11-12],因此探讨BF形成能力差异菌株的基因及致病性具有重要意义。本研究中164株S.aureus有141株为MPA阳性,BF形成率为83.4 %,证实奶牛源S.aureus流行株具有普遍的BF形成能力,且以弱BF形成菌株为主。 S.aureus肠毒素(SEs)是一种外源性超抗原,它能激活大量产生促炎细胞因子和趋化因子,可导致发热、低血压和休克[6, 13],因此是食品生产中的重点监测对象。本研究通过PCR方法对临床分离的S.aureus肠毒素毒力基因检测结果显示,肠毒素基因(sea~seu)流行率为96.3 %,其中以新型肠毒素seg基因检出率(81.1 %)最高;传统型肠毒素基因(sea~see)的检出率为62.8 %,其中以see基因检出率(57.3 %)最高;传统型肠毒素和新型肠毒素分别以sed和sel基因检出率最低,分别为8.5 %和20.7 %。汪永碌等[14]从食物中毒和食物样品中分离出S.aureus的肠毒素基因(sea~sej)检出率为68.6 %,传统型肠毒素基因(sea~see)检出率为 88.5 %,其中以seb检出率最高;Wang等[15]对中国宁夏地区奶牛乳房炎牛奶样品中分离出的S.aureus进行肠毒素基因(sea~seu)检测,结果显示71.4 %的分离株至少携带一种肠毒素基因,其中sei和sen检出率最高(44.0 %)。Nazari等[16]研究发现sea、seb基因及新型肠毒素基因seg、seh是牛奶中S.aureus检出率最高的肠毒素基因。上述研究提示不同地区S.aureus分离株肠毒素基因的分布具有地域多样性。本研究将S.aureus流行株以不同BF形成能力进行分组检测,肠毒素基因检出率无明显的差异,提示S.aureus携带肠毒素基因与其BF形成能力无直接的相关性。 从左向右依次为BF-、BF3+及对照组From left to right, the order is BF-, BF3+ and the control group图4 小鼠肾、肺、肝和脾的病理学变化Fig.4 Pathological changes in kidneys, lungs, liver and spleen of mice with S. aureus 图5 小鼠肺,脾,肝和肾的代表性组织病理学特征Fig.5 Representative histopathological features in lungs, spleen, liver and kidneys of mice with S. aureus 表2 BF3+、BF-菌株接种小鼠各脏器脏器载菌量的比较(±s) S.aureus在体内环境中可形成BF抵抗宿主的免疫反应;在有利条件下又可浮游菌形式感染宿主,造成S.aureus持续性感染[17-19]。本研究对比了8株BF形成能力不同S.aureus的LD50,结果显示BF3+菌株毒力弱,而BF+菌株及BF-菌株毒力强;且BF-菌株对脏器的侵袭力强于BF3+菌株。研究结果与陈传荣等[20]对不同BF形成能力致病性大肠杆菌的毒力强弱结论相似。有研究报道,细菌形成BF可影响浮游菌毒力因子的释放,这可能是细菌毒力减弱的原因之一[21]。Li 等[22]对比了铜绿假单胞菌BF菌与浮游菌毒力差异,结果显示BF菌株毒力基因表达低于浮游菌近30倍,且bdIA缺失株致病性在慢性感染中毒力更强,而在急性感染中毒力较弱[23]。因此,S.aureus形成BF后毒力会发生改变可能与细菌逃避免疫的适应性调节机制相关[22]。 本研究证实,新疆地区奶牛源S.aureusBF形成率高,且肠毒素基因检出率较高,其中以新型肠毒素基因seg检出率最高,提示新型肠毒素seg基因是奶牛源S.aureus新疆分离株的重要分子特征。S.aureus浮游菌株BF形成能力与肠毒素检出率之间无明显相关性,但随着生物被膜形成能力的增强,LD50相应增大。由于BF的存在是治疗S.aureus性奶牛乳房炎及子宫内膜炎面临的一大难题,因此S.aureusBF在致病性上发挥的作用以及与毒力之间的内在关系值得深入分析。1.4 S. aureus分离株肠毒素基因检测
1.5 不同BF形成能力菌株菌液的制备
1.6 不同BF形成能力菌株半数致死量(LD50)的测定
1.7 不同BF形成能力菌株感染小鼠脏器病理组织学观察

1.8 不同BF形成能力菌株人工感染小鼠组织器官载菌量分析
2 结果与分析
2.1 S. aureus分离株生物被膜形成能力检测
2.2 S. aureus分离株携带肠毒素基因的检测
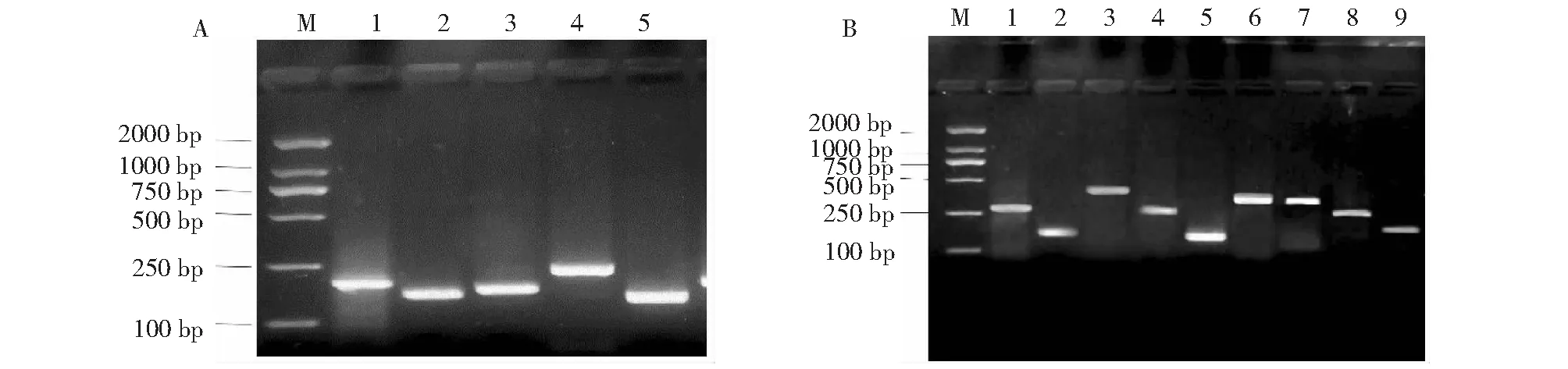
2.3 不同BF形成能力菌株LD50的测定
2.4 不同BF形成能力菌株感染小鼠的病理学变化
2.5 不同BF形成能力菌株感染小鼠的病理组织学观察
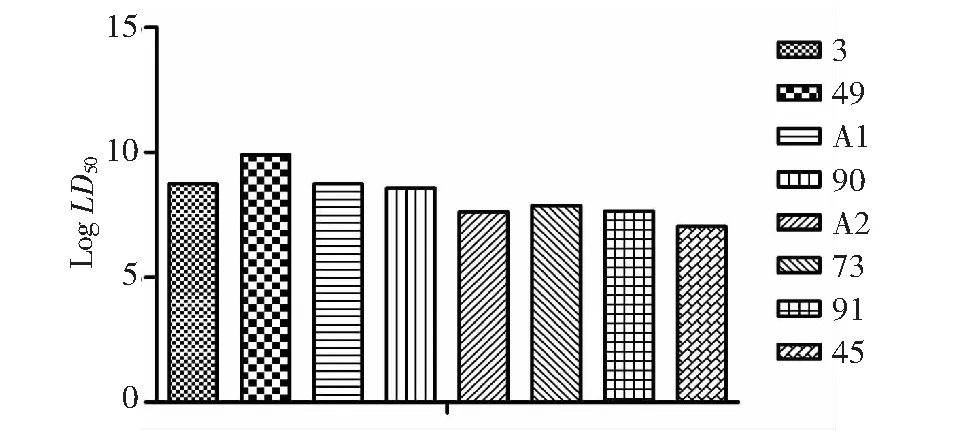
2.6 不同BF形成能力菌株感染小鼠的组织器官载菌量分析
3 讨 论



4 结 论
