澳洲茶树干旱胁迫下保护酶活性及代谢产物含量变化规律
2019-04-26刘海龙覃子海肖玉菲张晓宁陈博雯
刘海龙,覃子海,张 烨,肖玉菲,张晓宁,陈博雯
(广西壮族自治区林业科学研究院 国家林业局中南速生材繁育实验室广西优良用材林资源培育重点实验室,南宁 530002)
澳洲茶树(Melaleuca alternifolia)为桃金娘科(Myrtaceae)白千层属植物,又名互叶白千层,常绿小乔木,原产于澳大利亚。澳洲茶树树皮灰白色,厚而松软,呈薄层状剥落,所以又名“千层树”。叶互生,披针形或线形,具油腺点。花白色,密集于枝顶成穗状花序。由于从该植物中提取的茶树精油有重要的商业价值,20世纪90年代初我国开始引进澳洲茶树,在南方多省区种植[1-2]。项东云等[3]通过948引进项目系统地开展澳洲茶树引种、良种选育、繁育、种植和加工利用技术研究。吴丽君等[4]、刘海龙[5-7]等较系统地开展了澳洲茶树组培技术研究,形成了澳洲茶树组培工厂化育苗系列技术。此外,广西林科院、福建林科院等单位分别筛选出4-松油醇型和1,8-桉叶素型澳洲茶树的优株[2,8-9],并通过无性繁殖,实现了优良无性系的大规模推广种植。
组培技术的突破以及良种的保障,确保了澳洲茶树种植加工项目的高收益。据估算,在广西等地种植澳洲茶树,第1年枝叶产量可达3 t,可提取澳洲茶树精油36 kg(按1.2%的得油率),产值可达7 200元(按20万/t的精油价格),提取精油后的枝叶还可用于熬制多糖多酚45 kg(按1.5%的得率),产值可达9 000元(按20万/t的价格),两项相加产值可达24.3万元/(hm2·a)。第2年起,枝叶产量超过4 t,产值相应提高。此外,澳洲茶树枝叶还可生产其它系列产品,如黄酮浸膏、茶树纯露、生物质燃料等。
澳洲茶树在我国种植已近20年,在平地、丘陵、山地均有种植,种植地气候类型也各有不同,但对澳洲茶树抗旱性的研究尚未见开展。本研究拟对澳洲茶树干旱胁迫下的保护酶活性及代谢产物含量进行测定,以初步了解澳洲茶树在干旱胁迫下的反应机制,为深入了解澳洲茶树的抗旱性能,有效推广澳洲茶树种植,保证产量,提供一定的理论依据。
1 材料和方法
1.1 试验材料
采用盆栽试验,盆口直径40 cm,高30 cm,每盆装土20.0 kg。使用广西林科院所培育的4-松油醇型澳洲茶树良种组培苗种植半年后的植株作为供试材料,土壤为第四纪红壤,质地为轻黏土,土壤中有机质、全氮、全磷、全钾平均含量分别为11.3、0.14、0.16、6.43 g/kg。盆栽最大土壤持水量为43.4%。
1.2 干旱胁迫
试验在广西林科院生物所(108.35°E,22.92°N)进行,白天气温27.0~37.5℃,夜间气温22.5~26.0℃,相对湿度55%。本研究共种植15盆澳洲茶树,试验苗木在处理前连续浇水3 d,然后让其自然干旱。从2018年8月17—31日,连续胁迫处理15 d。土壤中相对含水量采用电子秤(精度0.001 kg)称质量法测定,每隔1天称质量1次。土壤相对含水量=(土壤质量-土壤干质量)/(土壤饱和质量-土壤干质量)×100%。
1.3 生理指标测定
1.3.1 酶活性的测定
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)以及过氧化物酶(POD)活性的测定采用李合生[10]的方法;硝酸还原酶(NR)活性测定采用徐龙光[11]的方法;谷胱甘肽过氧化物酶(GSH-PX)活性的测定采用邓修惠等[12]的方法。以上生理指标每间隔1天测定1次。
1.3.2 代谢产物的测定
脯氨酸(Pro)的测定采用茚三酮显色法[13],可溶性糖含量的测定采用蒽酮法[14],每间隔1天测定1次。
1.4 数据分析
利用SPSS 17.0和Excel 2016对数据进行统计和分析,全部数据是3次重复实验的平均值±标准误差。
2 结果
2.1 不同时间的土壤相对含水量
横坐标表示月份-日期,纵坐标表示相对含水量(图1)。相对含水量随着胁迫时间延长而逐渐降低,8月23日后趋稳。
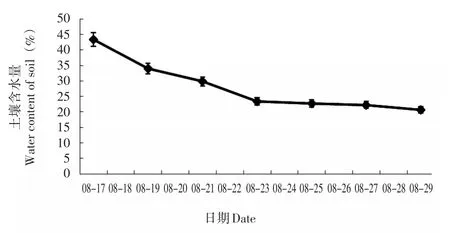
图1 不同时间的土壤相对含水量Fig.1 Relative water content of soil at different times
2.2 干旱胁迫对澳洲茶树保护酶活性的影响
过氧化物酶(POD)活性及谷胱甘肽过氧化物酶(GSH-PX)活性的变化趋势基本相同,都表现出随着时间推移逐步下降的趋势(图2、6)。POD活性在前3天(17—19日)下降幅度较大,后期趋缓,25日后接近为0。GSH-PX活性在19—23日下降幅度较大,后期趋缓,27日后接近为0。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)以及硝酸还原酶(NR)活性的变化趋势基本相同,其活性均为前期升高,后期降低的趋势(图3、4、5)。SOD活性上升及降低趋势均较缓,后期仍然能检测出超过1 500的相对活性。CAT活性在前期快速升高(17—21日),后期逐步降低,29日后接近为0。NR活性在前3天快速升高(17—19日),后期逐步降低,25日后趋近0。
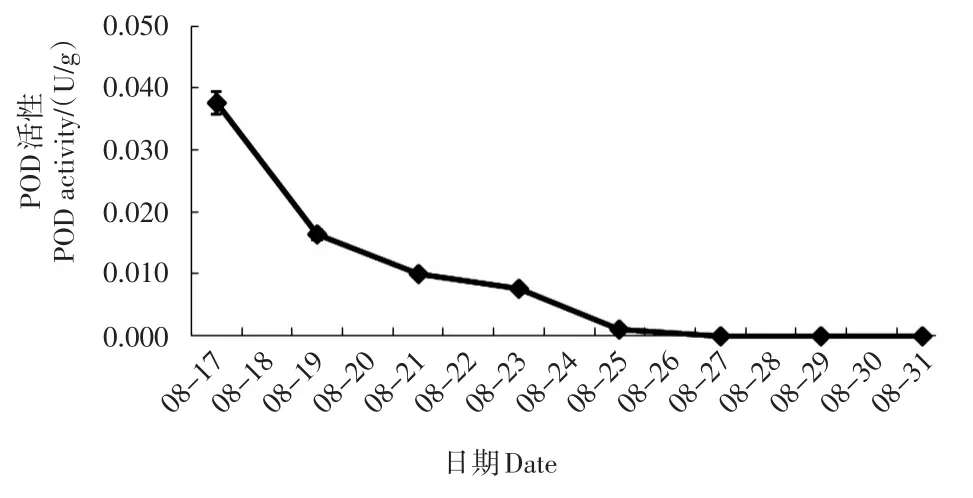
图2 不同时间的叶片POD活性Fig.2 POD activity of leaves at different times

图3 不同时间的叶片SOD活性Fig.3 SOD activity of leaves at different times
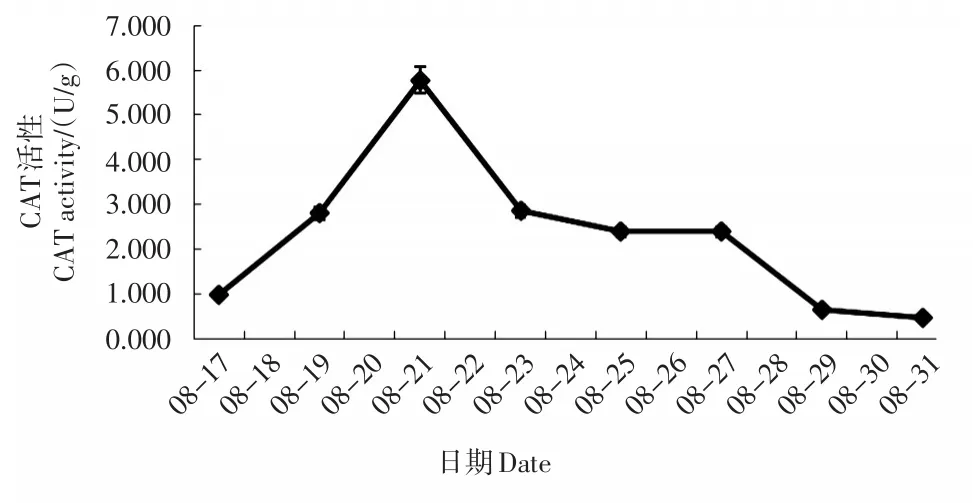
图4 不同时间的叶片CAT活性Fig.4 CAT activity of leaves at different times

图5 不同时间的叶片NR活性Fig.5 NR activity of leaves at different times
2.3 干旱胁迫对澳洲茶树代谢产物的影响

图6 不同时间的叶片GSH-PX活性Fig.6 GSH-PX activity of leaves at different times
可溶性糖含量前期呈上升趋势(17—21日),中期趋于稳定(80 mg/g左右),后期呈下降趋势(27—31日)(图7)。
脯氨酸(Pro)的含量变化为前期含量有小幅波动(17—23日),中期含量快速升高(23—25日),后期呈下降趋势(25—31日),直至接近于0(图8)。
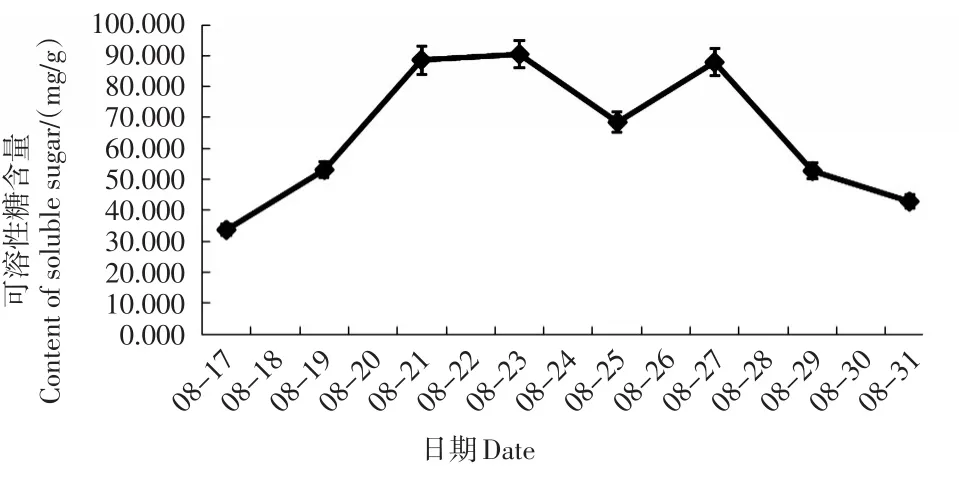
图7 不同时间的叶片可溶性糖含量Fig.7 Soluble sugar content of leaves at different times

图8 不同时间的叶片脯氨酸含量Fig.8 Proline content of leaves at different times
3 讨论
3.1 澳洲茶树抗旱性相关保护酶指标的变化
超氧化物歧化酶(SOD)、过氧化物酶(POD) 和过氧化氢酶(CAT)3种酶组成了生物体内活性氧防御系统,它们在清除超氧自由基、H2O2和过氧化物以及阻止或减少羟基自由基形成等方面发挥重要作用,在逆境胁迫时发挥着重要的自身保护功能[15]。抗旱能力强的植株往往能维持较高水平的抗氧化酶活性[16]。植物细胞对活性氧的忍受水平存在一个阈值。在阈值范围内,植株可以通过提高保护酶活性来消除自由基带来的伤害;超过这个阈值,保护酶活性会下降,活性氧的积累超过其清除能力,植株便受到损害[17]。本研究中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性表现为先升高后降低的趋势,表明这2种保护酶前期在阈值范围内能发挥出了保护酶的功效,后期超过阈值范围,则出现活性下降,失去了对植株的保护功能。本研究中过氧化物酶(POD)活性则仅仅检测出下降的趋势,可能的原因有:一可能土壤含水量下降过快,或检测时间间隔过长,导致未检测到前期上升的趋势;二可能澳洲茶树叶片中的过氧化物酶(POD)与超氧化物歧化酶(SOD)和过氧化氢酶(CAT)对干旱胁迫的反应机制有所不同。
谷胱甘肽过氧化物酶(GSH-PX)是酶促清除机制中的关键酶,其作用是催化还原型谷胱甘肽(GSH)与过氧化氢反应,阻止OH-自由基的产生,避免质膜过氧化,从而实现保护细胞膜结构和功能完整性的目的[18]。本研究中谷胱甘肽过氧化物酶(GSH-PX)的活性同过氧化物酶(POD)活性变化规律类似,仅检测到下降的变化趋势,究其原因可能也与POD类似。
硝酸还原酶(NR)是氮代谢关键酶之一,其活性直接影响植株的氮代谢,植物中氮代谢生理与抗旱性存一定的相关性,高水平的氮代谢能有效增强植物的抗旱性[19]。本研究中硝酸还原酶(NR)的活性同超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性变化规律类似,表现为先升高后降低的趋势,表明在阈值范围内NR酶能将NO3-还原成NH4+,再通过清除NH4+的累积,解除其毒害,使氮素的同化加速,从而提高氮代谢水平。超过阈值范围,NR酶活性降低,NH4+出现累积,植株受损,氮代谢水平随之降低。
3.2 澳洲茶树抗旱性相关代谢产物的变化
干旱胁迫条件下,植株可通过增加游离氨基酸含量来有效提高植株的渗透调节能力及保水性能,因此游离氨基酸含量是植株适应干旱胁迫的一个重要指标[17],但较长时间的干旱胁迫可能会使生成的游离氨基酸进一步分解。本研究中,干旱胁迫使澳洲茶树植株游离脯氨酸含量显著增加,与郝敬虹等[20]的研究结果基本一致,后期脯氨酸分解,检测到的含量逐步降为0。
干旱胁迫下,可溶性糖能有效降低叶片渗透势、维持细胞膨压,阻止水分丧失,达到保水目的,从而进行自身调节,适应干旱环境条件[21]。细胞质中可溶性糖含量的大量增加,有效提高了植物细胞渗透调节能力,减低了对质膜的伤害,对植物抵抗逆境十分重要[22]。本研究中可溶性糖前期升高,中期趋于稳定,与常丽等[21]的研究结果一致,即可溶性糖含量表现为重度胁迫条件下最大,干旱处理有利于可溶性糖含量的积累。后期可溶性糖含量降低,推测为细胞受损,导致可溶性糖流失所至。
综上所述,干旱处理条件下澳洲茶树叶片中有3种保护酶活性上升(SOD、CAT、NR),表明这3种酶启动了保护机制,以应对逆境。另外2种保护酶(POD、GSH-PX)则未检测到活性上升和启动保护的情况,说明不同物种对干旱胁迫的应对机制及参与反应的酶种类有所不同。干旱胁迫情况下代谢产物脯氨酸和可溶性糖的含量均显著增加,出现累积,这个结果与多数研究的结果一致,表明这2种物质是提高植株渗透调节能力和保水性能的重要物质。
大多数的研究表明轻度或中度干旱胁迫条件下,保护酶活性上升,重度干旱胁迫条件下,保护酶活性下降。由此可推测8月19日土壤相对含水量为34.1%时为轻度胁迫,此时NR活性显著升高,启动保护,SOD活性也有小幅升高;8月21日土壤相对含水量为29.8%时为中度胁迫,此时CAT活性升高到最大值;而8月23日土壤相对含水量为23.5%时为重度胁迫,所有保护酶活性都表现为大幅下降。而根据可溶性糖含量的变化则可推测,8月21日土壤相对含水量为29.8%时已接近重度胁迫,因为此时可溶性糖含量接近最大值。
由此,我们认为最适宜澳洲茶树生长的土壤相对含水量的值应该在34.1%以上,低于这个值则进入干旱胁迫的状态。而土壤相对含水量低于23.5%,甚至29.8%时则进入重度干旱胁迫的状态,会对澳洲茶树叶片造成不可逆的伤害,甚至危及植株的存亡。
目前,澳洲茶树已在我国南方的大部分省区推广,如广西、广东、海南、福建、云南、江西、湖南等省区,以及西部的四川、重庆等地。澳洲茶树不仅可在平地种植,更常见的是在这些地区的山地种植,表现出一定的抗旱性。因此,评价澳洲茶树的抗旱性还要综合考虑各方面的研究结果,如对其根系的吸水、储水能力的研究等。而开展本研究也有其理论及现实意义,其结果可为确定最适宜澳洲茶树生长的土壤相对含水量提供依据,在人工灌溉条件下可以通过调节土壤相对含水量来促进澳洲茶树增产丰产。
