红叶石楠离体快繁体系的建立
2019-04-26钱晶晶周玉丽江文林张香杨张远兵
钱晶晶, 周玉丽, 吴 燕, 江文林, 张香杨, 张远兵*
(1.安徽科技学院 农学院,安徽 凤阳 233100;2.润林建设有限公司,安徽 滁州 239000)
红叶石楠(PhotiniafraseriDress)是蔷薇科石楠属植物,分布广泛[1]。因其新稍为亮红色,具有较高的观赏价值,所以经常作为园林植物应用于道路绿化、园区美化等方面[2]。该树耐盐碱性及耐旱能力较强,适合在土壤贫瘠的地区种植,生长速度快及管理方法简单,在我省极具推广价值和前景[3-4]。但目前红叶石楠的繁殖主要依靠扦插,这种方法受到土地、环境和气候等外界因素制约较多,导致其繁育较慢[5-6],尤其是占用土地资源较多,也影响农业生产用地。另外扦插繁殖所带来的品种退化,植物寿命短等问题也越来越凸显,因而发展一种现代繁育技术培育红叶石楠种苗,成为目前的当务之急。组织培养可以通过植物的一部分组织或细胞成功的“克隆”出一个完整的植物,也可以缩短植物的繁殖周期。组织培养环境是一个相对封闭、统一的人工环境[7-9]。避免了外界的光、水、养分和菌落的差异,统一了植物的培养环境,避免外界干扰,有利于培养高质量的红叶石楠无性繁殖苗,提高红叶石楠种苗的质量。
本试验通过组织培养的方法,获得可以移栽的红叶石楠离体快繁苗,从而建立红叶石楠的快速繁殖体系,以解决其扦插繁殖品种退化以及受季节、土地限制等问题,为红叶石楠的现代化大规模繁育优质种苗提供参考。
1 材料方法
1.1 供试材料
外植体来源于安徽科技学院种植基地,采集健壮的无病虫害红叶石楠新生嫩茎,去除叶片作为外植体,用流水冲洗10 min,采用赤霉素浸泡30 min后备用。
培养室培养条件:光照为2 400 LX,温度为25±1 ℃,光照时间为12 h/d,相对湿度为60%。
1.2 试验方法
1.2.1 外植体消毒 取红叶石楠茎尖(红叶石楠尖端1 cm嫩芽),清水冲洗10 min,再放入70%乙醇浸泡30 s,放入超净工作台中,用无菌水冲洗3次,分别用消毒剂进行消毒处理(消毒剂及处理时间见表1),再用无菌水冲洗5次,最后将冲洗好的材料放于滤纸上备用。
1.2.2 外植体接种 在解剖镜下,用解剖针将外植体茎尖苞片逐层拨开,直到只剩下叶原基生长点,直径约为0.3~0.5 mm。用手术刀切下生长点接种于培养基中,于培养室中培养。35 d后统计污染状况和成活状况。污染率=(污染植株/接种数)×100%,成活率=(成活数/未污染数)×100%。比较不同消毒剂及消毒时处理对红叶石楠茎尖生长的影响,每个处理进行3组平行试验,每组10 颗植株进行试验,记录数据,并计算平均数。

表1 不同消毒剂及消毒时间
1.2.3 不定芽分化及生根培养 接种45 d当成活外植体长到0.5 cm左右时取出,接种到培养基中,培养35 d,统计不定芽诱导率和生长状况,分化率=(分化不定芽数/接种数)×100%,生根=(生根组培苗数/接种数)×100%。试验采取三因素五水平正交设计,比较不同激素及浓度处理对红叶石楠组培苗分化及生根的影响,共25组(表2)。
试验中,以不加激素处理为对照。每个处理进行3组平行试验,每组10颗植株进行试验,记录数据计算平均数。
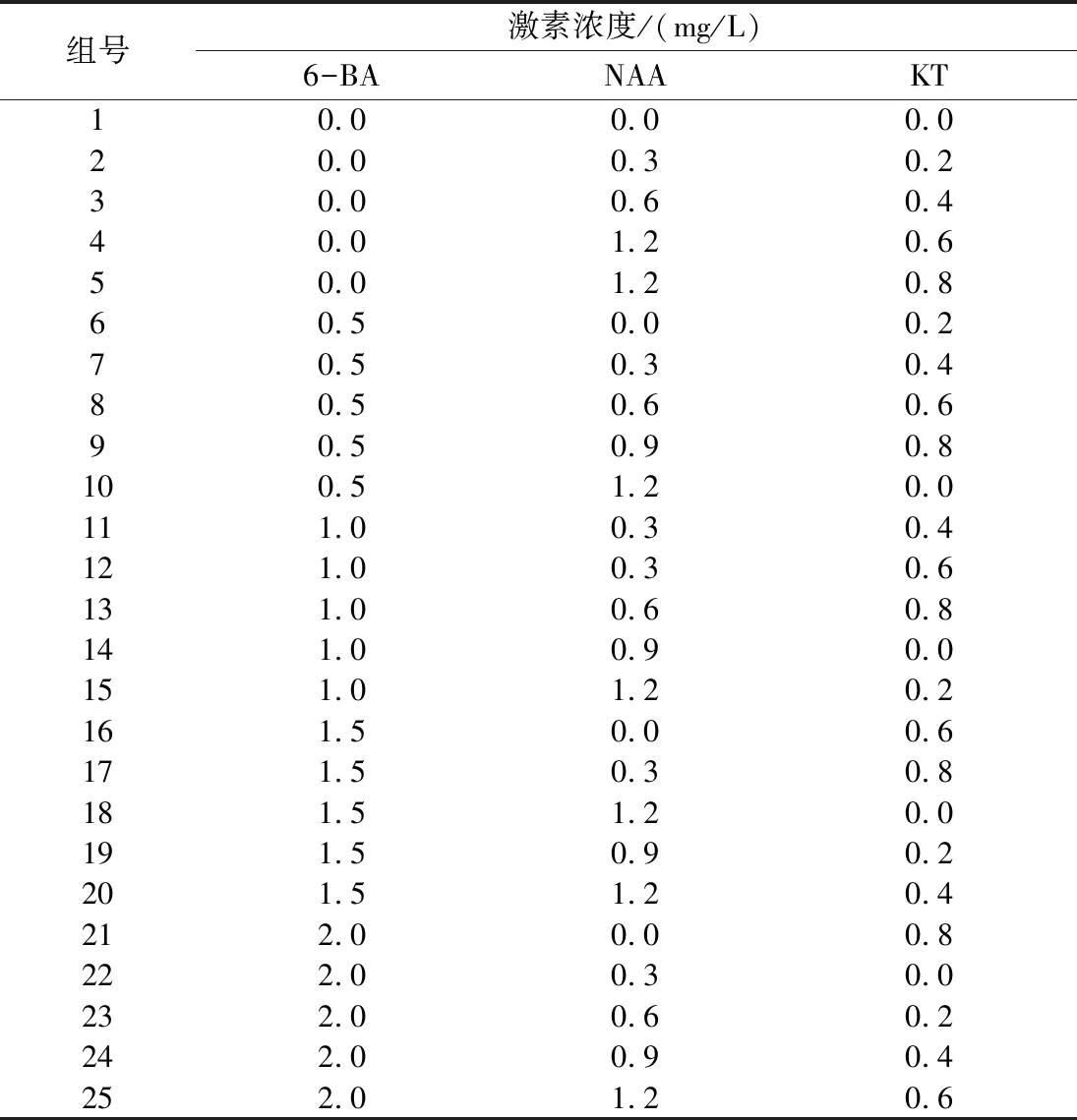
表2 不同激素及浓度处理组合
1.2.4 炼苗 将生根健壮的组培苗打开组培瓶盖,进行炼苗5 d。炼苗室环境为温度25±1 ℃,光照时间 12 h/d,相对湿度60%~65%。统计成活=(成活数/总炼苗数)×100%。比较不同光照强度(1 000、1 200、1 400、1 600、1 800、2 000 LX)对红叶石楠炼苗成活率影响。每个光照强度为一个处理,每个处理100颗植株,记录数据。
1.2.5 移栽 炼苗后,挑选健壮幼苗洗净根部培养基,移栽到基质育苗盘中,放置于温室中,光照为自然光照,每日早晚于叶片上喷水,保持叶面及土壤湿润,每隔两周喷施稀释10倍MS工作液。30 d后比较不同湿度(50%、60%、70%、80%、90%)对红叶石楠移栽苗成活率影响。每个梯度湿度为一个处理,每个处理50颗植株,记录数据。
1.3 数据统计
本试验采用Excel 2010进行数据统计和分析。
2 结果与分析
2.1 不同消毒剂及消毒时间对红叶石楠茎尖接种的影响
红叶石楠茎尖接种后,5~7 d内开始返青。接种15 d能看到明显的芽点分化,45 d时茎尖完全分化为红叶石楠组培苗,此时苗高达到0.5 cm以上即可以进行后续试验(图1)。

图1 红叶石楠生长离体快繁接种后生长状态
从表3可以看出,5% NaClO消毒20 min以上和HgCl2的消毒8 min以上时污染率明显低于其他处理污染率,可降至16.7%甚至更低。但是NaClO处理过后的红叶石楠茎尖明显出现褐化的现象。HgCl2处理时间超过8 min,虽然没有出现褐化现象,但是茎尖活力明显降低,接种35 d后茎尖返青率从8 min的76.7%迅速降到消毒14 min的46.7%。因此,在外植体的最佳消毒方案为0.1% HgCl2消毒8 min。
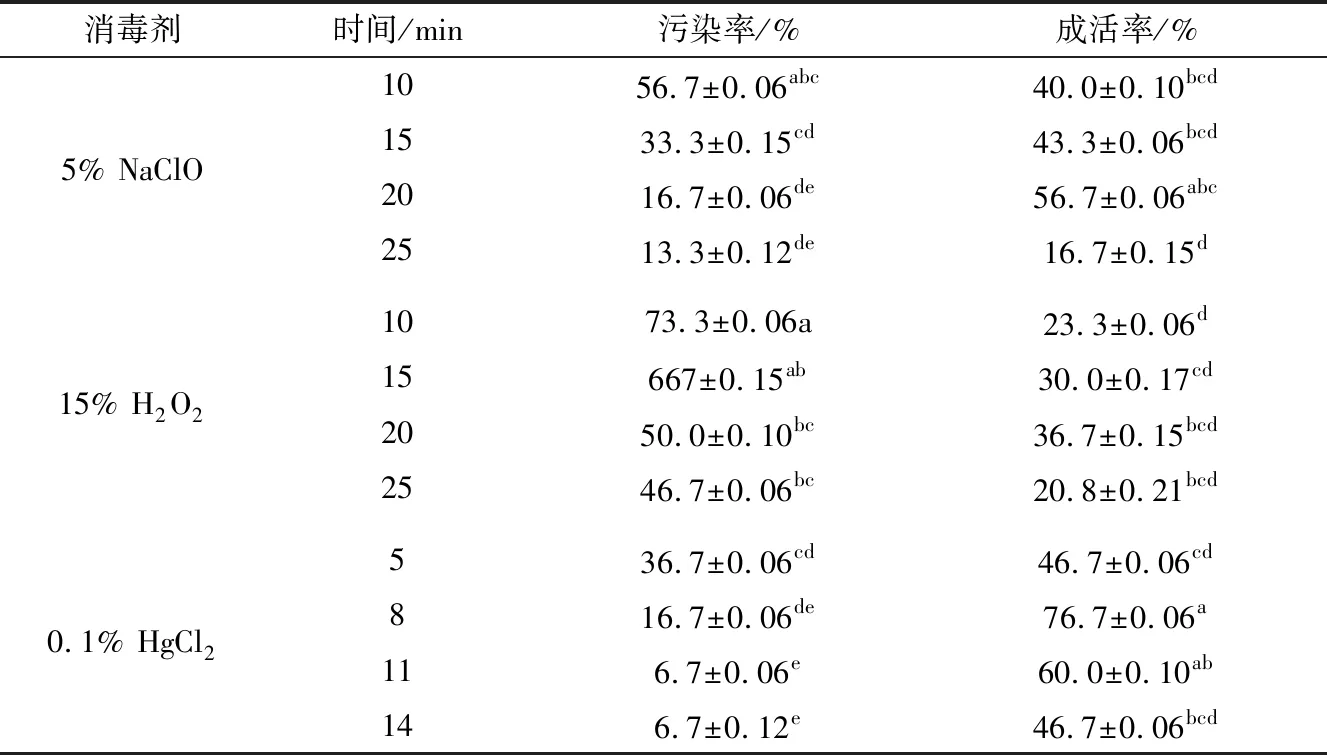
表3 不同消毒剂及消毒时间对红叶石楠茎尖接种的影响
2.2 不同激素及浓度组合对红叶石楠不定芽分化的影响
从表4可以看出,第11、16、23组诱导不定芽分化效果较好。激素组合中显示:6-BA对红叶石楠组培苗不定芽起到较好诱导作用,当6-BA浓度高于1.0 mg/L诱导出不定芽也较多,但是当6-BA浓度过高达到2.0 mg/L时,诱导出的不定芽茎细,叶片小,继代后出现死亡现象(第23组)。在试验过程中还发现,KT的存在对诱导出不定芽分化有较为明显的促进作用,KT高于0.4 mg/L时诱导出的不定芽较为粗壮,更适合继代、不定芽分化及生根等。
因而最适合红叶石楠不定芽分化培养基为:MS+1.5 mg/L 6-BA+0.6 mg/L KT,使用该培养基对红叶石楠组培苗进行培养时,分化率能够达到100%,每株组培苗可以诱导出分化不定芽7.1±1.08 棵,分化出的不定芽平均高度为1.99±0.153 cm,较为健壮适合后续培养(图2A)。

图2 不同激素处理下红叶石楠生长状况

表4 不同激素及浓度组合对红叶石楠组培苗生长的影响
2.3 不同激素及浓度组合对红叶石楠组培苗生根的影响
本试验红叶石楠最优生根培养基为第19组:MS+1.5 mg/L 6-BA+0.9 mg/L NAA+0.2 mg/L KT。该条件下培养35 d后诱导生根率可达到100%,培养每棵组培苗平均生根数为14.9±2.42,根红褐色、粗壮,平均根长8.47±0.959 cm。苗高5.36±0.148 cm,茎粗,非常适合移栽(图2B)。值得注意的是,对照组(第1组)在各个激素为零的情况下,也出现了部分组培苗生根情况,说明该植株较易生根,添加NAA浓度为0.3 mg/L时就出现红叶组培苗在分生不定芽的同时有70.0%±0.10%的组培苗诱导生根的现象(第17组)。但是红叶石楠组培苗生根水平并不是随着NAA的生根而持续升高,在NAA浓度为1.2 mg/L时(第10组和第25组),其生根率和生根数都出现了下降趋势。因而,本试验中红叶石楠生根培养中NAA最适添加浓度为0.9 mg/L。
2.4 炼苗移栽
选取粗壮的红叶石楠组培苗进行炼苗及移栽试验。炼苗中,光照强度直接影响到组培苗的存活率,在光照强度低的情况下炼苗5 d,红叶石楠组培苗存活率最高,光照强度达到2 000 LX时,红叶石楠组培苗成活率明显降低仅为45%,且移栽过程中未出现明显差异。
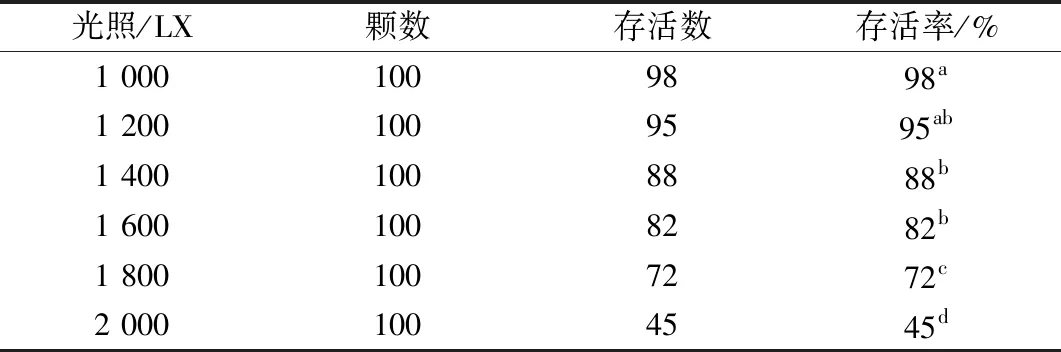
表5 不同光照条件下炼苗5 d红叶石楠组培苗存活率
空气湿度时影响红叶石楠组培苗移栽成活率的重要因素,表6显示,在移栽温室空气湿度为70%,移栽成活率可达99%,是最为理想的移栽条件。移栽30 d后的红叶石楠叶片生长加快、茎节短、腋芽开始萌发、根部逐渐变黑、生长明显、长势佳(图3C),符合工厂化育苗要求。
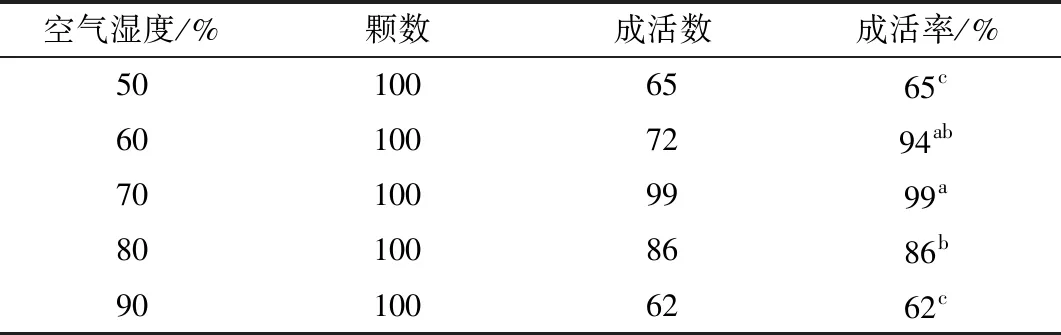
表6 不同空气湿度条件下红叶石楠移栽成活率
3 结论与讨论
本试验从消毒剂种类、激素添加量等对红叶石楠组织培养过程进行筛选:(1)外植体的最佳消毒方案为:0.1% HgCl2消毒8 min;(2)不定芽分化最佳培养基为:MS+1.5 mg/L 6-BA+0.6 mg/L KT;(3)红叶石楠最优生根培养基为:MS+1.5 mg/L 6-BA+0.9 mg/L NAA+0.2 mg/L KT。避免了近年来关于红叶石楠的组织培养研究中研究不系统等[10-13]问题。其次,关于红叶石楠组织培养的研究生中,并未明确炼苗和移栽的研究条件及成活率,使规模化育苗的成本难以统计,不具备生产价值[14]。本试验从炼苗和移栽主要条件进行筛选出移栽苗最大成活率,试验显示1 000 LX强度下炼苗5 d后。放置于温室中,光照为自然光照,每日早晚于叶片上喷水,保持叶面及土壤湿润,每隔两周喷施稀释10倍MS工作液,在空气湿度70%的条件下,移栽苗成活率达到99%,适合红叶石楠大规模工业生产。多数研究文章选取腋芽或茎段作为外植体,使得外植体取样时间多在早春中进行,范围较为窄小[15]。另外,本试验采取红叶石楠茎尖作为材料进行外植体接种,由于红叶石楠自身生长特性,使接种时间扩大到4至11月份,随时取样、随时接种,扩展了接种时间。最后,本试验通过茎尖剥离的方法对红叶石楠进行离体快繁处理,使红叶石楠苗更加健壮,解决了传统扦插繁殖红叶石楠品种退化、植株老株病株多等问题。
