植物精油海藻酸钠复合膜对双孢蘑菇的抑菌保鲜效果研究
2019-04-26孔瑞琪逯文倩张荣飞王相友郭衍银
王 娟,程 萌,孔瑞琪,逯文倩,张荣飞,王相友,郭衍银
植物精油海藻酸钠复合膜对双孢蘑菇的抑菌保鲜效果研究
王 娟,程 萌,孔瑞琪,逯文倩,张荣飞,王相友,郭衍银
(山东理工大学农业工程与食品科学学院,淄博 255049)
为了研究植物精油对双孢蘑菇贮藏期主要腐败菌的抑制效果,该文以新鲜双孢蘑菇为试验材料,分离、纯化并鉴定引起双孢蘑菇贮藏期腐败的主要病原菌;通过体外抑菌活性试验,筛选出抑菌效果较好的植物精油,并将此精油应用于复合膜的保鲜试验中,验证其抑菌保鲜效果。通过对双孢蘑菇主要致腐微生物进行分离、纯化得到9株单菌落,经致病性试验得到主要病原真菌为3号菌,对该病原菌18S rDNA 序列进行进化树分析,确定其为丰孢木霉菌()。选用姜黄、连翘、桉叶、当归4种精油对3号菌菌株进行抑菌活性试验,筛选出较优精油种类及浓度。结果表明,桉叶油对丰孢木霉菌的抑制效果最好,其次是连翘油,姜黄油和当归油无明显抑制作用。桉叶油最小抑菌浓度(minimum inhibitory concentration, MIC)为0.312 5L/mL,最小杀菌浓度(minimum bactericidal concentration, MBC)为0.625L/mL;连翘油MIC为0.625L/mL,MBC为1.25L/mL。通过对海藻酸钠/桉叶油复合膜和海藻酸钠单一膜的性能指标进行测定和对比发现,桉叶油的添加可显著提高膜的气体阻隔性能和机械性能。分别用海藻酸钠/桉叶油复合膜、海藻酸钠单一膜和普通PE膜对双孢蘑菇进行保鲜试验,结果表明,添加桉叶油的复合膜可有效降低双孢蘑菇子实体的衰老和致病腐烂,具有显著的抑菌保鲜效果。该研究结果可为双孢蘑菇贮藏期防腐和天然杀菌保鲜剂的选择提供一定的理论依据。
病原菌;精油;膜;双孢蘑菇;抑菌;保鲜
0 引 言
双孢蘑菇()是世界范围内种植最广泛的一种食用菌,富含多种营养物质,如甘露醇、维生素、菌糖、有机碱等,是典型的高蛋白、低脂肪、低能量的菌类保健食品[1]。新鲜双孢蘑菇子实体洁白,含水率高,无明显的保护组织,货架期短[2],其本身作为一营养体很容易受到侵害,尤其是在生长成熟期间,易发生病变,常表现性状为褐斑、腐烂等,严重影响其口感和食用价值,同时也很大程度上影响了其商品价值[3],对于消费者和生产商来说都是不利的。食用菌贮藏期间的腐烂、病变多是由致病微生物的侵染引起的,目前对食用菌病原菌的研究多集中在种植期间。张春兰等[3]研究了双孢蘑菇褐腐病病原菌有害疣孢霉菌的传播途径及其核相;陈少珍等[4]分离鉴定了蘑菇黑斑病病原菌为黑根霉菌;Graupner等[5]通过质谱成像及基因组分析研究了双孢蘑菇软腐病病原菌中抗真菌毒力因子的特征;罗秀俊等[6]分离鉴定了香菇烂筒病的主要病原菌为哈茨木霉菌。迄今对引起双孢蘑菇贮藏期病害的病原菌相关报道较少。
植物精油,是植物体内一类重要的次生代谢产物,通过蒸馏、压榨等方式从草本植物的花、果实、种子等中萃取提炼出来[7],具有抑菌、抗氧化、抗病毒等作用,因此,在食品、医药、农业等方面得到了应用和发展[8]。研究表明植物精油类物质大多具有杀菌、防腐的作用,对食品中常见的链格孢菌、镰刀菌和霉菌中青霉、曲霉、根霉等真菌都具有很强的抑杀作用[9-14]。姜黄为姜科属,多年生草本植物,具有良好的抗炎镇痛及体外抗氧化活性[15];连翘属于木犀科连翘属植物,作为常用的传统中药之一,具有清热解毒、抗菌利尿、散结消肿的功效[16];桉叶油是从桉树油、玉树油、樟脑油、月桂叶油等物质中提取而来,具有杀菌消炎的作用[17];当归为伞形科植物,具有扩张外周血管,降血压的作用[18]。以往人们多是对这4种精油的药用价值进行研究,而在果蔬保鲜研究中的报道较少,因此,本文针对精油的抑菌活性、抗氧化活性及其在保鲜方面的应用进行研究,以期为植物精油资源的抑菌保鲜应用提供依据。
本试验拟对从腐烂双孢蘑菇分离得到的微生物进行纯化,将纯化后的菌株接种于健康双孢蘑菇进行致病性试验,对主要病原菌菌株进行测序,确定其种属。选用姜黄、连翘、桉叶、当归4种精油进行抑菌活性试验,筛选出针对双孢蘑菇病原菌抑制效果较好的植物精油,并采用精油复合膜进行保鲜验证试验,旨在为双孢蘑菇贮藏期防腐保鲜以及天然杀菌保鲜剂的选择提供一定的理论依据。
1 材料与方法
1.1 试验材料与主要试剂
新鲜双孢蘑菇采自山东省淄博市临淄区,采后立即运至山东理工大学实验冷库,(4±1)℃下预冷12 h备用。
姜黄、连翘、桉叶、当归精油(江西省吉安市国光香料厂);海藻酸钠(天津市光复);UNIQ柱式DNA胶回收试剂盒(上海生工)。
1.2 试验仪器设备
BSC-150型恒温恒湿箱(上海博讯);XA.XT plus质构仪(英国Stable Micro System公司);LDZF-50KB-H型立式压力蒸汽灭菌器(上海申安);SHP-300型智能生化培养箱(上海三发);TGL-20M高速台式冷冻离心机(湖南湘仪);BCN-1360型生物超净工作台(哈尔滨东联电子);DYY-5型稳压稳流电泳仪(北京六一);Bio- RadVersaDoc3000 凝胶成像仪(上海和美国际贸易有限公司);2720 PCR仪(AB1公司);3730测序列分析仪(美国Applied BioSystems公司)。
1.3 试验方法
1.3.1 病原菌的培养和分离
参考杜小琴等[19]的方法,并略有修改:对腐烂变质的部位采用组织分离法进行病症分组。在病健交接处切取约2 mm的组织,用75%的酒精进行消毒10 s,无菌水冲洗3次后于马铃薯葡萄糖琼脂培养基(PDA)中,25 ℃下培养纯化。
1.3.2 致病性试验
1)真菌孢子悬浮液的制备
参照周德庆的方法[20],取25℃下培养10 d的带菌PDA平皿1个,加入含0.05% 吐温80的无菌水10 mL,用镊子挑取平板的病原菌孢子,转入50 mL三角瓶中,在旋涡振荡器(XW-80A型,上海黄浦沪西仪器厂)振荡15 s后,用4层纱布滤去菌丝,再用血球计数板计数算出孢子悬浮液的浓度,最后稀释至所需浓度106CFU/mL。
2)细菌菌悬液的制备
采用平板菌落计数法[20],用无菌牙签将供试细菌接入50 mL无菌水中,振荡30 min,稀释菌悬液,用微量可调移液器(法国吉尔森公司)分别吸取标记10-4、10-5、10-6菌悬液各200L,转接至无菌平皿中涂布,37℃培养48 h,平板计数。计算方法如式(1)
3)致病性试验
霉菌制备106CFU/mL微生物孢子悬液,细菌则为105CFU/mL的细胞悬液,通过喷雾接种在新鲜健康的双孢蘑菇上,每种处理10个蘑菇,重复3次。接种后的双孢蘑菇用普通PE保鲜膜单层包装,于4℃实验冷库暗培养(相对湿度85%±5%)。观察并记录新鲜双孢蘑菇的发病情况,显症后与原腐烂双孢蘑菇进行对比鉴定,一致则可以确定是该病原菌。
1.3.3 形态学鉴定
挑取少量的目标菌株接种于PDA培养基,25℃培养72 h观察菌落形态,并用乳酸石碳酸棉兰染色剂(上海生工)染色,观察个体形态。
1.3.4 18S rDNA鉴定菌种
1)选择合适的特异性引物
ITSl (5¢-TCCGTAGGTGAACCTGCGG-3¢),ITS4 (5¢-TCCTCCGCTTATTGATATGC-3¢)。
2)扩增目标区序列
扩增体系:
10×taq Buffer(Takara公司),10L;dNTP MIX(Takara公司),1L;ITS1(泓迅公司合成引物),2L;ITS4(泓迅公司合成引物),2L;菌样,5L;Taq酶(Takara公司),2L;加去离子水至50L。
反应条件:96℃,5 min;(96℃、30 s; 58℃、30 s;72℃、30 s)×35 cycles;72℃,7 min;4℃∝。
3)PCR产物纯化
4)PCR产物克隆测序
5)同源性分析与进化树的构建
采用核酸BLAST技术,将测序获得的序列信息与美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)网站的Gen Bank数据库进行对比,得到与所测序列同源性较高的已知分类地位的菌种,然后将已知菌株与所测菌株的18S rDNA序列一起,应用Meg Align(Clustal w)进行比对,绘制进化树。
1.3.5 抑菌活性试验
1)不同精油的抑菌效果
采用滤纸片法[21-23]进行测定。分别用100L的姜黄、连翘、桉叶、当归4种不同种类精油浸渍无菌滤纸片(直径6 mm)2 h。吸取30L浓度为106CFU/mL的孢子悬液,均匀涂布于PDA培养基,于25℃下培养,3个平行对照,3次重复。48 h后,用游标卡尺测量包围平板周围的抑制区(zones of inhibition,ZOI)的直径(包括滤纸片的直径)记录。以体积分数10%的吐温80作为对照。计算方法如式(2)

2)最小抑菌浓度(minimum inhibitory concentration, MIC)和最小杀菌浓度(minimum bactericidal concentration, MBC)的测定
对于具有较好抑菌活性的植物精油,采用试管二倍稀释法[24]测定其MIC。用体积分数10%的吐温80将植物精油稀释成不同浓度梯度的稀释液,每支试管分别加入100L 106CFU/mL制备好的菌悬液。设立不加精油的空白对照组。25℃振荡培养48 h,每组处理3个平行,3次重复。用“+”表示有菌生长,“-”表示无菌生长,MIC为试管内无菌的最小精油浓度。
将上述100L精油有效抑菌浓度药液接入空白PDA固体培养基上涂布均匀,于25℃恒温培养48 h,观察培养基上有无菌物生长,以培养皿中计数减少99.9%原始菌落的精油浓度作为MBC[24]。
1.3.6 膜的制备及性能测定
1)膜的制备
参考汤秋冶等[25]的方法:称取2 g海藻酸钠粉末缓慢加入到90 mL的蒸馏水中,80℃水浴搅拌至膜液澄清。然后冷却至室温(25℃),分别加入1 mL的甘油和0.7 mL的精油(海藻酸钠单一膜不加入精油)。调节膜液pH值为6.5,然后定容至100 mL,用磁力搅拌器(HJ-4型,峥嵘仪器厂)以2 000 r/min 搅拌30 min,于4℃下静置过夜。第2天将100 mL 的膜液倒在水平的玻璃模具(100 mm× 100 mm)内,50℃干燥12 h(必须保证玻璃板的水平性)后,取出模具,加入2%的氯化钙,交联120 s,最后室温下放置12 h,揭膜。
2)膜的物理和力学性能测定
膜的水蒸气透过率(water vapor transmission rate,WVTR)和透氧率参考ASTM[26]的方法测定,机械性能参考罗宁宁[27]的方法测定。
1.3.7 不同包装膜对双孢蘑菇保鲜效果试验
分别用制备好的精油复合膜、海藻酸钠单一膜和普通PE膜将新鲜双孢蘑菇包装起来,无包装处理作为空白对照,将4组不同处理的双孢蘑菇同时放入4℃的冷库中贮藏,分别在贮藏的第0、3、6、9、12天测量蘑菇的失质量率、硬度、菇皮白度、菇肉白度、细胞膜透性和菌落总数等指标。
1.3.8 测定指标及方法
1)失质量率[28]
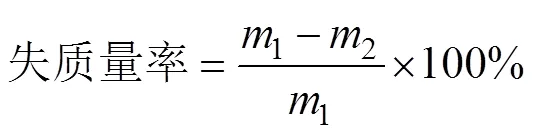
式中1为贮藏前双孢蘑菇质量,g;2为贮藏后双孢蘑菇质量,g。
2)硬度
用果实硬度计(GY-1型,牡丹市机械研究所)测定双孢蘑菇的硬度。将硬度计垂直于双孢蘑菇表面,匀速将压头压入子实体内约5 mm,以指针读数作为双孢蘑菇的硬度值[29]。
3)白度值
双孢蘑菇子实体切面的白度值用自动色差计(SC-80型,北京康光仪器有限公司)进行测定,用表示[30]。
4)细胞膜透性
参考张荣飞等[28]的方法,用电导率仪(DDB-6200型,上海雷磁新泾仪器有限公司)测定浸提液的电导率。
5)菌落总数
参照GB/T 4789.2-2016《食品卫生微生物学检验菌落总数测定》测定菌落总数[31],结果单位以lg CFU/g表示。取5 g样品置于45 mL无菌生理盐水中,8 000 r/min均质2 min,得到1:10样品匀液。用无菌吸管吸取1 mL样品匀液缓慢注于盛有9 mL无菌生理盐水的无菌试管中,得到1:100样品匀液,依次制备一系列不同浓度梯度的样品匀液。选取2~3个适宜稀释度样品匀液,各吸取100L于无菌PDA培养基中,均匀涂布,25℃恒温培养48 h。
2 结果与分析
2.1 病原菌分离及鉴定
根据科赫法则,从腐烂双孢蘑菇分离纯化病原菌(图1),最终得到9株单菌落,通过形态学鉴定,分别为3种霉菌和2种细菌。回接致病性验证试验,确定双孢蘑菇的主要致腐病原菌为3号菌。将3号菌菌株于25℃下PDA培养基中培养3 d的菌落形态如图2a所示,显微特征观察(×400)如图2b所示。

图1 双孢蘑菇贮藏期病发病症状、原菌分离和菌落形态

图2 病原菌菌株
3号菌菌落呈棉絮状,开始为白色且膨松,后从菌落中央产生绿色孢子,菌盘逐渐变成绿色,产孢区有菌丝轮纹,带有特殊气味。菌体可沿培养基表面蔓延生长,培养基背面呈绿色。孢子近似球形,透明。
用质量分数1%的琼脂糖凝胶对3号菌菌株的18S rDNA扩增产物电泳检测,经溴乙锭染色后,在560 bp附近出现荧光条带(图3),与预期结果一致。
分析18S rDNA序列可得,该病原菌与木霉属微生物保守序列相似度最高。进化树如图4所示,3号病原菌与丰孢木霉菌()亲缘关系较近,与哈茨木霉菌()也比较近,但与黑甲肉座菌()亲缘关系较远。因此可以推断,3号病原菌为丰孢木霉菌()。

注:泳道1、2:3号菌的PCR扩增产物,其中泳道1上样量1 µL,泳道2上样量2 µL;泳道M:DNA ladder。

图4 3号菌和相关菌株的系统进化树
2.2 植物精油对病原菌的体外抑菌效果
表1为不同植物精油的抑菌圈直径大小,通过比较可以得到,桉叶油对丰孢木霉菌的抑制效果最好,其次是连翘油,姜黄油和当归油无明显抑制作用。因此以桉叶油和连翘精油为主要研究对象测定其MIC和MBC。

表1 不同植物精油的抑菌圈直径
表2为不同精油浓度的抑菌效果,由表2可以看出,桉叶油的MIC为0.312 5L/mL,MBC为0.625L/mL;连翘精油的MIC为0.625L/mL,MBC为1.25L/mL。虽然桉叶油与连翘油都具有抑菌活性,但桉叶油针对丰孢木霉菌的抑制效果更好,这可能与其成分1,8-桉叶油素有关[32]。因此,选择桉叶油制备复合保鲜膜,并进行性能比较试验和双孢蘑菇保鲜应用试验。
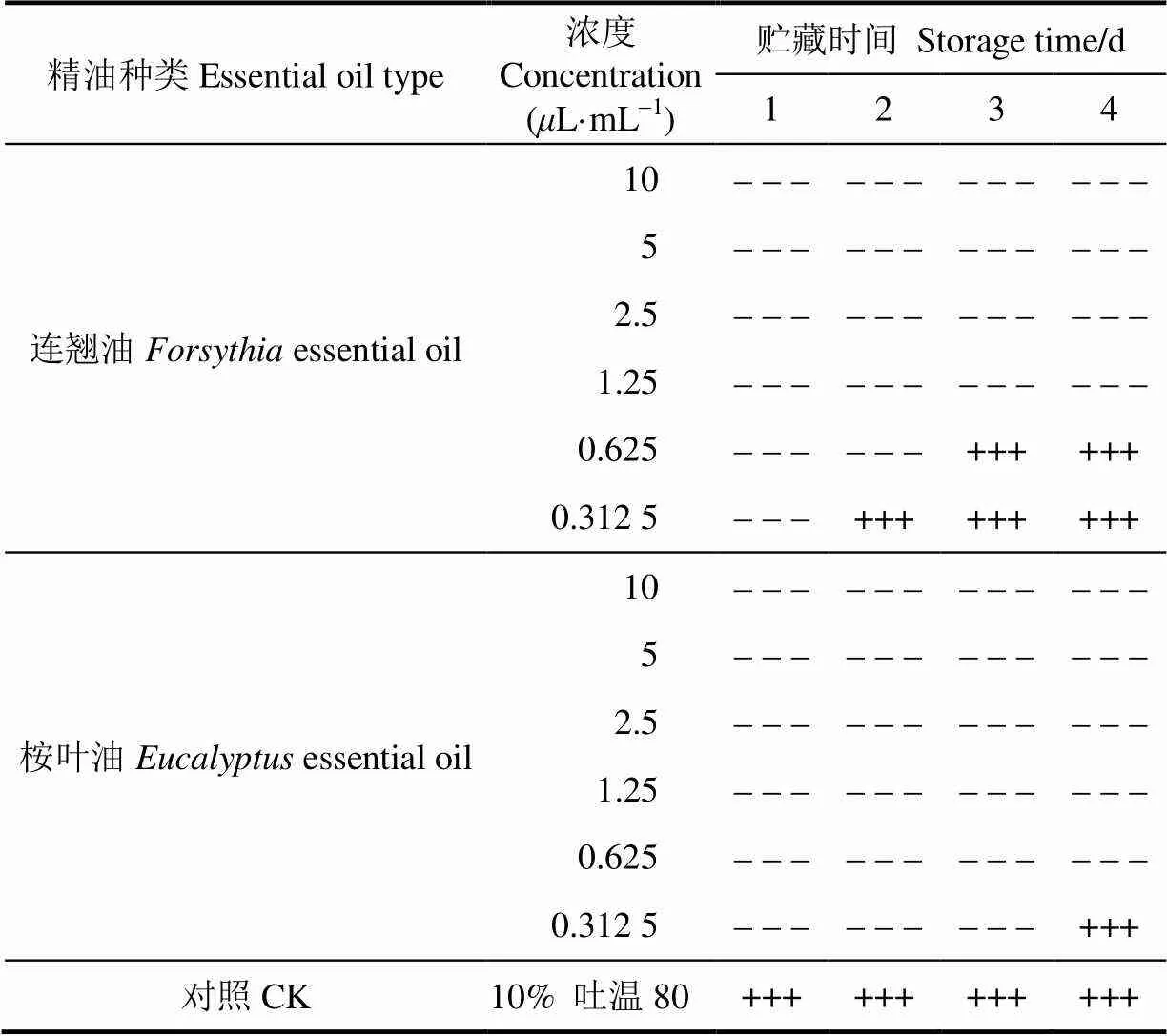
表2 不同精油浓度的抑菌效果
注:“+”表示有菌生长,“-”表示无菌生长。
Note: “+” indicates fungus growth, “-” indicates no fungus growth.
2.3 膜的性能及在双孢蘑菇中的保鲜应用
2.3.1 膜理化参数
表3为海藻酸钠/桉叶油复合膜与海藻酸钠单一膜的性能比较。

表3 海藻酸钠/桉叶油复合膜与海藻酸钠单一膜参数
由表3可以看出,海藻酸钠/桉叶油复合膜的水蒸气透过率和氧气透过率均显著低于海藻酸钠单一膜,说明桉叶油的添加增强了膜的气体阻隔性能,这可能是由于桉叶油均匀分散在复合膜中,与膜液发生分子相互作用[27],增加了膜的厚度和致密性。由表3还可以看出,海藻酸钠/桉叶油复合膜的拉伸强度和断裂伸长率均显著高于海藻酸钠单一膜,说明桉叶油的添加提高了复合膜的机械性能,这可能与精油类物质干燥成膜后的力学特性有关。
2.3.2 失质量率
失质量率可直观反映双孢蘑菇的新鲜度。双孢蘑菇在采后贮藏中,子实体品质降低,由于双孢蘑菇含水率较高,又因为表面无明显保护组织,失质量主要是失水造成的。失水率大于5%,子实体即变蔫变软,新鲜程度降低[28]。不同处理双孢蘑菇失质量率的变化如图5所示,在整个贮藏过程中,4种不同包装方式处理下,双孢蘑菇的失质量率均呈现不断上升的趋势,空白对照组的失质量率在第6天就已高达7.7%,菌体皱缩严重,普通PE膜和海藻酸钠单一膜处理均可减缓双孢蘑菇的失水,但2种处理无显著差异(<0.05)。贮藏第12 天时,海藻酸钠/桉叶油复合膜处理的双孢蘑菇失质量率仅为3.51%,显著低于其他处理。这是由于海藻酸钠/桉叶油复合膜具有较低的水蒸气透过率,可有效减少包装内水蒸气的散失,较好地维持了双孢蘑菇贮藏环境的高湿度要求,降低了双孢蘑菇子实体水分的散失。
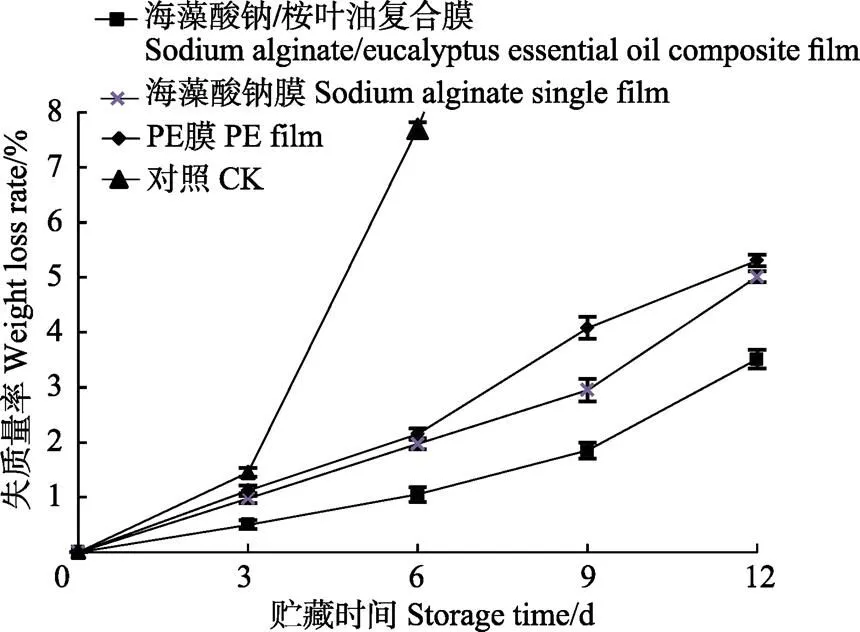
图5 不同处理对双孢蘑菇贮藏期间失质量率的影响
2.3.3 硬度
硬度反映了子实体的成熟衰老。在贮藏期内,双孢蘑菇的硬度会随着细胞膨压下降、细胞壁逐渐降解等因素不断下降[33]。图6显示了贮藏过程中双孢蘑菇硬度的变化,在整个贮藏过程中,各处理双孢蘑菇子实体的硬度随贮藏时间的延长不断降低,这可能与果胶酶的催化作用有关,原果胶不断分解,在细胞渗透压的作用下,被细胞液溶解,导致菌体硬度减小。在贮藏第12 天海藻酸钠单一膜处理组双孢蘑菇硬度由原始的0.94 N/mm2下降到0.52 N/mm2,而海藻酸钠/桉叶油复合膜处理的样品硬度为0.58 N/mm2。在整个贮藏期内,复合膜处理的双孢蘑菇硬度均显著高于其他3组。
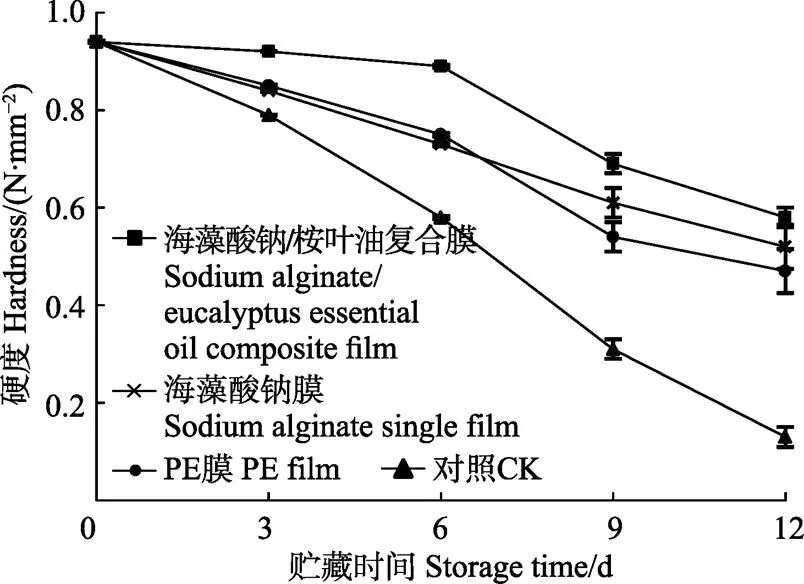
图6 不同处理对双孢蘑菇贮藏期间硬度的影响
2.3.4 白度值
白度是评价双孢蘑菇商品价值比较重要也是较为直观的指标,采后双孢蘑菇在贮藏过程中会因组织中的多种酚类物质氧化引起褐变。此外,双孢蘑菇表面的一些微生物也会导致蘑菇上产生深褐色的斑点。Gormley[34]将蘑菇的白度分为2类:白度大于等于86的为好品质菇,在80~85之间的为可接受品质。试验比较了不同包装处理的双孢蘑菇在贮藏期间菇皮和菇肉白度的变化情况。图7a为不同处理对双孢蘑菇贮藏期间菇皮白度的影响,由图7a可看出,海藻酸钠/桉叶油复合膜处理的双孢蘑菇品质要优于其他3组处理。对照组双孢蘑菇菇皮的白度在第3天就低于85,菇皮有黏着现象,商品价值严重降低,而复合膜处理的双孢蘑菇菇皮白度值在第6天仍高于86,为好品质菇。普通PE膜包装和海藻酸钠包装的双孢蘑菇菇皮白度值在第12天均已低于80,为不可接受品质,复合膜处理组双孢蘑菇菇皮的白度值最低为82.31,仍然为可接受品质。另外,由图7b可看出,4种不同处理双孢蘑菇菇肉白度也具有相似变化规律。通过方差分析,在相同条件下,海藻酸钠/桉叶油复合膜贮藏期内菇肉白度均高于其他组,且差异显著。
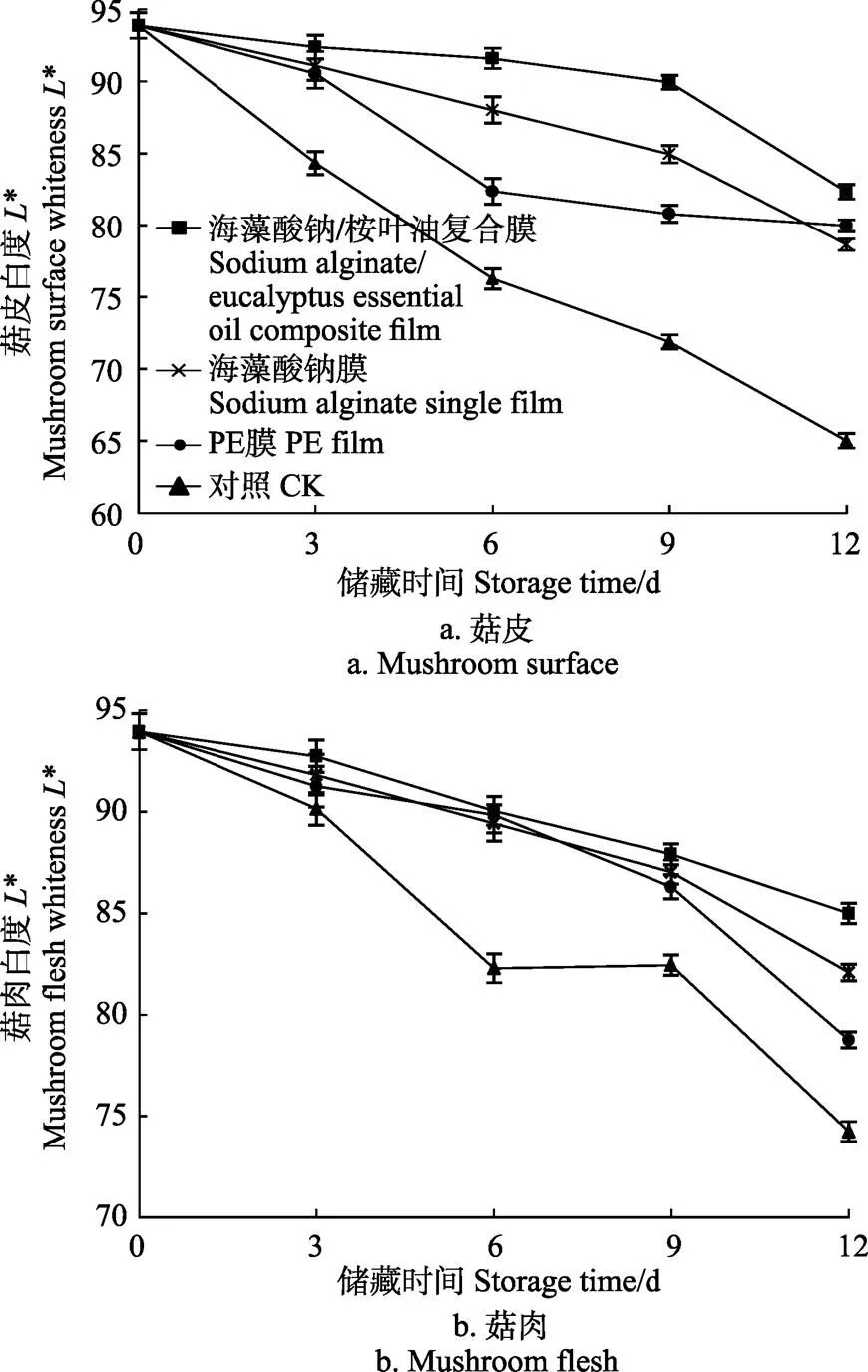
图7 不同处理对双孢蘑菇贮藏期间菇皮及菇肉白度的影响
2.3.5 细胞膜透性
果蔬在贮藏期间经历着一个后熟的过程,细胞膜透性间接反映了果蔬品质的衰老和损伤情况[35],随着细胞的不断降解,膜透性不断增加。图8为不同处理对双孢蘑菇贮藏期间细胞膜透性的影响,由图8可以看出,在整个贮藏过程中,海藻酸钠/桉叶油复合膜处理的双孢蘑菇膜透性较低。在贮藏第12 天时,对照组的膜透性高达73.32%,普通PE膜处理组为68.94%,海藻酸钠单一膜处理组为65.63%,而复合膜处理组仅为60.71%。这说明海藻酸钠/桉叶油复合膜的使用能够有效地降低脂质过氧化和电解质外漏的发生。

图8 不同处理对双孢蘑菇贮藏期间细胞膜透性的影响
2.3.6 菌落总数
双孢蘑菇感染微生物容易造成子实体的衰老、品质下降等现象,最终导致其软化腐烂,产生病害和有毒物质等。即使低温干燥的条件下也难以减少微生物侵害,食用菌微生物侵染致病问题不容忽视。图9为不同处理对双孢蘑菇贮藏期间菌落总数的影响,由图9可以看出,随着贮藏时间的延长,4组不同包装处理的双孢蘑菇菌落总数均呈不断上升趋势。对比可得,不同贮藏期内,海藻酸钠/桉叶油复合膜包装下的双孢蘑菇菌落总数上升较为缓慢,且显著低于其他3种处理,贮藏结束时,对照组双孢蘑菇的菌落总数高达12.33 lg CFU/g,普通PE膜处理下的双孢蘑菇菌落总数为10.62 lg CFU/g,海藻酸钠单一膜处理后的双孢蘑菇菌落总数为9.85 lg CFU/g,复合薄膜处理后的双孢蘑菇菌落总数仅为7.77 lg CFU/g,说明海藻酸钠/桉叶油复合膜可以显著抑制双孢蘑菇微生物数量的增长,可有效防止因感染病害导致的褐变、软化、腐烂等品质下降,保持食用价值和经济价值。对比Qin等[36]对双孢蘑菇的研究情况,海藻酸钠/桉叶油复合膜更有效减少贮藏期微生物数量,直观反映了该膜的抑菌性,即桉叶油具有较好的抑菌性能。

图9 不同处理对双孢蘑菇贮藏期间菌落总数的影响
3 结 论
本文对腐烂双孢蘑菇中的微生物进行分离纯化,得到9株单菌落;经致病性验证试验,确定了双孢蘑菇贮藏期间主要致病菌为3号菌菌株;通过18S rDNA序列分析和绘制进化树比对,该病原菌为丰孢木霉菌()。
研究了4种植物精油对双孢蘑菇主要致病菌的抑制效果,结果表明,桉叶油的抑菌性最强,其次是连翘油,而姜黄油和当归油无明显抑菌效果。针对抑菌效果较好的2种精油深入研究,得到桉叶油的最小抑菌浓度(minimum inhibitory concentration, MIC)为0.312 5L/mL,最小杀菌浓度(minimum bactericidal concentration, MBC)为0.625L/mL;连翘精油的MIC为0.625L/mL,MBC为1.25L/mL。
通过对海藻酸钠/桉叶油复合膜和海藻酸钠单一膜的性能指标进行测定和对比发现,桉叶油的添加可显著提高膜的气体阻隔性能和机械性能。通过双孢蘑菇保鲜试验说明,与海藻酸钠单一膜相比,添加了桉叶油的复合膜对双孢蘑菇起到显著的抑菌保鲜效果,可有效延缓贮藏期双孢蘑菇的失重、衰老和褐变,并对双孢蘑菇贮藏期间微生物的感染起到了明显抑制作用,提高了双孢蘑菇的商品价值。本研究结果可为双孢蘑菇贮藏期防腐和天然杀菌保鲜剂的选择提供理论依据。
[1] 张荣飞,王相友,刘战丽. 纳米TiO2/SiO2复合膜结构的表征及其对双孢蘑菇涂膜保鲜的影响[J]. 现代食品科技,2014,30(9):134-141.Zhang Rongfei, Wang Xiangyou, Liu Zhanli. Structural characterization of a nano-TiO2/SiO2composite film and its preservative effect on agaricus bisporus[J]. Modern Food Science and Technology, 2014, 30(9): 134-141. (in Chinese with English abstract)
[2] 曹冬洁,王相友,王娟. 基于酶动力学方程的双孢蘑菇气调贮藏呼吸速率模型[J]. 农业工程学报,2016,32(4):284-289. Cao Dongjie, Wang Xiangyou, Wang Juan. Respiration rate model ofbased on enzyme kinetics equation under controlled atmosphere storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(4): 284-289. (in Chinese with English abstract)
[3] 张春兰,徐济责,柿岛真,等. 双孢蘑菇疣孢霉病的发病过程及病原菌的核相研究[J]. 微生物学报,2017,57(3):422-433. Zhang Chunlan, Xu Jize, Kakishima Makoto, et al. The development ofwet bubble disease and the nuclear phase of pathogen[J]. Acta Microbiologica Sinica, 2017, 57(3): 422-433. (in Chinese with English abstract)
[4] 陈少珍,黄思良,黄卓忠,等. 蘑菇黑斑病病原菌分离与鉴定[J]. 广西农业科学,2009,40(1):43-46. Chen Shaozhen, Huang Siliang, Huang Zhuozhong, et al. Isolation and identification of pathogen of mushroom black spot[J]. Guangxi Agricultural Science, 2009, 40(1): 43-46. (in Chinese with English abstract)
[5] Graupner K, Scherlach K, Bretschneider T, et al. Imaging mass spectrometry and genome mining reveal highly antifungal virulence factor of mushroom soft rot pathogen[J]. Angewandte Chemie International Edition, 2012, 51(52): 13173-13177.
[6] 罗秀俊,郭建峰,韩波波,等. 一株香菇病原真菌的分离、鉴定与室内防治药剂筛选[J]. 云南农业大学学报:自然科学,2017,32(5):793-804. Luo Xiujun, Guo Jianfeng, Han Bobo, et al. Isolation, id- entification of apathogen and vitro screening of control medicament[J]. Journal of Yunnan Agricultural University: Natural Science, 2017, 32(5): 793-804. (in Chinese with English abstract)
[7] 汤晓倩,刘霞,冯蕊. 植物精油在植物保护中的应用研究进展[J]. 安徽农业科学,2016,44(1):211-213. Tang Xiaoqian, Liu Xia, Feng Rui. Research advances of application of plant essential on in plant conservation[J]. Joumal of Anhui Agricultural Science, 2016, 44(1): 211-213. (in Chinese with English abstract)
[8] 胡林峰,许明录,朱红霞. 植物精油抑菌活性研究进展[J]. 天然产物研究与开发,2011,23(2):384-391. Hu Linfeng, Xu Minglu, Zhu Hongxia. Advances in antifungal activity of plant essential oil[J]. Natural Product Research and Development, 2011, 23(2): 384-391. (in Chinese with English abstract)
[9] Zakuan Z, Mustapa S A, Sukor R, et al. Antifungal activity of(temukunci) extract against filamentous spoilage fungi from vegetables[J]. International Food Research Journal, 2018, 25(1): 433-438.
[10] Combrinck S, Regnier T, Gpp K. In vitro activity of eighteen essential oils and some major components against common postharvest fungal pathogens of fruit[J]. Industrial Crops and Products, 2011, 33(2): 344-349.
[11] Starovic M, Ristic D, Pavlovic S, et al. Antifungal activities of different essential oils against anise seeds mycopopulations [J]. Journal of Food Safety and Food Quality-Archiv fur Lebensmittelhygiene, 2016, 67(3): 72-78.
[12] Maqbool M, Ali A, Alderson P G, et al. Postharvest application of gum arabic and essential oils for controlling anthracnose and quality of banana and papaya during cold storage[J]. Postharvest Biology & Technology, 2011, 62(1): 71-76.
[13] Tian J, Ban X, Zeng H, et al. Chemical composition and antifungal activity of essential oil fromCelak[J]. International Journal of Food Microbiology, 2011, 145(2/3): 464-470.
[14] 李宁,关文强,赵丽静. 丁香精油对贮藏期圣女果防腐效果初步研究[J]. 天津农学院学报,2011,18(2):16-19. Li Ning, Guan Wenqiang, Zhao Lijing. Preliminary study on clove oil preventing decay of cherry tomato during storage[J]. Journal of Tianjin Agricultural University, 2011, 18(2): 16-19. (in Chinese with English abstract)
[15] 卢彩会,牟德华. 姜黄油的抗炎镇痛及体外抗氧化活性[J]. 食品科学,2018,39(1):243-249. Lu Caihui, Mou Dehua. Antiinflammatory, analgesic and in vitro antioxidant activities of turmeric oil[J]. Food Science, 2018, 39(1): 243-249. (in Chinese with English abstract)
[16] 李亚茹,周林燕,李淑荣,等. 植物精油对果蔬中微生物的抑菌效果及作用机理研究进展[J]. 食品科学,2014,35(11):325-329.Li Yaru, Zhou Linyan, Li Shurong, et al. Antibacterial activity and mechanism of action of plant essential oils and their main components from fruits and vegetables: A review [J]. Food Science, 2014, 35(11): 325-329. (in Chinese with English abstract)
[17] 秦海燕,叶平,白凤相,等. 桉叶油对小鼠肺炎的恢复治疗作用[J]. 中国兽医杂志,2012,48(10):57-58.
[18] 妥海燕,任远,王志旺,等. 当归挥发油对哮喘BALB/c小鼠的平喘作用及对Th17免疫活性的影响[J]. 中国应用生理学杂志,2016,32(2):137-141.
[19] 杜小琴,何靖柳,秦文,等. 甜樱桃果实采后病原菌的分离鉴定及植物精油抑菌效果研究[J]. 食品工业科技,2015,36(20):339-343. Du Xiaoqin, He Jingliu, Qin Wen, et al. Isolation and identification of pathogenic bacteria forsweet cherry and antibacterial effect of plant essential oil[J]. Science and Technology of Food Industry, 2015, 36(20): 339-343. (in Chinese with English abstract)
[20] 周德庆. 微生物学实验教程[M]. 北京:高等教育出版社,2006.
[21] Gao Z L, Chen Y, Xie Y H. In vitro antimicrobial activity of essential oil from artemisia annua[J]. Food Science, 2010, 31(19): 209-211.
[22] 潘素娟,王长青,李晓东,等. 邪蒿挥发油化学成分的GC- MS分析及抑菌作用[J]. 食品科学,2011,32(24):200-203. Pan Sujuan, Wang Changqing, Li Xiaodong, et al. Chemical composition as analyzed by GC-MC and antibacterial activity of volatile oil from stems and leaves ofhiroe[J]. Food Science, 2011, 32(24): 200-203. (in Chinese with English abstract)
[23] Donato R, Santomauro F, Bilia A R, et al. Antibacterial activity of Tuscan Artemisia annua, essential oil and its major components against some foodborne pathogens[J]. LWT- Food Science and Technology, 2015, 64(2): 1251-1254.
[24] 贾会玲,黄晓德,钱骅,等. 9种植物精油及精油单体成分对黄瓜枯萎病的抑菌活性[J]. 安徽农业科学,2017,45(31):160-162.Jia Huiling, Huang Xiaode, Qian Hua, et al. Antifungal activity of nine essential oils and essential oil monomers against[J]. Joumal of Anhui Agricultural Science, 2017, 45(31): 160-162. (in Chinese with English abstract)
[25] 汤秋冶,潘道东,孙杨赢,等. ε-聚赖氨酸/海藻酸钠抗菌复合膜的制备及性能研究[J]. 中国食品学报,2016,16(12):101-107. Tang Qiuye, Pan Daodong, Sun Yangying, et al. Preparation and performance of antimicrobial films based on sodium alginate and ε-poly-L-lysine[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12): 101-107. (in Chinese with English abstract)
[26] Standard test methods for water vapor transmission of materials: ASTM E96/E96M-2016 [S]. 2016-07.
[27] 罗宁宁. 壳聚糖-肉桂精油可食性膜的制备、性能及应用研究[D]. 上海:上海应用技术大学,2016.
[28] 张荣飞,王相友. 电喷雾纳米涂膜工艺优化及其对双孢蘑菇保鲜效果[J]. 农业工程学报,2017,33(23):291-299.Zhang Rongfei, Wang Xiangyou. Process optimization of Nano-SiO2/potato starch coatings and its improving effect for storage ofby electrospraying[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(23): 291-299. (in Chinese with English abstract)
[29] 王娟,王相友,李霞. 低温气调贮藏下氧气含量对双孢蘑菇品质的影响[J]. 农业机械学报,2010,41(4):110-113. Wang Juan, Wang Xiangyou, Li Xia. Effects of oxygen concentration on storage quality ofunder low temperature and controlled atmosphere storage[J]. Transactions of the Chinese Society for Agricultural Machinery, 2010, 41(4): 110-113. (in Chinese with English abstract)
[30] 赵春霞,李大虎,程玉娇,等. 高氧气调包装对双孢蘑菇品质的影响[J]. 包装工程,2014,35(15):5-10. Zhao Chunxia, Li Dahu, Cheng Yujiao, et al. Effects of modified atmosphere packaging with O2on the qualities of. Packaging Engineering, 2014, 35(15): 5-10. (in Chinese with English abstract)
[31] 国家食品药品监督管理总局. 食品卫生微生物学检验菌落总数测定:GB/T 4789.2-2016 [S]. 北京:标准出版社,2016-12.
[32] 蓝亮美,马丽,郭占京,等. 三种桂产桉叶油对常见致腐菌的抑制作用研究[J]. 食品工业科技,2014,35(22):155-158. Lan Liangmei,Ma Li,Guo Zhanjing,et al. Study on major components and antimicrobial activities of volatile oil extracted from three kinds of eucalyptus leaves[J]. Science and Technology of Food Industry,2014,35(22): 155-158. (in Chinese with English abstract)
[33] 陶菲. 真空预冷处理延长白蘑菇贮藏期的研究[D]. 无锡: 江南大学,2006:1-70.
[34] Gormley R. Chill storage of mushrooms[J]. Journal of the Science of Food & Agriculture, 1975, 26(4): 401-411.
[35] 林河通,席玙芳,陈绍军,等. 龙眼采后生理和病理及贮运技术研究进展[J]. 农业工程学报,2002,18(1):185-190. Lin Hetong, Xi Yufang, Chen Shaojun, et al. Research advances of postharvest physiology, postharvest pathology andstorage and transport technologies for longan fruits[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2002, 18(1): 185-190. (in Chinese with English abstract)
[36] Qin Y, Liu D, Wu Y, et al. Effect of PLA/PCL/ cinnamaldehyde antimicrobial packaging on physicochemical and microbial quality of button mushroom () [J]. Postharvest Biology &Technology, 2015, 99(3): 73-79.
Inhibitory and fresh-keeping effects study of plant essential oil sodium alginate composite film on
Wang Juan, Cheng Meng, Kong Ruiqi, Lu Wenqian, Zhang Rongfei, Wang Xiangyou, Guo Yanyin
(255049)
Button mushroom () is one of the most popular mushrooms, traditionally cultivated in the world. Mushrooms are a good source of mannitol, vitamins, saccharides, organic bases and many mineral elements. However, button mushrooms only have a short shelf life, and they will lose their commercial value within a few days, due to browning, water loss, senescence and microbial attack. The short shelf-life of mushroom is an impediment to the distribution and marketing of the fresh product. Food spoilage and food poisoning caused by microbial infection during the harvesting, processing, transportation and storage of foods present an enormous threat to consumers and the development of food industry. Plant essential oil (EO) is an important volatile secondary metabolite in plants, which is well known for its high volatility, low residual generation, and very rare resistance problems. The purpose of this paper is to study the inhibitory effect of plant EOs on the main spoilage bacteria of mushroom during storage. Nine colonies were obtained by isolating and purifying the main spoilage microorganisms of mushroom. According to morphological identification, these colonies are 3 kinds of molds and 2 kinds of bacteria respectively. It was confirmed by pathogenicity test that the main pathogen of mushroom during storage was strain No. 3. The 18S rDNA sequence phylogenetic tree analysis of the pathogen showed that the pathogen No. 3 was closely related to. Four kinds of EO, which areEO (TEO),EO (FEO),EO (EEO) andEO (AEO), were used to test the antibacterial activity against the Strain No. 3. The minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of preferred EO were determined by agar disk diffusion test. The results showed that EEO has the best inhibitory effect on., followed by FEO, while TEO and AEO have no obvious inhibitory effect. The MIC and MBC of EEO were 0.3125 and 0.625L/mL, respectively. The MIC and MBC of FEO were 0.625 and 1.25L/mL, respectively. Water vapor transmission rate, oxygen permeability, tensile strength and elongation at break of sodium alginate/EEO composite film and sodium alginate single film were measured. The results show that the addition of EEO can significantly improve the gas barrier properties and mechanical properties of the membrane. The effects of four different packaging treatments on the physicochemical properties and microbial quality of mushrooms stored at 4°C for 12 d were investigated. The fresh mushrooms were packaged with the sodium alginate/EEO composite film, sodium alginate single film and PE film, and unpackaged mushrooms were used as control. The microbial levels and physicochemical properties such as weightloss, firmness, color, cell membrane permeability, and microbiological quality were measured. Although the highest weight loss (3.51%) was observed in the sodium alginate/EEO treatment at the end of storage, it was still lower than 5%. Mushrooms packaged in the sodium alginate/EEO composite film was significantly (<0.05) firmer than those packaged in the sodium alginate single film and PE film. The cell membrane permeability the odium alginate/EEO film was lower than those of the other treatments, and the browning index was similar. The sodium alginate/EEO film was more effective in reducing microbial counts of mushrooms than the other two films. The overall acceptability of mushrooms packaged in the sodium alginate/EEO film remained good and within the limit of marketability after 12 d storage. The results suggested that the sodium alginate/EEO film could effectively reduce the senescence and pathogenic decay of mushrooms. The results of this study can provide a theoretical basis for the selection of antiseptic and natural bactericidal preservatives for mushroom during storage.
pathogen; essential oils; film;; antibacterial properties; preservation
2018-09-19
2019-02-28
国家自然科学基金资助项目(31301819);山东省农业重大应用技术创新课题(鲁财农字[2014]38号);淄博市校城融合计划项目(2018ZBXC142)
王 娟,副教授,博士,主要从事农产品加工及贮藏方面研究。Email:wangjuan7912@163.com
10.11975/j.issn.1002-6819.2019.05.038
S646
A
1002-6819(2019)-05-0311-08
王 娟,程 萌,孔瑞琪,逯文倩,张荣飞,王相友,郭衍银. 植物精油海藻酸钠复合膜对双孢蘑菇的抑菌保鲜效果研究[J]. 农业工程学报,2019,35(5):311-318.doi:10.11975/j.issn.1002-6819.2019.05.038 http://www.tcsae.org
Wang Juan, Cheng Meng, Kong Ruiqi, Lu Wenqian, Zhang Rongfei, Wang Xiangyou, Guo Yanyin. Inhibitory and fresh-keeping effects study of plant essential oil sodium alginate composite film on[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(5): 311-318. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.05.038 http://www.tcsae.org
