决明子低聚糖提取工艺的响应面优化研究及其组分分析
2019-04-25贾志飞蔡为荣
贾志飞,蔡为荣
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
决明子(Cassia seed)又名马蹄子、草决明,是一种药食同源的原料,属豆科植物决明(CassiaobtusifoliaL.)或小决明(C.toraL.)的成熟干燥种子[1]。决明子味苦、甘、咸,性微寒,入肝、肾、大肠经,以具有明目之功而得名[2]。据《神农本草经》中记载,决明子“治青盲,久服益精光”。它在长江以南地区均有种植或野生,主产于安徽、浙江、四川、广东、广西等地[3]。
现代研究表明,决明子含有许多对人体有益的成分,诸如蒽醌类、萘并-吡喃-酮类、糖类、蛋白质及氨基酸类、微量元素等[4],具有降血压、降血脂、抗肿瘤、抗氧化、免疫调节、抑菌等作用[5]。国内外许多学者对决明子中的物质和成分做了一定的研究,但大多集中在蒽醌类、多糖、降脂降压作用的研究以及功能性饮料的开发上[6],对其中的低聚糖的研究相对较少。低聚糖能够促进人体肠道内双歧杆菌的增殖[7],对调节肠道菌群、提高机体健康水平具有重要作用,因此对决明子中低聚糖的研究具有很高的价值。
低聚糖的提取方法主要有水浴提取法、超声波辅助提取法、微波辅助提取法及酶法制备等[8],但是目前对决明子中低聚糖的提取工艺研究鲜有报道。因此,采用水浴醇提的方法对决明子低聚糖进行提取,通过响应面分析得到决明子低聚糖的提取工艺,使用高效凝胶渗透色谱法、离子色谱法及红外光谱法对低聚糖的组分进行了初步分析,为深入研究决明子低聚糖提供基础。
1 材料与方法
1.1 材料与试剂
决明子,产于安徽亳州;无水乙醇(AR)、浓硫酸(AR)、苯酚(AR)、CHCl3(AR)、正丁醇(AR)、葡萄糖(AR)等,均为国药集团化学试剂有限公司试剂;蒸馏水。
1.2 主要仪器
HH-2 数显恒温水浴锅(国华电器有限公司);JY1002电子分析天平(上海良平仪器仪表有限公司);RE-85Z旋转蒸发器(上海青浦沪西仪器厂);722紫外可见分光光度计(上海佑科仪器仪表有限公司);真空冷冻干燥机(美国SIM公司);IRPretige-21傅里叶变换红外光谱仪(日本岛津)。
1.3 实验方法

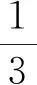
(3)低聚糖含量的测定:决明子低聚糖含量的测定采用苯酚-硫酸法[11]。
(4)单因素实验:分别考察提取温度、提取时间、乙醇浓度及料液比4个因素对决明子低聚糖得率的影响。准确称取干燥粉碎后的决明子样品10 g于250 mL三角瓶中,利用水浴醇提的方法,在提取时间90 min,料液比1∶20(g/mL),乙醇浓度20%的条件下,考察温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)对决明子低聚糖得率的影响。在提取温度50 ℃,提取时间90 min,料液比1∶20(g/mL)的条件下,考察乙醇浓度(0、10%、20%、30%、40%)对决明子低聚糖得率的影响。在提取温度50℃,提取时间90min,乙醇浓度20%的条件下,考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50)(g/mL)对决明子低聚糖得率的影响。在提取温度50 ℃,料液比1∶20(g/mL),乙醇浓度20%的条件下,考察提取时间(30 min、60 min、90 min、120 min、150 min)对决明子低聚糖得率的影响。
(5)响应面实验:依据单因素的实验结果,利用Design-Expert软件进行响应面实验设计,根据Box-Behnken原理采用四因素三水平的方法设计并进行实验,运用该软件对实验结果进行分析,根据分析结果最终确定决明子低聚糖的最佳提取条件,并在该条件下验证实验模型的可行性。
(6)决明子低聚糖的组分分离:将经Sevag法脱蛋白后的低聚糖溶液分别于500 Da、1 000 Da和2 000 Da截留规格的透析袋中透析36h后收集其组分进行真空冷冻干燥。
(7)分子量的测定:将制得的低聚糖样品溶解于流动相中,经0.22 μm微孔过滤膜过滤后采用高效凝胶渗透色谱法(HPGPC)测定其分子量。色谱条件(色谱柱:Ultra hydrogelTMLinear 300 mm×7.8 mmid×2,流动相:0.1 MNaNO3,流速:0.9 mL/min,柱温:45 ℃。)
(8)单糖组成分析:采用ICS-5000离子色谱仪(美国戴安公司)对决明子低聚糖进行单糖组成分析。色谱柱:CarboPac PA20;流速:0.5 mL/min;检测器:脉冲安培检测器。
(9)红外光谱分析:取1 mg左右真空冷冻干燥后的决明子低聚糖样品与100~200 mg充分干燥后的KBr于玛瑙研钵中研磨成细粉,经压片机压片后用傅里叶变换红外光谱仪测定,扫描波长为400~4 000 cm-1。
2 结果与分析
2.1 单因素实验
(1)提取温度对决明子低聚糖得率的影响。在提取时间90 min,乙醇浓度20%,料液比1∶20(g/mL)的条件下,考察了提取温度对决明子低聚糖得率的影响,具体如图1所示。由图1可知,决明子低聚糖的得率随着温度的升高呈现先升高后下降的趋势。在温度低于50 ℃时,低聚糖得率随温度的提升而逐渐提高,在温度高于50 ℃时,低聚糖得率随温度的提升而逐渐下降。可能的原因是,在温度较低时,温度的增加能够加快低聚糖的扩散,促进细胞中物质的溶出,因而低聚糖的得率也随之提升,而在温度过高时,不仅会对低聚糖造成破坏,还有可能引起细胞膜蛋白质的变性,影响低聚糖的溶出,从而使低聚糖的得率下降[12]。因此,选择决明子低聚糖提取的温度为50 ℃。
(2)提取时间对决明子低聚糖得率的影响。在提取温度50 ℃,乙醇浓度20%,液料比1∶20(g/mL)的条件下,考察了提取时间对决明子低聚糖得率的影响,具体如图2所示。从图2中可以看出,决明子低聚糖的得率随着提取时间的增加而逐渐提高,而在提取时间90 min后,低聚糖得率的提升幅度并不明显,由增加提取时间带来的收益并不显著,出于节约时间及能源的考虑,设定提取时间90 min为决明子低聚糖提取的最佳时间条件。

图1 提取温度对决明子低聚糖得率的影响 图2 提取时间对决明子低聚糖得率的影响
(3)乙醇浓度对决明子低聚糖得率的影响。在提取温度为50 ℃,提取时间为90 min,料液比为1∶20(g/mL)的条件下,考察了乙醇浓度对决明子低聚糖得率的影响,具体如图3所示。由图3可知,决明子低聚糖的得率随着乙醇浓度的增加呈现先升高后下降的趋势。产生此现象的原因可能是,低聚糖在不同浓度的乙醇溶液中溶解度有所不同,而且在乙醇浓度较低时,少量乙醇的存在加速了决明子组织中有机物质的溶解,促使低聚糖等物质溶出胞外,增加了低聚糖的得率,而随着乙醇浓度的进一步提高,过高的乙醇浓度可能对细胞产生一定的紧致作用,浓度越高,这种作用越强,从而抑制了低聚糖的溶出[13]。因此,选择决明子低聚糖提取的乙醇浓度为20%。
(4)料液比对决明子低聚糖得率的影响。在提取温度为50 ℃,提取时间为90 min,乙醇浓度为20%的条件下,考察了料液比对决明子低聚糖得率的影响,具体如图4所示。从图4中可以看出,在料液比1∶20(g/mL)之前,低聚糖得率明显提升,在料液比1∶20(g/mL)之后,低聚糖得率呈现缓慢降低的趋势。可能是由于在较高的料液比时,溶剂的量较少,物质的溶解扩散缓慢,不利于决明子中物质的溶解溶出,从而使低聚糖的得率较低。而随着料液比的降低,溶剂的用量增加,使得物质的溶解溶出加快,增加了低聚糖的得率,但是由于大量溶剂的使用,在制备及收集的工艺过程中,原料的损耗也随之增加,于是出现低聚糖得率小幅降低的趋势。因此,决明子低聚糖提取的最佳料液比条件为1∶20(g/mL)。
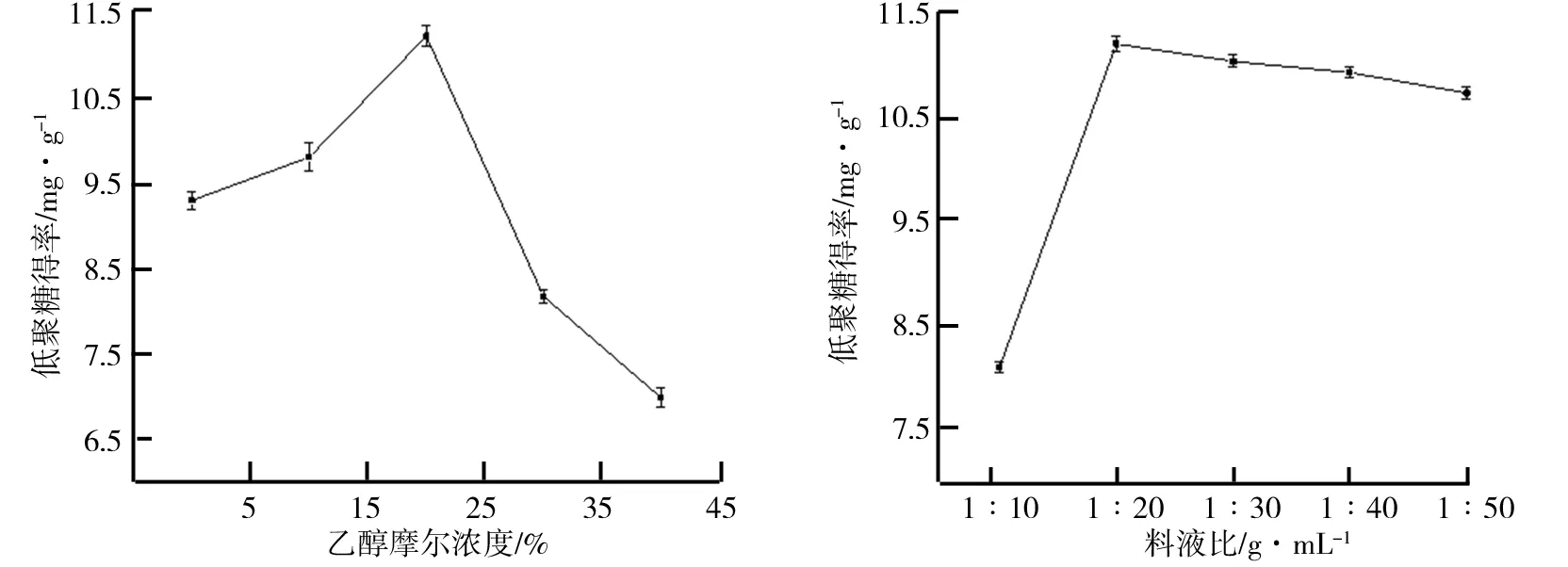
图3 乙醇浓度对决明子低聚糖得率的影响 图4 料液比对决明子低聚糖得率的影响
2.2 响应面实验分析
根据单因素的实验结果,拟定了响应面实验为提取温度、提取时间、乙醇浓度及料液比的四因素三水平的实验设计如表1所示。根据实验结果,四因素经过拟合得到多元回归方程:
低聚糖得率=+10.85+0.10×A+0.17×B+1.06×C+0.25×D+0.014×AB-0.084×AC-0.056×AD-0.027×BC+0.070×BD+0.17×CD-0.89×A2-0.32×B2-1.06×C2-0.77×D2。
决明子低聚糖提取Box-Behnken响应面实验设计及结果如表2所示。从表2中可以看出,响应面设计的实验号分为两种,其中1~24号为析因实验,25~29号为中心实验。由Design-Expert软件进行的ANOVA分析结果如表3所示。
综合表3中数据,回归方程中各因素及其组合对响应值的影响可由其显著性即P值来判断,P值越小其显著程度越高。由表3可看出该模型的P值小于0.01,达到了极显著的水平。失拟项P值大于0.05,表明失拟项不显著。在这种情况下,因素D和B2达到了显著水平,因素C、A2、C2和D2达到了极显著水平。方程的相关系数R2=0.945 5,说明94.55%的数据可以用此模型来解释,该方程的模型具有较高的拟合度。根据响应面的坡度及等高线的形状可以看出每个因素对低聚糖得率影响的强弱及因素间交互作用的显著程度[14]。在各因素水平范围内,其对低聚糖得率的影响由大到小依次为:料液比(C)、提取温度(A)、提取时间(D)、乙醇浓度(B)。各因素间交互影响的响应面及等高线图如图5所示。
表1 决明子低聚糖提取Box-Behnken响应面实验设计因素及水平
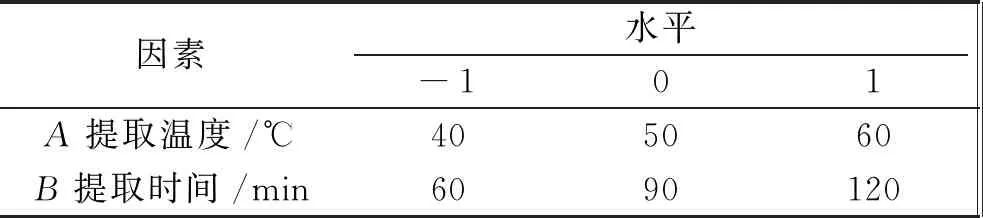
因素水平-101A提取温度/℃405060B提取时间/min6090120

因素水平-101C料液比/g·mL-11∶101∶201∶30D乙醇浓度/%102030
表2 决明子低聚糖提取Box-Behnken响应面实验设计及结果

实验号A:温度/℃B:时间/minC:料液比/g·mL-1D:乙醇浓度/%得率/mg·g-11-1-1009.19821-1009.5523-11009.8324110010.241500-1-17.6366001-19.583700-118.2228001110.8539-100-19.20110100-19.20611-10019.2561210019.037130-1-108.1211401-108.278150-11010.676

实验号A:温度/℃B:时间/minC:料液比/g·mL-1D:乙醇浓度/%得率/mg·g-116011010.72517-10-107.8071810-108.31419-10109.5562010109.728210-10-19.32222010-19.467230-1019.82224010110.24725000010.89626000011.01127000010.88628000011.00329000010.442

表3 响应面ANOVA分析结果
注:*表示显著(P﹤0.05),**表示极显著(P﹤0.01)
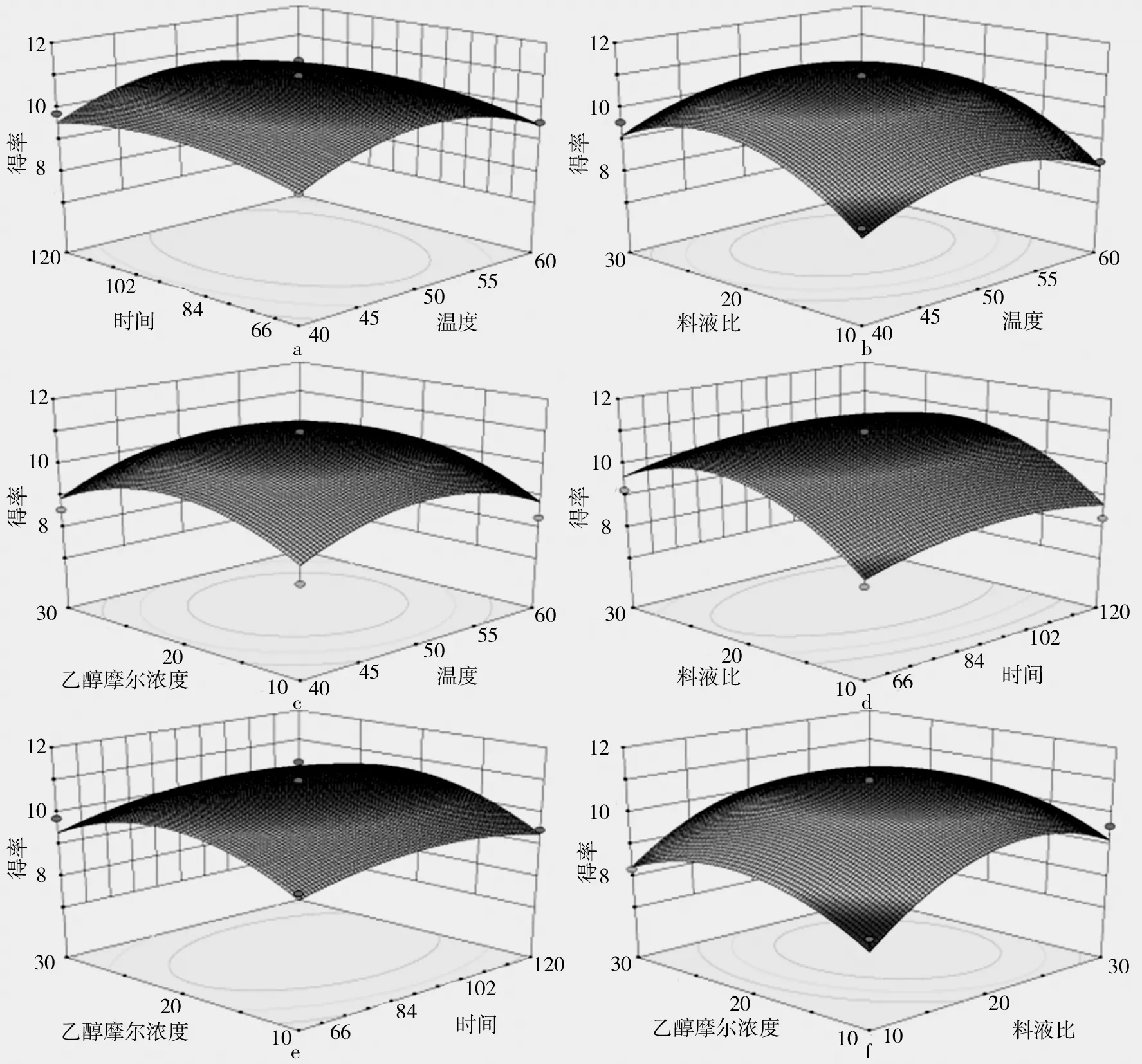
图5 各因素交互影响低聚糖得率的响应面及等高线图
根据Design-Expert软件对拟合的二次回归方程求最大值可得,决明子低聚糖提取的最佳工艺条件为:提取温度50.29 ℃,提取时间98.44 min,料液比1∶25.12(g/mL),乙醇浓度22.32%,在此条件下决明子低聚糖的理论预测得率为11.175 mg/g。考虑到实验的实际操作及便利性,故而修正最佳工艺条件为:提取温度50 ℃,提取时间100 min,料液比1∶25(g/mL),乙醇浓度22%。以此条件进行3次重复实验的低聚糖得率分别为11.131 mg/g、11.165 mg/g、11.157 mg/g,计算平均得率为11.151 mg/g,与理论预测值11.175 mg/g接近,说明采用Box-Behnken作为响应面模型能较好地预测决明子低聚糖的实际提取效果,具有一定的可行性和实际应用价值。
2.3 决明子低聚糖的分子量分析
通过500 Da、1 000 Da和2 000 Da 3种规格的透析袋透析36 h后得到3种决明子低聚糖组分,分别命名为COSA、COSB和COSC。3种组分通过HPGPC的检测结果如图6、图7、图8所示。

图6 决明子低聚糖组分COSA分子量色谱图 图7 决明子低聚糖组分COSB分子量色谱图

图8 决明子低聚糖组分COSC分子量色谱图
3种决明子低聚糖组分COSA、COSB和COSC的重均分子量Mw分别为593、1 112和4 036,数均分子量Mn分别为405、965和2 399,其中Mw/Mn的值表示聚合物分子量的多分散性(PD),其数值越接近1表明分子量分布越均匀,物质越单一,反之则表明物质分子量分布宽泛,物质不均匀。由检测结果计算可知COSA、COSB和COSC的PD值分别为1.46、1.15、1.68,表明相对于COSC来说,COSA和COSB的分子量分布较为集中,物质纯度较高,而COSC则分子量分布宽,物质纯度较低。同时也说明,采用透析的方法能较好地将决明子低聚糖中不同分子量大小的组分进行分离。
2.4 单糖组成分析
以Fucose、Rhamnose、Arabinose、Galactose、Glucose、Xylose、Mannose、Fructose等8种单糖作为标准品检测COSA、COSB及COSC中的单糖组成,检测结果如图9、图10、图11及表4所示。
从图9、图10、图11中可以看出,COSA、COSB及COSC 3种决明子低聚糖组分均由4种单糖组成,分别为鼠李糖、阿拉伯糖、半乳糖及葡萄糖,其中组分COSA中4种单糖组成的摩尔百分比分别为0.46%、3.28%、56.95%和39.31%,组分COSB中4种单糖组成摩尔百分比分别为0.48%、3.64%、50.31%和45.57%,组分COSC中4种单糖组成摩尔百分比分别为0.24%、1.91%、55.07%和42.78%。由表4可知,3个组分中单糖组成占比最高的是半乳糖,均在50%以上。其次是葡萄糖,两者共占比在95%以上,是决明子低聚糖单糖组成的主要组分。鼠李糖和阿拉伯糖含量较少,其中以鼠李糖含量最少。半乳糖含量从高到低的组分依次是COSA>COSC>COSB;葡萄糖含量从高到低的组分依次是COSB>COSC>COSA。由此可知,决明子低聚糖的3个组分COSA、COSB和COSC的组成单糖种类相同,含量不同。同时可知,决明子低聚糖是以半乳糖和葡萄糖为主要单糖组成的低聚糖。
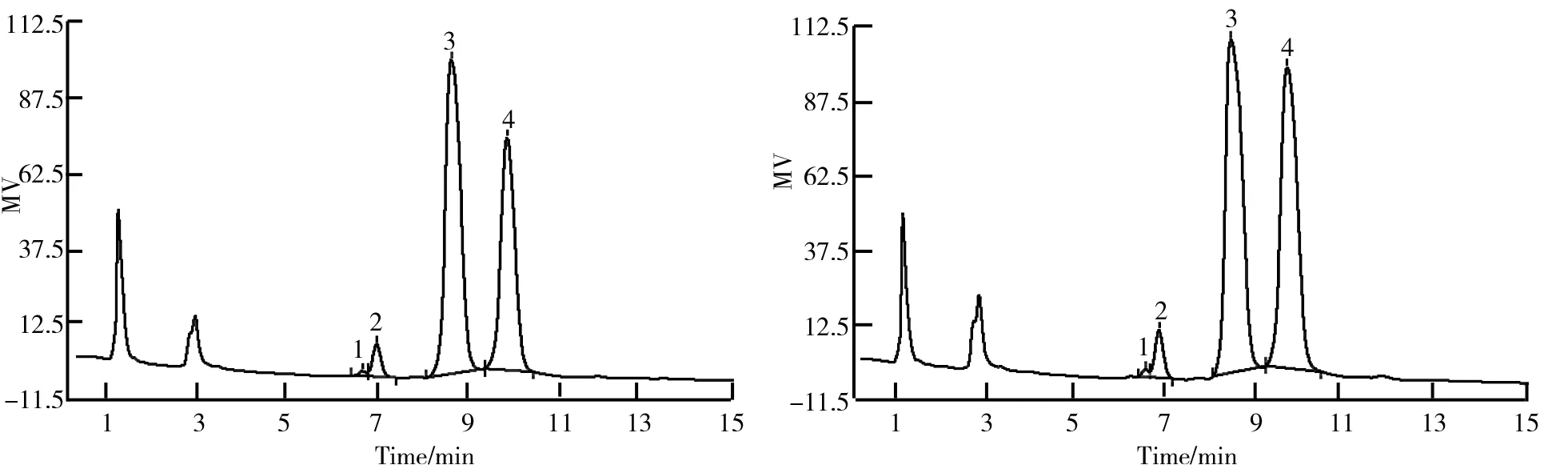
图9 决明子低聚糖组分COSA离子色谱图 图10 决明子低聚糖组分COSB离子色谱图
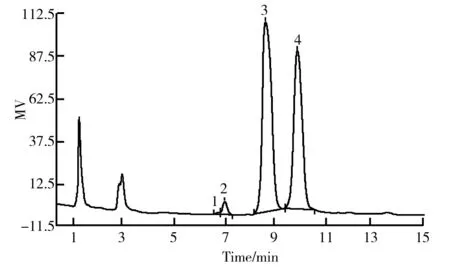
图11 决明子低聚糖组分COSC离子色谱图
表4 决明子低聚糖各组分单糖组成

组分单糖组成/摩尔百分比,%鼠李糖阿拉伯糖半乳糖葡萄糖COSA0.463.2856.9539.31COSB0.483.6450.3145.57

组分单糖组成/摩尔百分比,%鼠李糖阿拉伯糖半乳糖葡萄糖COSC0.241.9155.0742.78
2.5 红外光谱分析
由3 000~2 800 cm-1的C-H伸缩振动和1 400~1 200 cm-1的C-H变角振动两组糖类特征峰,可以确定此化合物为糖类化合物[15]。
决明子低聚糖组分红外光谱图如图12所示。决明子低聚糖组分的红外光谱分析如表5所示。对于呋喃环糖类化合物而言,937 cm-1、877 cm-1及818 cm-13个峰为呋喃环特征峰,结合图12可知该糖类化合物并不符合呋喃型的特征。同时,吡喃环的非对称伸缩振动所造成的C-O-C骨架振动也在875 cm-1附近出现吸收峰,而α-D-葡萄吡喃糖类化合物中的这个峰相对于β-型是比较强的。半乳吡喃糖在875 cm-1附近同样会有吸收峰,这是由C2和C4位上赤道键构型的C-H变角振动所造成的。故而可以判断该低聚糖为吡喃型。结合单糖组成的分析可以推断,3种决明子低聚糖组分主要是由α-D-吡喃半乳糖和α-D-吡喃葡萄糖组成。

图12 决明子低聚糖组分红外光谱图
表5 决明子低聚糖组分的红外光谱分析

波长/cm-1备注3600~3200此处的宽峰是糖类化合物O-H的伸缩振动,3425cm-1是糖类分子间氢键的吸收峰3000~2800糖类的特征吸收峰,2937cm-1为糖类化合物C-H的伸缩振动1795糖类化合物C-H的伸缩振动1650~1600此范围为结晶水的吸收范围,故1637cm-1为结晶水的吸收峰1400~1200此范围吸收峰为糖类化合物C-H的变角振动1200~1000此范围吸收峰是糖类化合物C-O的伸缩振动,其中1149cm-1为C-O-H的伸缩振动,1090cm-1为C-O-C的伸缩振动
3 结论
运用Box-Behnken响应面分析法对决明子低聚糖的提取工艺进行优化,得到决明子低聚糖提取的最佳工艺为:提取温度50 ℃,提取时间100 min,料液比1∶25(g/mL),乙醇浓度22%,低聚糖的平均得率为11.151 mg/g。通过500 Da、1 000 Da和2 000 Da 3种规格的透析袋进行组分分离得到数均分子量Mn分别为405 Da、965 Da及2 399 Da的3种组分。通过离子色谱分析可知,3种低聚糖组分的单糖组成种类相同而含量存在差异,且均以半乳糖和葡萄糖为主要单糖组成。结合红外光谱分析可以初步推测,决明子低聚糖主要是以α-D-吡喃半乳糖和α-D-吡喃葡萄糖组成的低聚糖。研究结果为决明子低聚糖的进一步研究提供了基础,同时为其他植物低聚糖的提取研究提供了一定的参考。
